人脐带间充质干细胞条件培养基对缺氧胰岛的保护作用
2018-07-23伍君子马小倩杨策军容鹏飞
伍君子,马小倩,杨策军,容鹏飞,聂 唯,王 维
(中南大学湘雅三医院细胞移植与基因治疗中心,中国湖南长沙410013)
缺氧是移植胰岛细胞团面临的重大挑战。一方面,经分离提纯后离断动静脉的胰岛细胞团仅靠表面氧弥散作用无法满足细胞团中心的血氧供应[1~3],而具有分泌作用的β细胞恰好分布于细胞团中心部分。另一方面,缺氧导致细胞坏死的同时会引发炎症,导致周边腺泡杂质额外耗氧量升高,从而加剧缺氧;同时在移植早期,立即经血液介导的炎症反应(instant blood-mediated inflammatory reaction,IBMIR)会在细胞团表面形成微血栓,激活的补体引发血小板级联瀑布反应,进一步加剧胰岛缺氧[4~6]。因此,体外培养及移植早期是胰岛细胞缺氧最严重的时期,70%的移植胰岛会在这一阶段死亡[7,8]。此外,有研究证实早期低氧暴露可能导致人类胰岛细胞基因标记的持续变化和胰岛素分泌的持久损失[9,10],而且即使不在缺氧核心部位,存活的缺氧胰岛也表现为功能不佳或无功能。因此,在体外培养及移植早期采取干预措施,提高胰岛细胞应对缺氧能力,直接关系到胰岛的存活及移植胰岛的功能。
大量文献报道,间充质干细胞(mesenchymal stem cells,MSCs)与胰岛细胞共培养或共移植有利于保存胰岛的活性,提高胰岛功能[11~16]。近期研究认为MSCs的旁分泌作用在其中占据重要地位[17],但关于MSCs对胰岛细胞的缺氧损伤保护机制尚缺乏直接关注。本实验选择免疫原性低且已有研究证明确能通过异体移植改善非人类灵长类动物糖尿病的新生猪胰岛细胞团(neonatal porcine islet cell clusters,NICCs)[18]为细胞供体,以体积分数为1%的O2模拟移植后肝窦内缺氧环境,从细胞得率、死亡方式、线粒体呼吸链功能、糖刺激应对能力等方面探讨富含人脐带间充质干细胞旁分泌细胞因子的条件培养基(human umbilical cordderived MSC-conditioned medium,hu-MSC-CM)对缺氧胰岛的保护作用。
1 材料与方法
1.1 NICCs的获取
出生3~5 d的无特定病原体(specific pathogenfree,SPF)猪由湖南赛诺生物科技股份有限公司提供。按照本实验室前期建立的方法[19]将供体胰腺进行消化、分离及纯化得到NICCs。
1.2 hUC-MSCs的分离和鉴定
经医院伦理委员会批准,脐带由中南大学湘雅三医院健康产妇分娩后自愿捐赠。采用组织块贴壁法[20]分离hUC-MSCs,待原代细胞融合面积达50%时弃上清与组织,传代纯化。取P3~5代hUC-MSCs的细胞悬液,加入鼠抗人单克隆抗体异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-CD73、FITC-CD105、FITC-CD90、藻红蛋白(phycoerythrin,PE)/花菁染料(cyanine dye,Cy)5-CD45(白细胞共同抗原)、PE-HLA-DR(白细胞相关抗原),利用荧光激活细胞分类器(fluorescence activated cell sorter,FACS)检测细胞表面标志物。
1.3 人脐带干细胞源条件培养基的收集
将P3~5代hUC-MSCs置于含10%(体积分数)猪血清的RPMI1640培养基(Gibco公司,美国),常氧培养至细胞融合达90%时,改为不含血清的RPMI1640培养基继续培养。48 h后收集细胞上清,超速离心逐步去除悬浮细胞、死亡细胞、细胞碎片及凋亡小体等。将上清用0.22 μm滤器过滤,获得hu-MSC-CM。-80℃冷冻保存备用。
1.4 实验细胞分组
实验组:NICCs用含10%(体积分数)猪血清、30%hu-MSC-CM的RPMI1640培养基培养。对照组:NICCs用含10%猪血清的RPMI1640培养基培养。将实验组及对照组细胞分别置于常氧(20%O2、37 ℃、5%CO2)和缺氧(1%O2、37 ℃、5%CO2)的培养箱中培养3 d,随后收集细胞,进行数量、活力及功能检测。
1.5 胰岛细胞数量的测定
收集常氧及缺氧培养的各组NICCs悬液50 μL,光镜下检测胰岛细胞团数量并测量其直径,同时将结果换算为胰岛细胞当量(islet equivalent,IEQ)。各组取50 mL胰岛细胞悬液至冰上裂解、超声波破碎后,采用 BCA法对各组裂解的蛋白质样品进行定量检测,并将测量值设为总蛋白质含量。
1.6 AO/EB染色检测胰岛细胞凋亡
每组取1 000 IEQ胰岛细胞悬液离心后重悬至细胞终浓度为1×105/mL。取100 μL细胞悬液加入96孔板内,加入4 μL吖啶橙(acridine orange,AO;美国Amresco公司)和溴乙啶(ethidium bromide,EB;美国Sigma公司)等量混合染料后,置于荧光显微镜下观察,从形态学方面检测胰岛细胞凋亡。
1.7 胰岛β细胞的活性检测
采用FACS检测胰岛β细胞的活性。取每组NICCs 500~2 000 IEQ并离心、消化为单个胰岛细胞,加入1 mL培养基重悬。随后加入4 mL Newport Green及1 mL 7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)染色液避光孵育,染色完成后进行流式细胞检测。数据用WinMDI 2.9软件分析。
1.8 胰岛β细胞的功能分析
采用Seahorse线粒体应激实验评价胰岛β细胞的功能变化。将Seahorse XF细胞线粒体应激测试试剂盒(Seahorse Bioscience公司,美国)的检测板提前一天水合,各组胰岛细胞重悬后按每孔200 IEQ种植在胰岛捕获板上,无CO2培养箱中孵育1 h后置于生物能量代谢监测仪上。预设程序依次加入葡萄糖、寡霉素(ATP合酶抑制剂)、氰化物4-苯腙(线粒体呼吸链解偶联剂)、抗霉素A/鱼藤酮(线粒体呼吸链复合物抑制剂)。测试结束后收集细胞,测量其DNA含量。
1.9 Western-blot检测胰岛细胞在缺氧环境下蛋白质水平的表达情况
将实验组及对照组细胞置于缺氧条件下培养24 h、48 h后,取50 mL各组胰岛细胞悬液离心,加入RIPA细胞裂解液,并进行冰上裂解及超声波破碎。离心后采用BCA法对各组裂解的蛋白质样品进行定量检测并调至等浓度。将蛋白质样品与loading buffer煮沸变性以后,通过SDS-PAGE电泳将等体积等质量的蛋白质样品中不同相对分子质量的目标蛋白进行分离,并以200 mA电流将凝胶上的蛋白质电转到PVDF膜上。以含5%的脱脂奶粉室温封闭2 h后,加入已按相关抗体说明书成比例稀释的HIF-1α(美国Novus Biologicals公司)、受体相互作用蛋白3(RIP3,美国Santa Cruz公司)、cleaved-caspase 3(美国 Cell Signaling Technology公司)、p-腺苷酸活化蛋白激酶(p-AMPK,美国 Cell Signaling Technology 公司)、LC3(美国Sigma公司)的一抗,孵育过夜,再进行辣根过氧化物酶标记的二抗孵育,随后以超敏增强化学发光法(enhanced chemiluminescence,ECL)试剂盒显色。样本结果用β-actin条带作为内对照校正。
1.10 统计学分析
数据以平均值±标准差(x±s)表示,采用Graphpad prism 7.0统计学软件进行统计分析,两组间比较采用独立样本t检验,多组比较采用单因素方差分析。数据分析取P<0.05为显著性检验水准。
2 结果
2.1 hUC-MSCs鉴定
纯化后P3~5代hUC-MSCs呈旋涡状生长,细胞表面高表达基质细胞抗原CD73、CD105、CD90(≥95%),基本不表达CD45和HLA-DR(≤1%)。检测结果见图1。
2.2 hu-MSC-CM能减少缺氧环境下NICCs的得率损失
常氧及缺氧环境下hu-MSC-CM组胰岛细胞数差异和总蛋白质减少量都明显小于对照组(RPMI1640),且均有统计学差异(P<0.05,表1),说明hu-MSC-CM对缺氧造成的NICCs得率损失具有保护作用。
2.3 hu-MSC-CM能保护缺氧环境下NICCs的活性
对缺氧环境下培养3 d的两组胰岛细胞进行AO/EB染色,结果显示:缺氧条件下,两组NICCs的体积均变小,周围见较多细胞碎片,胰岛细胞橘红色荧光明显较常氧组胰岛细胞强,其中对照组更显著(图2A)。以上信息说明对照组胰岛细胞对缺氧反应更为敏感,细胞活性减退明显。
流式结果显示,缺氧条件下实验组、对照组中活的β细胞(Newport Green染色阳性、7-AAD染色阴性)比例分别为65.2%±7.0%、45.7%±5.1%,且实验组细胞在常氧、缺氧条件下产生的活β细胞比例差异较对照组明显缩小(P<0.001,图2B)。这说明hu-MSC-CM培养的NICCs对抗缺氧能力更强,hu-MSC-CM对缺氧环境下的NICCs具有一定的保护效果。
2.4 hu-MSC-CM能保护缺氧环境下NICCs的功能
缺氧培养3 d后进行细胞外通量分析,结果显示缺氧环境下两组细胞中线粒体应激指标:应对糖刺激反应(图 3A)、ATP 产量(图 3B)、基础耗氧量(图3C)、最大的呼吸储备能力(图3D)较常氧状态均明显减低,且对照组降低更为显著,特别是在基础耗氧量这一指标上,hu-MSC-CM组显著高于对照组[62.43±19.64 pmol/(min·μg DNA)vs.32.61±18 pmol/(min·μg DNA),P<0.001]。上述结果说明在缺氧状态下,hu-MSC-CM能显著改善胰岛细胞的线粒体呼吸功能。

图1 hUC-MSCs表面标记物的流式细胞检测结果Fig.1 Detection of the hUC-MSCs surface protein expression by FACS
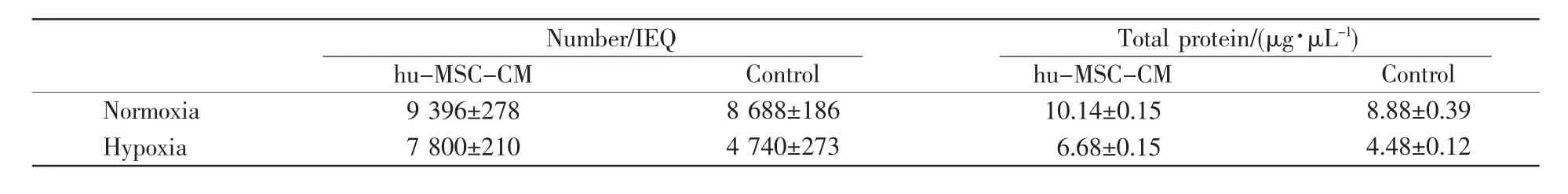
表1 常氧、缺氧环境下不同培养基组NICCs数量变化情况Table 1 Changes of the number of islet cells cultured with different media under normoxic and hypoxic conditions
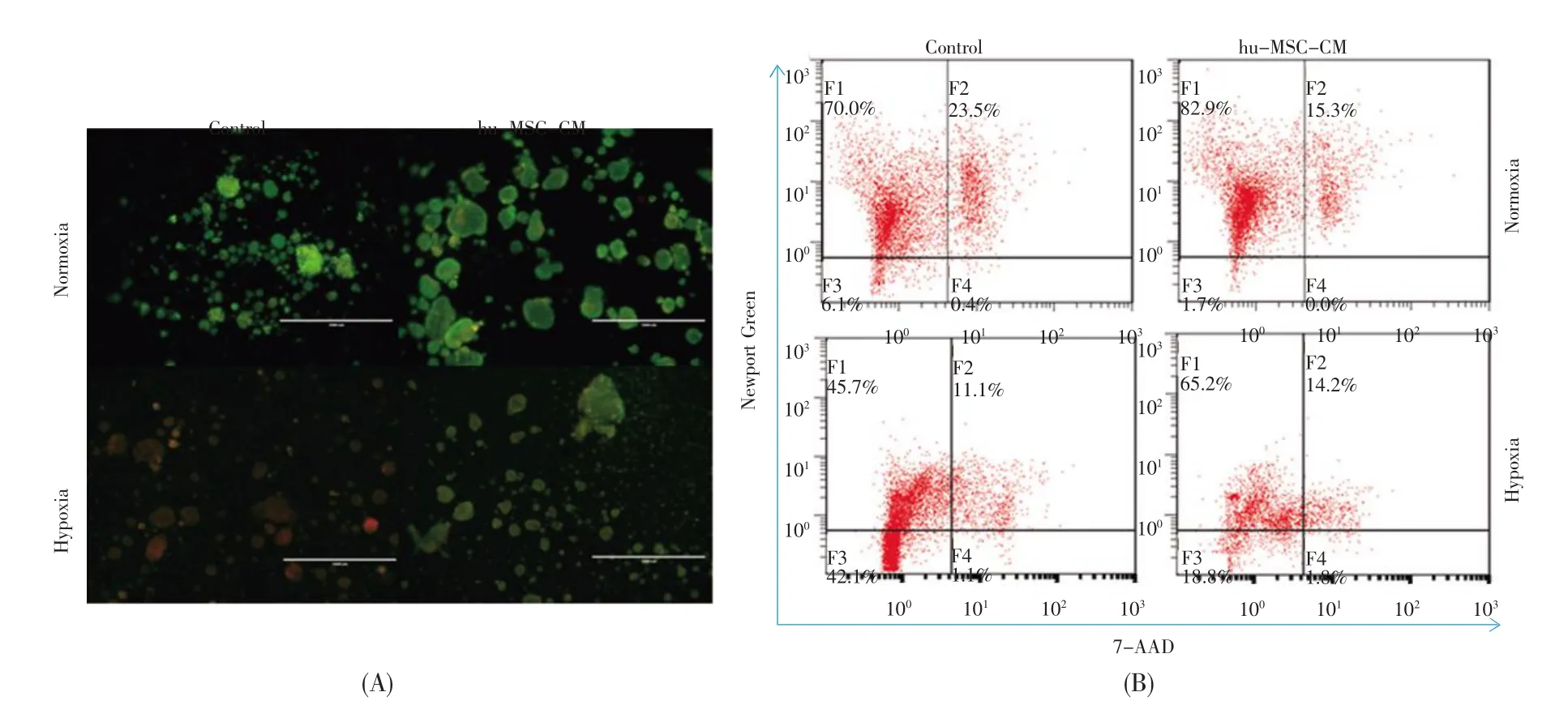
图2 正常或缺氧环境下不同培养基培养的胰岛细胞活性检测结果(比例尺:1 000 μm)(A)AO/EB染色。活细胞核染色质着绿色,死亡细胞核染色质着橘色,早期凋亡细胞核染色质着绿色并呈固缩状,继发性坏死细胞核染色质着橘色并呈固缩状;(B)Newport Green/7-AAD流式细胞检测结果。Fig.2 Viability of islets cultured with different media under normoxic or hypoxic conditions(scale bar:1 000 μm)(A)AO/EB staining.Living cells:Nuclear chromatins are green;Dead cells:Nuclear chromatins are orange;Early apoptosis cells:Nuclear chromatins are green and condensation;Secondary necrosis cells:Nuclear chromatins are orange and condensation.(B)FACS for Newport Green/7-AAD.

图3 不同培养基培养的NICCs在常氧及缺氧环境下的细胞外通量分析A:葡萄糖;B:寡霉素;C:氰化物 4-苯腙;D:抗霉素 A/鱼藤酮。Fig.3 Extracellular flux analysis of NICCs cultured in different media under normoxic or hypoxic conditionsA:Glucose;B:Oligomycin;C:FCCP;D:Antimycin A and rotenone.
2.5 hu-MSC-CM对缺氧条件下凋亡、自噬及缺氧耐受相关蛋白质表达的调节作用
缺氧24 h时,实验组中HIF-1α的表达量与对照组相比,差异不大;缺氧48 h后,HIF-1α在实验组中的表达水平较对照组明显增加,且48 h的表达量较24 h升高。但是,与实验组相比,对照组的NICCs中细胞凋亡上游调控因子RIP3和cleaved-caspase 3的表达在24 h内增强,说明实验组与对照组相比,凋亡降低。同时,与对照组相比,实验组磷酸化AMPK和LC3 I/II比值降低,说明实验组自噬发生较少,这也提示实验组NICCs的周围微环境比较好(图4)。
3 讨论
胰腺β细胞是人体内代谢活性最强的细胞之一,它高度依赖ATP合成的氧化代谢,而细胞内抗氧化酶表达水平却较低,这使得β细胞对缺氧损伤高度敏感[21~23]。β细胞独特的糖酵解通量与线粒体氧化活性直接相关[21,24]。在本研究中,我们也从低氧环境中胰岛细胞的糖刺激反应能力、ATP释放量、线粒体基础耗氧量及呼吸储备能力方面,证明了缺氧能通过破坏线粒体呼吸链,损伤胰岛细胞功能(图3)。经分离纯化处理后的胰岛细胞一般成团存在,且不再具有正常生理状态下的动静脉系统,仅能通过弥散作用从培养基中获氧,而这种氧弥散作用会随细胞团直径的增加递减,使得细胞团中心的β细胞更易发生缺氧损伤甚至坏死。同时为了提高新生猪胰岛细胞的成熟度,延长胰岛细胞体外培养时间至一个星期以上甚至一个月是必不可少的[25],这又将给氧含量偏低的胰岛细胞团带来更为严峻的缺氧挑战。实验中我们也发现,胰腺分离培养6 d后剩余胰岛细胞团的直径大多集中在50~150 nm,即使常氧条件下隔天换液,AO/EB染色仍可以看出较大胰岛细胞团不可避免地出现了死亡,且以中心区域最为明显(图2A)。
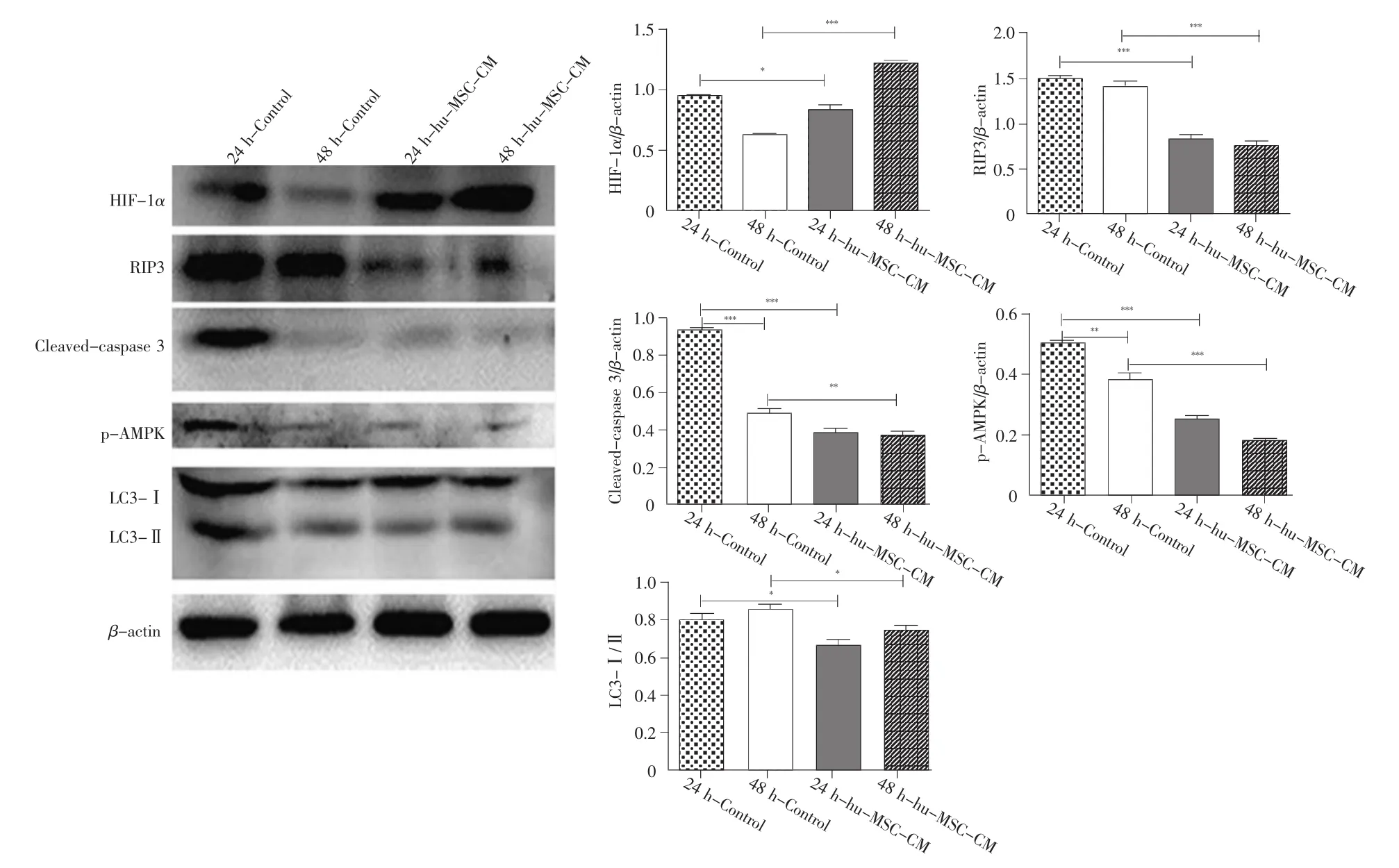
图4 缺氧环境下不同培养基培养的胰岛细胞中生存信号蛋白质的Western-blot分析Fig.4 Western-blot analysis of survival signal proteins in NICCs cultured with different media under hypoxic conditions*P<0.05,**P<0.01,***P<0.001.
为缓解体外培养及移植早期氧化应激对高代谢活性的β细胞存活及功能的双重打击,部分研究提出干细胞与胰岛细胞共培养或体内联合移植。但将具有增殖性的细胞群移植至活体内会产生免疫相容性、致瘤性、栓子形成及感染传播等风险;并且与MSCs共同培养也存在细胞需求量大、培养周期不同步、移植时增大门脉栓塞风险等诸多弊端;此外,间接接触培养在培养体系、换液污染等方面更是提出了很多新问题。所有这些使得共培养或联合移植模式仅停留在实验阶段,不能大规模应用于临床。越来越多的实验证明,MSCs改善受损细胞增殖和活力、免疫调节及抗炎活性的主要作用机制是通过旁分泌实现的[26,27]。目前,关于MSCs旁分泌直接协助胰岛抗缺氧的作用机制仍不明确。缺氧条件下,我们通过加入30%hu-MSC-CM条件培养基,发现可有效减少胰岛细胞死亡、提高细胞活性和功能(图2、图3),这可能是干细胞分泌物抗炎、促细胞修复、促再血管化和抗凋亡的共同作用。同时与直接使用干细胞移植相比,干细胞条件培养基规避了增殖性活体细胞群的免疫、致瘤风险,且无需使用具有潜在毒性的冷冻剂。后期我们还可以通过受控实验室条件下量身定制的细胞系进行大规模生产,用类似于常规药剂的方式评估源于MSCs的分泌物 (如细胞因子、趋化因子等)的安全性、剂量和效力,并为现成的分泌物用于急性病症的治疗提供可能,使其在临床应用中更经济实用。
另外,实验中对照组RIP3(凋亡终产物)、cleaved-caspase 3(凋亡、坏死通路的共同上游因子)在缺氧24 h内同步升高,但在48 h时间点内RIP3继续升高,而cleaved-caspase 3升高趋势减缓(图4),提示24 h后缺氧细胞的主要死亡方式是坏死,这与文献报道[28]一致。缺氧48 h时,对照组胰岛细胞中LC3Ⅰ/Ⅱ (自噬蛋白)表达升高,而其上游因子p-AMPK的表达水平反而下降,同时实验组p-AMPK和LC3Ⅰ/Ⅱ比值降低(图4),这说明缺氧可能还激发了其他自噬通路的上游因子,而hu-MSC-CM能通过分泌的生物活性物质改善缺氧胰岛自噬。此外,我们前期实验发现,缺氧24 h后细胞器结构肿胀、细胞变圆、胞膜破裂、内容物外溢,介导程序性坏死的RIP3升高。我们猜测缺氧引发的胰岛细胞死亡可能也是程序性坏死。这与其他研究提出的长期缺氧会降低胰岛线粒体氧化磷酸化水平,并导致胰腺β细胞坏死[29]的结果一致。
近年来关于MSCs的旁分泌效应在修复组织器官损伤(如皮肤创伤[30]、心血管损伤[31,32]、脑损伤[33]等)、器官移植[34]、肿瘤治疗[35]等方面展现出了较大的临床治疗潜力。但我们也注意到MSCs的外泌体在肿瘤耐药性、免疫逃逸、转移等方面也起着一定的作用[36]。而且,不同来源及不同周围微环境的MSCs蛋白质分泌组及治疗潜力有所差异[37,38]。所以,我们下一步可针对干细胞详细分泌谱展开研究,为单独应用MSC-CM中的营养因子或组合进行无细胞治疗、疾病定向治疗提供更多可能性。
