紫外照射下氧氟沙星在蒙脱石悬浮液中的去除研究
2018-07-21黄晓丹饶艳英吴丹丹赖贵满陈国平
黄晓丹,饶艳英,吴丹丹,赖贵满,陈国平
(1.莆田学院 环境与生物工程学院,福建 莆田351100;2.福建省新型污染物生态毒理效应与控制重点实验室,福建 莆田351100)
氟喹诺酮类抗生素是广谱抗菌药,具有易于口服的优点,因而在临床医学、水产养殖以及畜禽疾病防治等方面得到了广泛应用[1].但氟喹诺酮类抗生素通常在生物体内大约只有20%~80%会代谢和降解,剩余药物将会随尿液和粪便排出体外,进入环境[2].近年来,国内外均报道了在城市污水[3]、自然水体[4-5]、水体沉积物[6-7]以及土壤[8]中发现氟喹诺酮类抗生素.而氟喹诺酮类抗生素在环境中的滞留和积累将导致环境中生物的耐药性增强,加大环境风险.传统的生物污水处理工艺无法有效地去除氟喹诺酮类抗生素,因此研究安全有效地去除水体中氟喹诺酮类抗生素技术具有重要意义.
蒙脱石(KSF)是层状硅酸盐粘土矿物,是土壤粘土的主要成分之一,也是大气、水体中漂浮颗粒物和沉积物的重要组成,在自然界里广泛存在.由于特殊的物化结构,具有较高的离子交换容量和吸水膨胀能力,蒙脱石作为一种环境友好型矿物材料在环境污染治理中得到了广泛应用[9-10].本实验以氧氟沙星(OFLX)作为氟喹诺酮类抗生素代表,研究其在紫外光照下蒙脱石悬浊液中的去除情况及其影响因素.
1 材料与方法
1.1 主要仪器及试剂
电子天平(Cp213,上海奥斯),紫外分光光度计(UVmini-1240,岛津)、酸度计(pHS-2S,上海伟业),254 nm紫外灯(北京博朗特),离心机(TDL80-2B,上海安亭).
KSF、OFLX(98%)购自上海晶纯有限公司,30%H2O2、NaOH、NCl、C3H8O 等所有试剂均为分析纯,实验用水为纯水.
1.2 实验方法
配制一定浓度的OFLX与KSF的混合溶液,调整实验所需参数,以24 W主波长254 nm紫外灯作为光源进行照射反应,间隔30 min取样,所取样品在4 000 r·min-1的离心机中离心30 min后取上清液过0.45 μm滤膜后,用UVmini-1240紫外分光光度计于OFLX的最大吸收波长296 nm处测其吸光度,而后进行去除率计算.
OFLX的去除率计算如下:
去除率=[(C0-Ct)/C0]×100%.
式中:C0—OFLX初始浓度,单位mg/L;Ct—反应t时刻时OFLX浓度,单位mg/L.
2 结果与分析
2.1 对照试验
在OFLX=20 mg/L,KSF=0.1 g/L,H2O2=8 mL/L,pH=7.0,紫外光照为24 W的实验条件下进行了系列对照试验.实验结果如图1所示.UV/KSF/H2O2体系中OFLX的降解率最大,达到84.6%.其它体系如单独UV、单独KSF、UV/H2O2、UV/KSF、KSF/H2O2对 OFLX的降解率均不如 UV/KSF/H2O2体系.蒙脱石 KSF对OFLX有一定的吸附去除作用,反应240 min后,OFLX吸附去除率达44.3%.单独UV照射对OFLX去除率只有7.3%,UV/H2O2体系对OFLX去除率也只有25.8%.UV/KSF/H2O2体系对OFLX的去除率高于体系中各因素的单独作用之和,由此可见各因素之间存在着一定的协同作用.
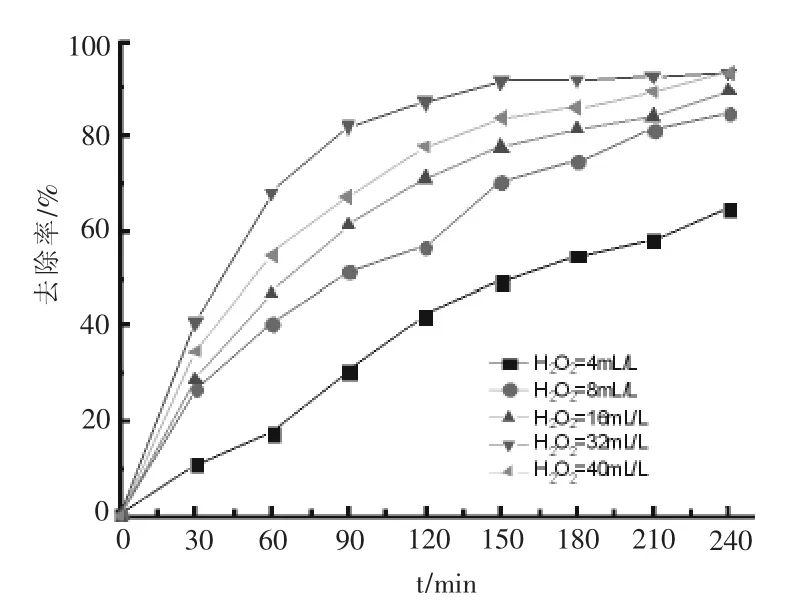
图1 OFLX在不同体系中的去除效果
2.2 H2O2的影响
在OFLX=20 mg/L,KSF=0.1 g/L,pH=7.0,紫外光照为24 W的实验条件下考察H2O2投加量影响,实验结果如图2所示.起初随着H2O2投加量增加,OFLX去除率随之显著提高,当H2O2投加量从4 mL/L增加到8 mL/L时,OFLX去除率从64.6%增大到84.6%.但随着H2O2投加量进一步增加,H2O2投加量从8 mL/L增加到40 mL/L时,OFLX去除率只是略有提高,从84.6%增加到93.4%.H2O2在紫外照射和蒙脱石KSF中铁成分[11-13]催化下均会产生强氧化性的OH·自由基.OH·自由基可氧化降解OFLX,但过量的H2O2反而会猝灭体系中的OH·自由基,从而使体系对OFLX的去除率难以进一步提高.
2.3 KSF的影响
在OFLX=20 mg/L,H2O2=8 mL/L,pH=7.0,紫外光照为24 W的实验条件下考察KSF投加量影响,实验结果如图3所示.随着KSF投加量逐渐增加,OFLX去除率先升高而后下降.当KSF投加量从0.02 g/L增加到0.1 g/L时,OFLX去除率从32.6%增加到84.6%,而后进一步提高KSF投加量到0.5 g/L,OFLX去除率反而下降为32.5%.KSF能吸附一定量的OFLX,同时由于KSF含有微量铁[9-10],可以催化H2O2产生OH·自由基,因而一定范围内KSF投加量增加可以使OFLX去除率随之提高.但当KSF浓度过高,一方面降低了溶液的透明度,影响体系对紫外光的利用效率,另一方面高浓度的KSF在溶液中容易发生团聚,也进一步降低了OFLX的去除率.
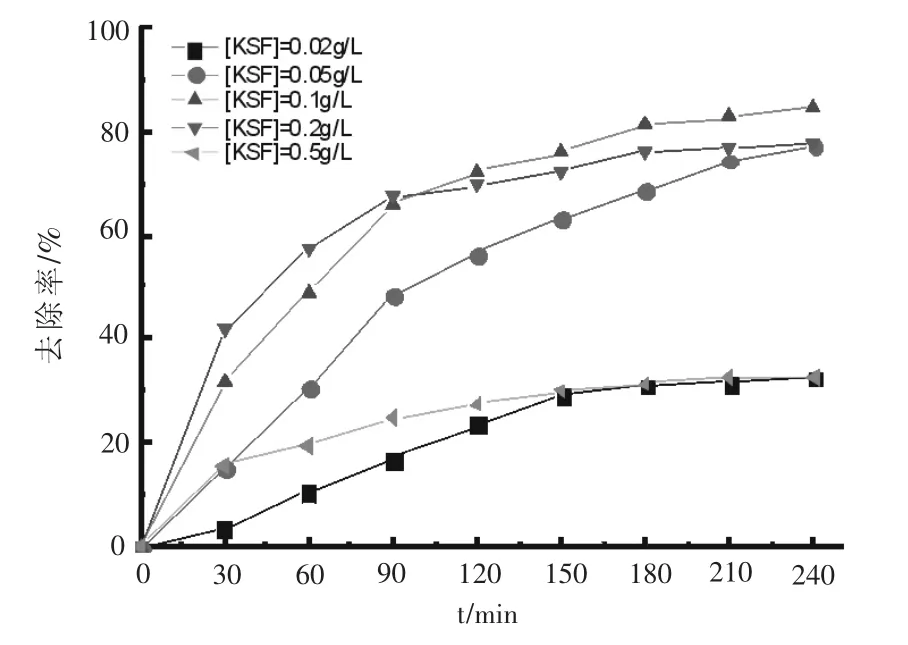
图3 KSF投加量对OFLX去除率的影响
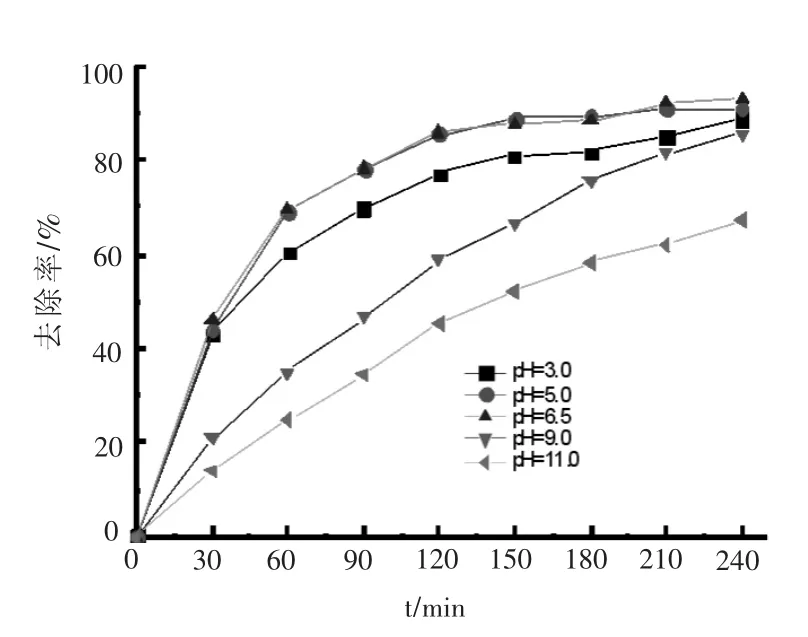
图4 溶液pH值对OFLX去除率的影响
2.4 溶液pH值的影响
在OFLX=20 mg/L,H2O2=32 mL/L,KSF=0.1 g/L,紫外光照为24 W的实验条件下考察溶液pH的影响,实验结果如图4所示.在溶液初始pH值为3.0、5.0和7.0时,OFLX去除率分别为88.9%、90.1%和93.1%.但随着溶液初始pH值进一步增加,从9.0到11.0,OFLX去除率随着pH值的增加而减小,从85.6%降低到67.1%.究其原因,强氧化性的OH·自由基是体系去除OFLX的主要氧化剂,而在碱性条件下OH·自由基会被氢氧根猝灭,因而碱性条件下OFLX的去除率下降.同时,KSF表面一般呈负电状态,在pH3.0~7.0区间,OFLX分子呈质子化状态带正电[14],电性引力可提高KSF吸附能力,而在pH9.0~11.0区间,OFLX分子去质子化带负电[14],电性相斥也降低了KSF对OFLX的吸附能力.因此,UV/KSF/H2O2体系对OFLX的去除可在中性条件下进行.
2.5 OFLX去除反应动力学分析
在H2O2=32 mL/L,KSF=0.1 g/L,pH=7.0,紫外光照为24 W的实验条件下考察不同OFLX初始浓度在UV/KSF/H2O2体系的去除,实验结果如图5所示.随着OFLX的浓度升高,OFLX去除率下降,但去除的OFLX绝对数量是不断增加的.对不同OFLX初始浓度的去除反应进行一级和二级动力学分析,分析结果如表1所示.
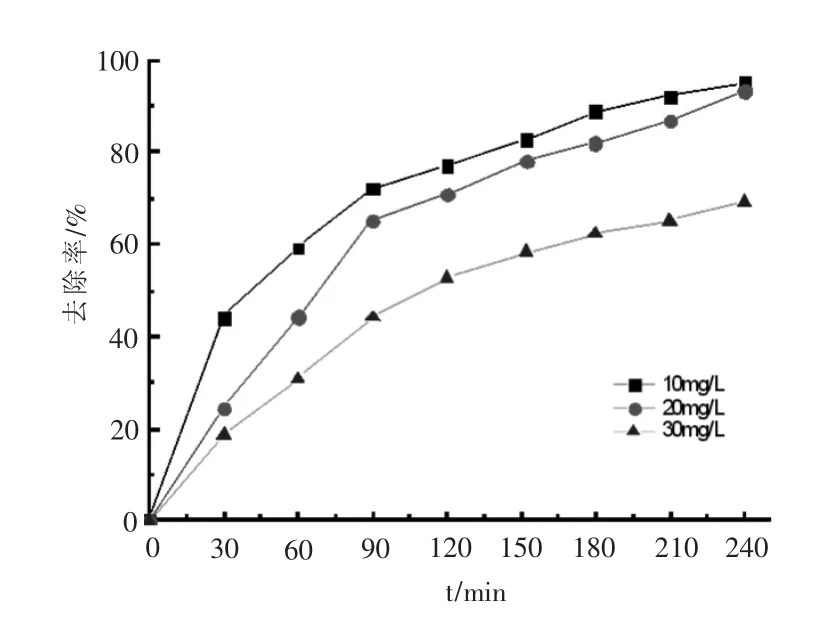
图 5 不同初始浓度OFLX在UV/KSF/H2O2中的去除
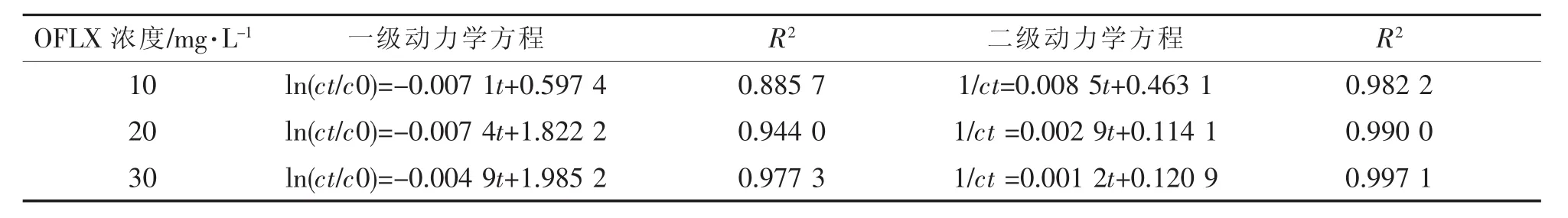
表1 OFLX的去除反应动力学分析
从表1可以看出,UV/KSF/H2O2体系对OFLX去除反应的二级动力学方程拟合相关系数R2均在0.98以上,比一级动力学方程拟合相关系数更高,因此UV/KSF/H2O2体系对OFLX去除反应可用二级动力学方程来描述.
2.6 OFLX去除机制研究
在UV/KSF/H2O2体系中,OFLX的去除应该主要通过两种途径,一种是KSF的吸附作用,还有一种是体系中产生的氧化性OH·自由基对OFLX的降解作用.为了验证假设,在OFLX=20 mg/L,H2O2=32 mL/L,KSF=0.1 g/L,pH=7.0,紫外光照为24 W的实验条件下,加入一定量的异丙醇猝灭溶液中的OH·自由基,考察此时的OFLX去除率,实验结果如图6所示.
从图6可以看出,体系中加入5 mL异丙醇之后,OFLX的去除率剧烈下降,从原来的93.4%下降到49.7%.进一步提高异丙醇的投加量到20 mL,OFLX的去除率进一步下降到41.7%,由此可见,体系中OH·自由基对OFLX的氧化是主要去除途径之一.而体系剩余的去除作用则是由KSF吸附贡献.因此,OFLX在UV/KSF/H2O2体系中的去除由氧化去除和吸附去除共同完成.
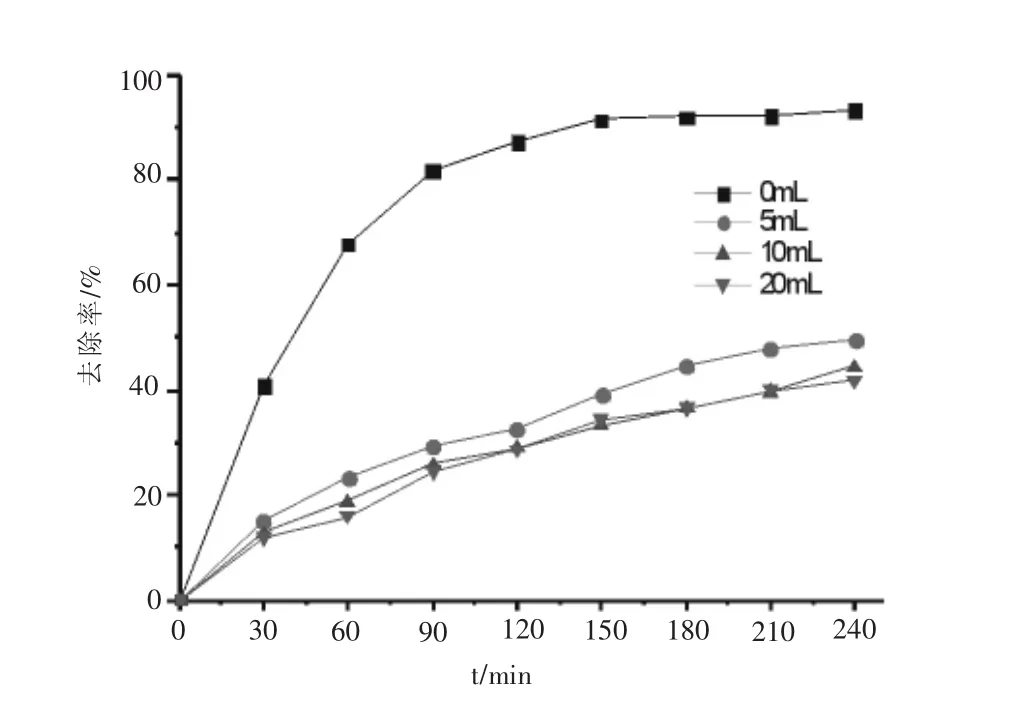
图6 异丙醇投加量对OFLX去除率的影响
3 结论
OFLX在UV/KSF/H2O2体系中可以有效地被去除.KSF和H2O2有最优投加量.当溶液pH值为7.0,KSF投加量为0.1 g/L,H2O2投加量为32 mL/L,OFLX去除率达最大值93.4%.在溶液pH值3.0~7.0范围内,OFLX去除率均在85%以上,进一步提高溶液pH值,去除效率则大幅下降.二级反应动力学可较好地描述OFLX在UV/KSF/H2O2体系中的去除反应.OFLX在UV/KSF/H2O2的去除有两种途径,一种是OH·自由基的氧化去除,另一种是KSF的吸附去除.
