1 610例湘潭地区孕妇耳聋基因突变位点筛查及临床意义
2018-07-21李春成谢月英周旭丽刘伟谢兰红
李春成 谢月英 周旭丽 刘伟 谢兰红
耳聋是一种严重危害人类健康的感觉神经系统缺陷疾病。由于遗传和环境因素的共同影响,人群中耳聋患病率随着年龄增长相应增加[1]。研究表明,60%的耳聋发生是由遗传造成的[2]。遗传性耳聋根据是否伴有耳外组织病变分为综合征型耳聋(syndromic hearing loss,SHL)和非综合征型耳 聋(nonsyndromic hearing loss,NSHL),其 中NSHL占遗传性耳聋人群数70%[3]。针对中国人群研究的数据显示,GJB2、SLC26A4、GJB3、mtD⁃NA 12S rRNA是导致中国耳聋人群的主要致病基因[4]。但耳聋基因突变位点及频率因地区、种族人群不同而有明显差异。
目前应用于临床的耳聋基因筛查技术主要有DNA测序法、基因芯片法和荧光定量PCR法,这些技术在应用中各有优缺点。传统Sanger测序是临床分子诊断的金标准,具有检测信息量大、准确度高的优势[5]。而近几年快速发展的微阵列基因芯片法极大提高了诊断效率,而且检测成本低。通过国家食品药品监督管理总局(China Food and Drug Administration,CFDA)认证的北京博奥生物有限公司耳聋基因检测芯片在特殊群体和新生儿耳聋基因筛查以及临床耳聋基因诊断中发挥了一定的作用[5]。本研究以湘潭地区1 610例孕妇为研究对象,采用北京博奥生物有限公司耳聋基因芯片法及Sanger测序,筛查和验证湘潭地区孕妇常见的GJB2、SLC26A4、GJB3、mtDNA 12S rRNA耳聋基因9个突变位点,为降低湘潭地区聋儿出生率及本地区制定预防、治疗应对策略提供临床依据。
1 对象与方法
1.1 对象
选取2015年11月至2017年4月在湘潭市妇幼保健院产前检查孕妇1 610例为研究对象,年龄19~41岁,平均年龄27岁。其中8位孕妇自述有耳聋家族史。
1.2 方法
1.2.1 实验设备与试剂
DAGON移液器购自上海大龙有限公司;TG16⁃WS 高速离心机(型号TG16⁃WS)购自湖南湘仪有限公司;医用定性PCR扩增仪(型号5333)购自德国eppendorf公司;医用核酸分子杂交仪(型号HHM⁃2)购自广东凯普生物科技股份有限公司;医用掌上离心机(型号Spectrafuge)购自美国Labndt公司;耳聋基因检测试剂购自潮州凯普生物有限公司;医用恒温金属浴(型号ACCU⁃BLOCK)购自美国Labndt公司。
1.2.2 DNA分离提取
检测前,对孕妇均进行耳聋知识培训,在充分知情、同意原则下,取孕妇静脉血1 mL,EDTA抗凝,采用凯普血液基因组DNA提取试剂盒(离心柱型)提取,具体操作步骤按试剂盒说明书进行。
1.2.3 PCR扩增
将提取的DNA经定量和纯度检测后,按照以下反应体系进行PCR扩增:将耳聋基因常见9个突变位点扩增试剂分为A、B 2组,其中A组包括35M、176M、235M、299M、538M、IVS7⁃2;B 组包括1494M、1555M、2168M。A组和B组PCR Mix各27.5 μL,DNA 聚合酶 0.5 μL,DNA 2 μL,总反应体系57.5 μL。PCR仪循环参数:95℃预变性9 min;95℃ 30 s,55℃ 30 s,72℃ 1 min,共 40 个循环;72℃延伸5 min。
1.2.4 芯片杂交
取A组 、B组PCR扩增产物5 μL,进行芯片杂交,具体操作步骤按照耳聋基因检测试剂盒说明书进行。另对研究对象中8位自述有耳聋家族史的孕妇而耳聋基因检测试剂盒未检出常见9个突变位点者,再进行测序验证。
1.2.5 结果判读
根据产品试剂盒说明书提供以下判读依据:按照耳聋基因芯片上杂交膜探针排列顺序,观察整张膜条上是否出现蓝紫色斑点。样本阳性位点的杂合突变或异质突变指正常探针及对应的突变探针位点都出现蓝紫色斑点;正常探针位点不出现蓝紫色斑点,而对应的突变探针位点则出现蓝紫色斑点,表示该位点纯合突变或均质突变。
1.2.6 统计学分析
实验数据采用SPSS 16.0统计学软件进行统计分析。耳聋基因常见突变位点阳性检出率比较采用χ2检验,以P<0.05表示有统计学意义。
2 结果
2.1 1 610例孕妇常见耳聋基因突变位点筛查结果
69例携带耳聋基因突变病例中检出常见突变位点9个,各基因突变位点分布情况见表1、图1。
2.2 Sanger测序结果
其中8例耳聋家族史受检孕妇,测序检出以下少见突变位点,详见图2。
2.3 耳聋基因常见突变位点阳性率比较
69例耳聋基因突变携带病例中,GJB2、SLC26A4、mtDNA 12S rRNA基因的突变位点检出率分别进行卡方检验,其中GJB2、SLC26A4统计比较结果均有统计学意义(P<0.05);mtDNA 12S rRNA基因的统计比较结果无统计学意义(P>0.05)(表 2)。

表1 1 610例常见耳聋基因突变位点分布情况Table 1 Distribution of common mutable sites in 1610 samples
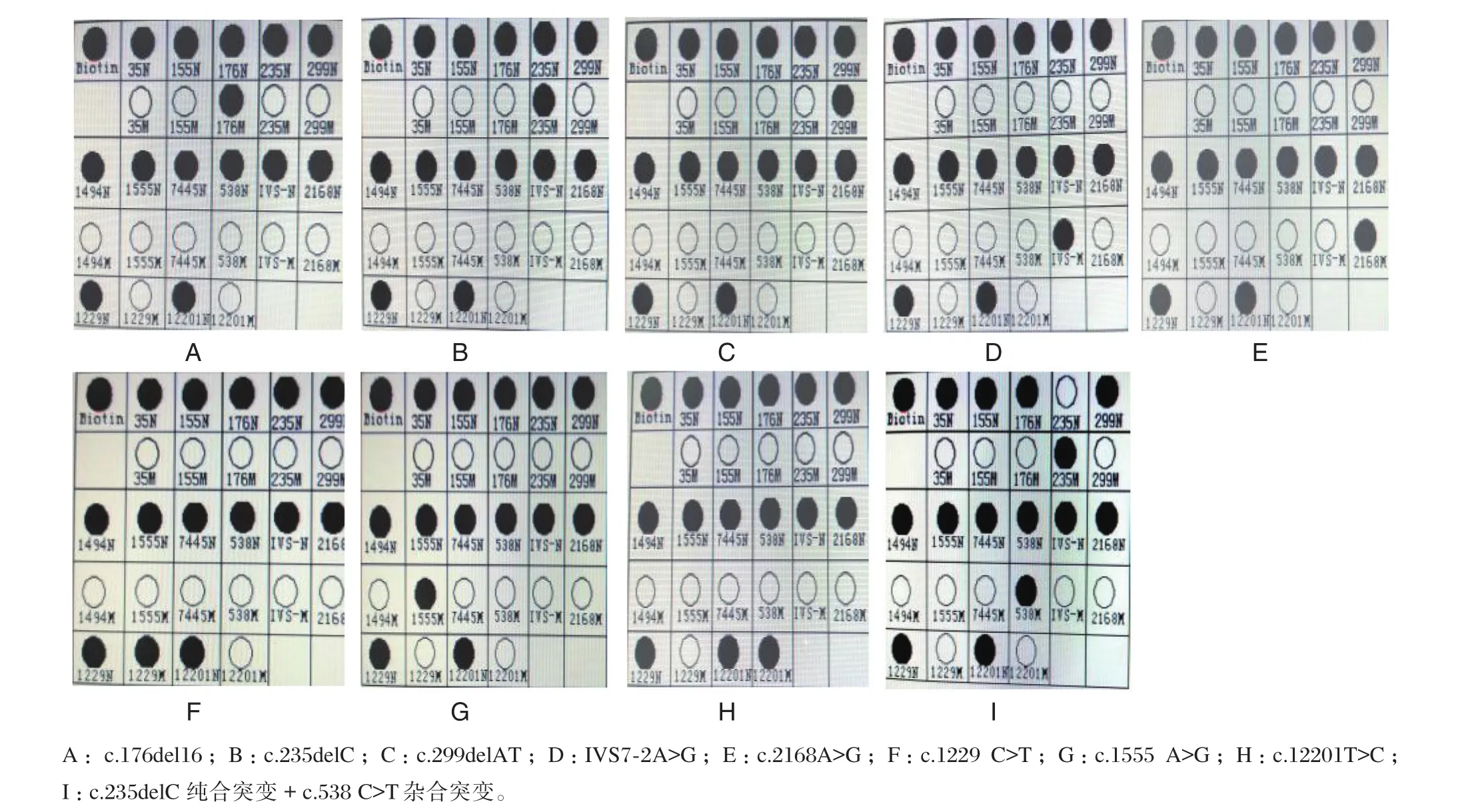
图1 常见耳聋基因杂合突变位点Figure 1 Common heterozygosis mutation sites of deafness gene
3 讨论
研究表明,在中国听力障碍人群中,耳聋基因突变的携带率为6%[6]。对出生后的耳聋人群再进行筛查和干预并不能从根本上阻断遗传性耳聋的发生。而在生育前进行耳聋基因筛查,则可以实现一级预防。本研究选择以湘潭地区孕妇为筛查对象,以期达到以上目的和效果。
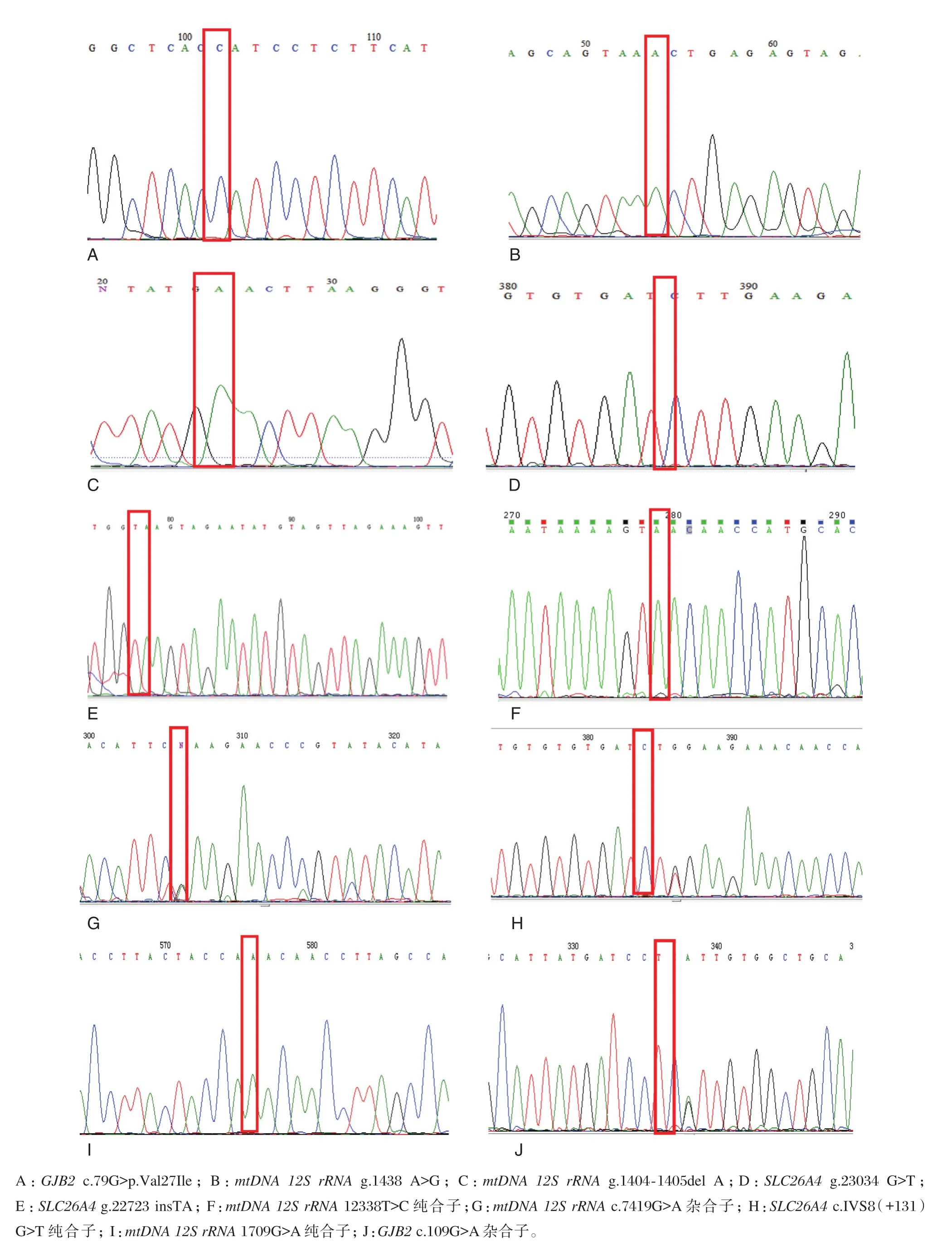
图2 耳聋基因少见突变位点测序图Figure 2 Sequencing results of rare mutation sites of deafness gene
耳聋遗传病具有高度的遗传异质性,研究发现耳聋致病基因及其突变位点在不同种族和地区表现出很大差异性[7]。到目前研究为止,文献报道110个致病耳聋基因被检测出来,其中与NSHL相关的遗传基因座有177个,涉及2 000个突变位点[8]。流行病学研究显示,在中国人群研究中,50%NSHL患者与GJB2(OMIM:121011)、GJB3(OMIM:603324),SLC26A4(OMIM:605646)和mtDNA 12S rRNA(OMIM:561000)4个常见耳聋基因相关[9]。在大多数亚洲人口中,GJB2基因突变是导致NSHL常染色体隐性遗传病的主要致病基因[10]。据文献报道,在石家庄、北京地区孕妇筛查中,GJB2基因突变检出率分别为3.40%(11/324)[11],2.8%(25/893)[12]。本研究湘潭地区孕妇GJB2基因突变检出率为2.42%(39/1 610)。以上结果均展现了GJB2基因检出率在同一种族不同地区的差异性。由于以上研究都是采用耳聋基因芯片法,但研究对象数量有所不同,究其检出率不同的原因,是否与各地区研究样本量的多少有关,有待群体分子流行病学深入研究,但以上研究结果在一定程度上反映了不同地区人群的遗传差异性。GJB2基因突变除了检出率不同,其突变位点差异性同样显著。GJB2基因4个最常见突变位点为 c.235delC、c.299⁃300delAT、c.176⁃191del16 和c.35delG,这4个位点在中国人群中的检出率占88%[13]。白人中以c.35delG突变频率最高,为81%[14],167delT 则是犹太人种的热点突变[15]。而在中国、韩国和日本,c.235delC则是热点突变[16]。本研究发现湘潭地区GJB2基因突变位点主要为c.235delC,其 次 为 c.299⁃300delAT,未 检 测 出c.35delG,与以上研究报道c.235delC是我国耳聋人群GJB2基因主要突变位点相吻合。GJB2基因的检出率及突变位点的差异性显示了高度的遗传异质性,给临床遗传性耳聋基因的诊断带来了极大的挑战。耳聋遗传异质性除了与人群遗传方式不同有关外,更常见于耳聋基因突变方式多样化,包括点突变、小片段插入缺失(indel)、拷贝数变异(copy number variation,CNV)、结构变异(structur⁃al variation,SV)等[5]。目前,检测耳聋基因的方法众多,包括Sanger测序是临床分子诊断的金标准,但是检测成本高。然而传统的酶切、杂交、Taq⁃Man探针等方法针对突变热点进行检测时,在检测通量上仍然没有大幅度提高[5]。以上这些耳聋基因的检测方法均具有明显不足之处。近几年微阵列芯片技术的快速发展,给耳聋基因的检测带来了很大的方便。但国内外已经采用的耳聋基因芯片类型比较多,有CGC遗传公司研发的CGC芯片[6]以及 APEX、Invader等芯片检测技术,可以同时针对数百个突变位点进行高通量检测,但这些基因芯片均具有检测周期长(最长可达8周),检测成本相对较高等缺点,而且对除点突变之外的其他突变类型的检出能力均有限[17]。而本研究采用的CFDA认证的博奥耳聋基因检测芯片具有检测成本低,周期短等优势,而且检测位点基本上覆盖了中国耳聋人群大部分常见突变位点。因此,不同种族、地区如果明确该人群耳聋基因突变形式和遗传方式,可根据本地区耳聋基因突变特点采取合适的检测方法,可能更有利于从根本上预防、诊断和治疗耳聋遗传病的发生。GJB3基因是我国夏家辉院士于1998年克隆的一个决定人类遗传性神经性耳聋的致病基因,并明确c.538C>T和c.547G>A 2个位点会导致高频感音神经性耳聋[12]。杜瑞莉等[18]和陈垲钿等[19]分别对 50 例和200例NSHL患者进行GJB3基因检测,均未检测到这2个突变位点。本研究筛检出c.538C>T 7例。同样这种差异性表达是否与GJB3基因研究样本量过少或者地区人群遗传差异性表达有关,尚有待深入对比研究。目前,国内对GJB3基因进行大规模人群筛查报道很少。因此,关于GJB3基因在中国人群中遗传表观情况需要积累更多的临床研究资料。该基因突变频率虽然远低于GJB2基因[20],但研究表明,GJB3基因突变可以引起显性或隐性NSHL遗传病[12]。如果GJB3基因c.538C>T杂合突变携带者与GJB2基因杂合突变者婚配就可能导致下一代耳聋遗传病的发生[21]。因此,GJB3基因的筛查意义同样不可忽视。
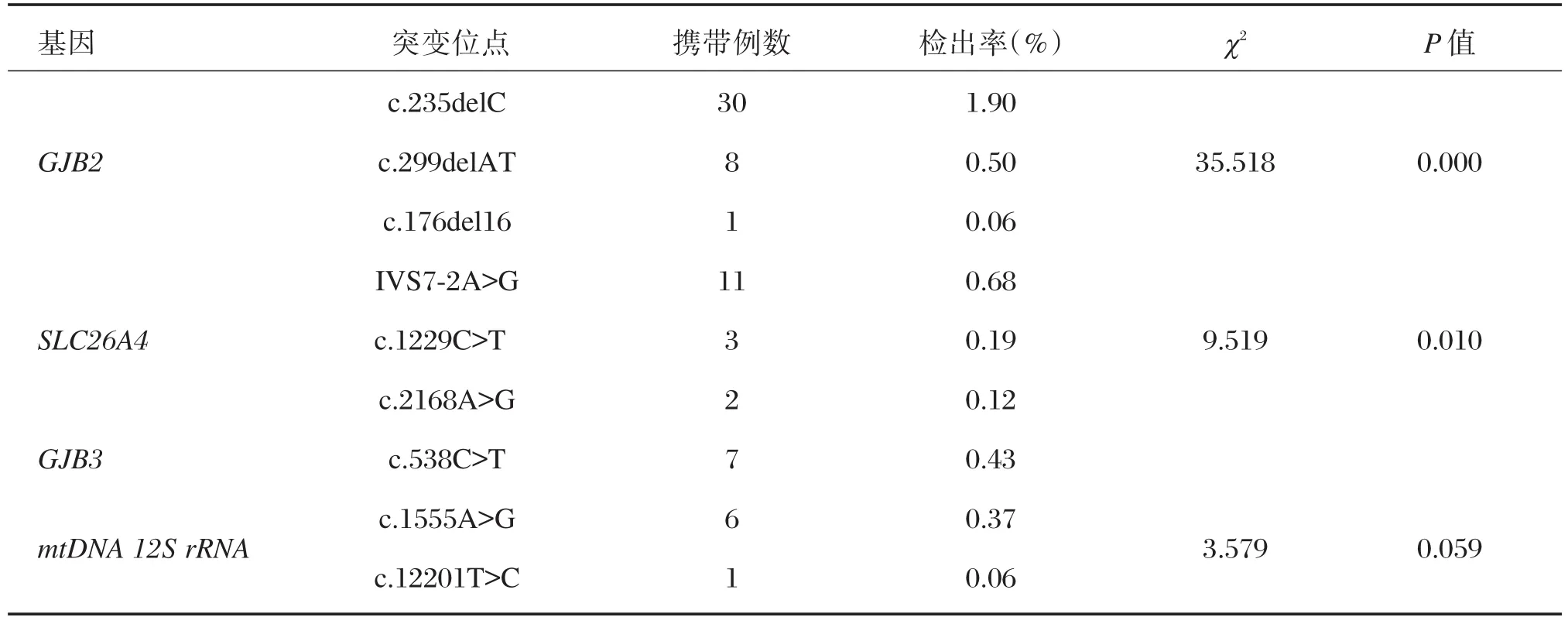
表2 耳聋基因常见突变位点阳性率分析Table 2 Analysis of positive rate of common mutation sites in deafness genes
SLC26A4基因突变会造成Pendrin蛋白功能异常,引起内淋巴囊离子转运障碍,导致隐性遗传的Pendred综合征和大前庭水管综合征(large vestibu⁃lar aqueduct syndrome,LVAS)[22]。因此,早期筛查SLC26A4基因突变对预防和治疗LVAS具有重要临床意义。以往研究结果显示,在巴基斯坦人群中,发现c.679G>C、c.304+2T>C和c.1667A >G等突变位点[23],而在日本和韩国人群中H723R则为最常见的突变[24],在国内南京市检出c.235C>T和c.347G>A 2个少见的SLC26A4基因突变位点[25]。而本研究未发现以上突变位点,主要检出IVS7⁃2A>G、c.1229C>T和c.2168A>G位点,同时Sanger测序发现2个少见位点g.23034 G>T和IVS8(+131)G>T纯合子,但未见报道这2个位点为致病位点。另外,满荣军等[26]报道SLC26A4基因检出率高于GJB2基因,而本研究统计学分析,发现结果刚好相反,SLC26A4基因检出率仅次于GJB2基因。以上研究结果同样显示了SLC26A4基因突变因种族、地区人群不同而凸显极大遗传异质性。这种异质性也再次证实了种族、地区人群的遗传因素影响的重要性。随着现代经济快速发展和医疗保健水平的提高,环境因素影响也逐渐缩小。针对以上SLC26A4基因遗传异质性表现,我们在制定耳聋基因突变位点检测策略或基因芯片开发中,应结合不同种族和地区人群遗传特点制定适合本地区的筛查策略及预防、治疗方法。
mtDNA 12S rRNA突变是导致氨基糖苷类抗生素致聋(aminoglycoside antibiotics induced deafness,AAID)和NSHL的重要原因之一,随着研究的深入,目前发现mtDNA 12S rRNA基因上的很多突变位点与AAID和NSHL相关,主要包括A1555T、C1494T、961insC、T961G、T961C 和 T1095C 等[27]。但在中国耳聋人群中,引起AAID和NSHL相关的mtDNA 12S rRNA基因主要突变位点为A1555G和 C1494T[28]。本研究主要筛查出mtDNA 12S rRNAc.1555A>G和c.12201T>C 2个位点。其中主要以c.1555A>G(6/7例)位点为主,与以上研究结果相符。由于A1555G突变位点与AAID密切相关,而且mtDNA 12S rRNA的遗传方式为母系遗传且不发生重组,线粒体不与组蛋白结合,没有修复能力,因而很容易发生变异[29]。针对本研究检出的6例mtDNA 12S rRNA阳性孕妇,我们将对其分娩的新生儿进行紧密随访,并对mtDNA 12S rRNA突变位点进行筛查,以防止新生儿AAID的发生。
本研究对8位有耳聋家族史的孕妇进行Sanger测序,发现GJB2、SLC26A4及mtDNA 12S rRNA耳聋基因存在一些少见突变位点,譬如mtDNA 12S rRNAc.1438 A>G、c.1709G>A、c.7419G>A、c.12338T>C 等;其中mtDNA 12S rRNAc.1438 A>G位点检出率比较高。该位点是否为个别耳聋患者致病位点未见相关研究报道,但有研究报道mtDNA 12S rRNAc.12338T>C为致病突变位点[30]。对于这些少见突变位点是否具有临床致病性有待我们进一步去研究证实。
综上所述,我国因幅员广阔,人口众多,不同民族、地区人群的遗传素质自然有所不同。这也解释了耳聋基因突变位点检测表现出的极大遗传差异性。因此,不同种族和地区,应结合当地耳聋基因表现特征,制定适合本地区的筛查策略及预防措施。同时,耳聋致病基因及突变位点众多,对于有听力障碍但耳聋基因芯片筛查为阴性者,我们应给予患者正确的遗传咨询指导,以避免漏诊和误诊。