长期递增负荷运动对大鼠胸腺上皮和胸腺激素表达的影响
2018-07-21任超学郝选明金艳平
任超学 郝选明 金艳平
长期从事大强度运动训练会引起运动性免疫抑制,对免疫功能产生强烈的负性影响[1],在运动免疫抑制发生发展的过程中,作为T细胞发育成熟的中枢免疫器官,胸腺的形态结构会发生明显的负性变化,使得T细胞的发育过程受阻,T 细胞凋亡增加[1⁃2]。免疫学研究业已证实,T 细胞在胸腺发育成熟过程中,不仅受细胞因子和转录因子的影响,而且受胸腺激素的直接调节[3]。胸腺激素是由胸腺被膜下上皮细胞分泌的,以旁分泌的方式影响着T细胞在胸腺发育的整个阶段,能连续诱导胸腺细胞发育为成熟的T细胞,并进一步分化为不同功能的亚群。目前,有关长期运动训练对胸腺上皮细胞结构和胸腺激素分泌方面的实验研究报道少见。鉴于此,本实验研究采用6周递增负荷运动训练,观察大鼠在运动性免疫抑制发生和发展过程中胸腺激素分泌的变化,同时通过观察分泌胸腺激素的胸腺上皮细胞形态与结构的变化,以探索胸腺激素分泌变化的原因,为探讨运动性免疫抑制发生机制提供实验依据。
1 材料与方法
1.1 实验动物与分组
在通过动物实验伦理审查后,实验选用无特定病原体(specific pathogen free,SPF)级 SD雄性大鼠(sprague dawley,SD)42只(8周龄,购于广州中医药大学实验动物中心,动物合格证号:NO.44005900001124)。实验动物分笼饲养,自由饮食、饮水,饲养房温度为(22±3)℃,湿度为60%左右。饲料为国家标准颗粒型固体大鼠饲料(广州中医药大学动物实验中心提供),饮用水为双蒸水。动物饲养房、训练房、动物跑台、笼具和饮水瓶定期紫外线消毒。
实验大鼠随机分为对照组和运动组(第0周时因大鼠未作任何干预故运动组和对照组共用1组6只大鼠,第2、4、6周运动组和对照组每组每周6只,合计36只大鼠,故该实验共计用大鼠42只),对照组不施加任何运动干预,主要用于观察生长发育过程对测试指标的影响;而运动组按照运动方案完成6周递增负荷运动。
1.2 运动方案
本实验采用本课题组沿用多年的递增负荷大鼠运动模型,运动训练大鼠活动方式为跑台运动,坡度为0,训练共6周,每周训练6天,每天训练30 min。运动强度为逐周递增负荷模式,第1周起始负荷为10 m/min(适应性训练),第2周增为20 m/min,随后各周负荷强度增量为5 m/min,至第6周达到40 m/min,接近大鼠极限负荷强度。
1.3 测试指标及测试方法
胸腺上皮细胞结构采用免疫组织化学染色法(strept avidin⁃biontin complex,SABC),Motic光学显微镜400倍镜下观察;胸腺素α1和胸腺生成素Ⅱ用酶联免疫吸附法(enzyme linked immunosor⁃bent assay,ELISA)测定。
1.4 实验仪器与试剂
1.4.1 主要实验仪器
全自动组织脱水机(型号:TP1020E)、石蜡包埋机(型号:EG1150)、石蜡轮转切片机(型号:RM2135)、摊片机(型号:HI1210)均购于德国莱卡公司;Motic光学显微镜(型号:Motic B5)、彩色数码CCD摄像头(型号:Moticam 1300)购于加拿大麦克奥迪公司;酶标仪(型号:BIO⁃RAD550)、大鼠活动跑台购于广州飞迪生物科技有限公司。
1.4.2 主要实验试剂
大鼠胸腺素α1和胸腺生成素Ⅱ酶联免疫分析试剂盒购于武汉华美生物工程有限公司;羊抗兔二抗试剂盒购于北京博奥森生物技术有限公司;苏木素、二甲苯、PBS、不同浓度的脱水用乙醇、多聚甲醛、盐酸、石蜡、中性树胶等购于广州市洁利生物医学有限公司。
1.5 采样时间和动物组织取材
1.5.1 采样时间
分别于训练前(第0周),训练第2周末、第4周末和第6周末采样,每组每次6只。具体采样时间为当周最后一次训练结束后48 h,使机体得到比较充分的恢复,避免测试结果受上次运动负荷的影响。
1.5.2 动物胸腺取材
实验取材当天,实验大鼠按照每100 g体重腹腔注射0.4 mL 10%水合氯醛进行麻醉,麻醉后取出大鼠胸腺。取出胸腺分离剔除结缔组织和脂肪,称湿重,然后沿纵轴将胸腺两叶分开,一叶胸腺组织加入适量生理盐水捣碎,反复冻融2次后,5 000g离心5 min取上清,按一次用量10 mL分装2管,冻存于-80℃冰箱,分别用于测大鼠胸腺素α1和胸腺生成素Ⅱ;另一叶置于4%的多聚甲醛磷酸缓冲液中24 h,用于免疫组化分析,观察胸腺上皮细胞的形态变化。
1.6 图像与数据统计处理
1.6.1 图像处理
用显微镜观察组织切片,在400倍镜下每张切片随机选取5个具有代表性的视野,视野不相互重叠,用数字图像采集系统采集图像,用Imagepro plus 6.0图像分析系统分析计算每张图片的阳性产物积分光密度(integrated optical density,IOD)及其阳性面积(area),用公式Density=IOD/Area计算该张图片上阳性产物的平均光密度,然后求5个视野平均光密度的均值,即为该样本阳性产物的平均光密度值。
1.6.2 数据统计处理
所有实验数据均采用平均数±标准差表示,用SPSS 17.0进行统计处理;组内前后比较采用配对样本t检验,组间比较采用单因素方差分析,相关性用皮尔逊相关分析,以P<0.05作为差异显著性水平。

表1 2组大鼠胸腺指数变化情况Table 1 Changes of thymus index of the 2 groups
2 结果
2.1 大鼠胸腺形态的变化
2组大鼠胸腺指数各周变化情况见表1,随着年龄的增加,对照组正常发育大鼠的胸腺指数会逐渐下降,与第0周相比,至第6周末有极显著下降(P<0.01);但运动组大鼠胸腺指数下降的速率更甚,同周2组组间比较,第2周末、第4周末和第6周末运动组均显著低于对照组(P<0.05)。
2.2 大鼠胸腺中胸腺素α1的变化
由表2可见,对照组随着年龄的增加,大鼠胸腺组织中胸腺素α1含量呈先升高再降低的趋势,但各周之间没有显著性差异(P>0.05);运动组大鼠胸腺素α1的含量也呈现先升高后降低趋势,与第0周相比,第2周末、第4周末胸腺组织中胸腺素α1的含量略有升高,但无显著性差异(P>0.05),但至第6周末,胸腺素α1的含量明显降低(P<0.05),不仅明显低于自身第0周值(P<0.05),而且明显低于对照组第6周末值(P<0.05)。
2.3 大鼠胸腺中胸腺生成素Ⅱ的变化
由表3可见,对照组大鼠胸腺生成素Ⅱ含量呈现先升高后降低的趋势,但各周之间无显著性差异(P>0.05);运动组大鼠胸腺生成素Ⅱ的含量总体呈现先升高后降低趋势,至第6周末,胸腺生成素Ⅱ的含量突然明显降低,不仅明显低于自身第0周值(P<0.05),而且明显低于对照组第6周末值(P<0.05),胸腺生成素Ⅱ的含量呈现出前4周保持平稳而随后出现突降的趋势。在6周递增负荷运动过程中,2组大鼠胸腺生成素Ⅱ的变化(表3)与胸腺素α1的变化(表2)表现出相似的变化趋势,相关程度高(r=0.86)。

表2 2组大鼠胸腺组织胸腺素α1的表达量(pg/mL)Table 2 The content of thymosin α1 in the 2 group(pg/mL)

表3 2组大鼠胸腺生成素Ⅱ的表达量(pg/mL)Table 3 The content of thymopoietinⅡ in the 2 group(pg/mL)
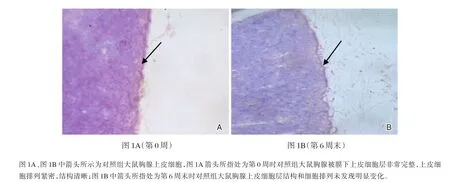
图1 对照组大鼠胸腺上皮细胞层形态与结构(SABC,×400)Figure 1 The structure of thymic epithelial cell changes in control group(SABC,×400)
2.4 大鼠胸腺被膜下上皮细胞层形态和结构的变化
对照组大鼠6周递增负荷运动过程中胸腺被膜下上皮层细胞形态和结构的变化情况参见图1。由图1A(第0周)可见,大鼠胸腺被膜下上皮细胞层非常完整,上皮细胞排列紧密,结构清晰。经过正常发育生长6周后(图1B,第6周末),胸腺上皮细胞层结构和细胞排列未发现明显变化。
图2A为大鼠执行运动方案前(第0周)胸腺上皮层形态结构,图2B为完成6周递增强度负荷运动后的变化。由B图可见,大鼠胸腺上皮细胞层形态的完整性遭到严重破坏,细胞层发生严重的断裂或缺失现象,上皮细胞排列松散,细胞间隙增宽,胸腺上皮细胞的结构明显不完整。
3 讨论
胸腺的主要作用是产生大量的T淋巴细胞,分泌各种胸腺激素和胸腺因子,发挥细胞免疫的作用[4]。笔者研究团队前期探索了影响T细胞发育成熟、增殖分化的细胞因子和转录因子,发现随着训练进程的进展,调控T细胞发育的正性调节因子白细胞介素⁃7(interleukin⁃7,IL⁃7)和转录因子⁃1(transcription factor⁃1,TCF⁃1)逐步降低,负性调节因子及转化生长因子⁃β1(transforming growth fac⁃tor beta 1,TGF⁃β1)则逐步升高,两者综合作用的结果,使得T细胞的整个发育全程(包括胸腺双阴选择阶段、双阳选择阶段和最后的单阳选择阶段)均受到显著影响[5],从而导致免疫功能下降。胸腺形态结构的变化对于机体的免疫功能至关重要。众多学者研究发现,胸腺随着机体年龄的增长在一定程度上会发生增龄性萎缩,而长期大强度运动训练会加剧胸腺萎缩速度[6⁃9],本研究结果与以上学者研究结果一致(如表1所示)。长期递增负荷运动作为对机体的强烈刺激,对胸腺形态产生非常显著的负性影响。功能的变化源于结构的变化,随运动时间的延长,胸腺萎缩加剧,提示胸腺细胞发育过程受阻,胸腺细胞凋亡增加,从而导致T细胞所介导的细胞免疫功能降低,以及机体细胞免疫和体液免疫两者协调关系的失衡。

图2 运动组大鼠胸腺上皮细胞层形态与结构(SABC,×400)Figure 2 The structure of thymic epithelial cell changes in exercise group(SABC,×400)
胸腺素α1是一种具有免疫活性的多肽类物质,主要存在于胸腺上皮细胞、外周血、精液和羊水等中,能降低CD4+CD8+双阳性胸腺细胞的凋亡,改变胸腺细胞亚群的比值,增加CD4+CD8+双阳性胸腺细胞的数量,提高机体的免疫力[10⁃11]。本实验发现,长期递增负荷运动对大鼠胸腺组织中胸腺素α1含量会产生严重的负性影响,而自然生长对胸腺素α1含量并未造成明显改变,这可能是由于前4周运动强度较小,对大鼠胸腺发育的影响不大,结合胸腺上皮形态结构光镜图(图1、图2)发现,运动前期大鼠胸腺上皮的形态结构相对完整,但随着运动负荷持续加重,至第6周末可见大鼠胸腺上皮结构遭到严重破坏,胸腺皮质厚度变薄,T淋巴细胞排列疏松,皮髓质界限不复存在,上皮细胞有明显破坏。运动组胸腺结构的破坏情况也与他人实验结果相符[8⁃9]。有研究发现,在长期递增负荷过程中,外源性补充胸腺素α1能够有效对抗胸腺组织的萎缩程度[9]。胸腺素α1是由胸腺上皮细胞产生的,胸腺上皮形态结构的破坏应该是胸腺素α1在6周递增负荷后明显降低的主要原因。
胸腺生成素是由胸腺被膜下上皮细胞分泌的一种胸腺激素,诱导前胸腺细胞分化成胸腺细胞,进而分化发育为成熟的T淋巴细胞,胸腺生成素对成熟T淋巴细胞有强烈的免疫调节作用,并在神经肌肉接头信息的传递中起重要作用。Goldstein从胸腺生成素中分离出了胸腺生成素Ⅱ,具有双向调节机体免疫功能的作用,不仅能抑制过强的免疫反应,而且能使受到抑制的免疫反应趋向正常[12⁃14]。本文实验发现,在 6 周递增负荷运动影响下,运动组胸腺生成素Ⅱ的分泌变化与胸腺形态显著萎缩的变化趋势一致,提示胸腺激素分泌的减少与胸腺结构遭到严重破坏有关,而胸腺激素所具有的调节胸腺细胞发育、拮抗胸腺细胞凋亡等功能因分泌量减少会出现弱化,进而又会反过来加速胸腺的萎缩速率。两者存在着这种互为因果的特殊关系,构成了运动对免疫功能或者促进、或者抑制这两种迥然不同的影响。
大量研究显示,经常进行适中强度的运动锻炼能够改善免疫器官的形态、结构和功能,从而提升机体免疫功能[1,15⁃16]。但长期从事超负荷类型的大强度运动训练则对两者有强烈的负性影响[18⁃19]。本实验也证实,在长期递增负荷前期,因负荷较小对两者的负性影响不大,机体可通过动员、激活或补偿机制尚可维持胸腺的形态、结构和功能。但随着训练进行到负荷后期(第6周末),因负荷强度过大,机体难于恢复,两者之间的平衡关系被彻底打破,从而导致胸腺形态结构呈现进行性破坏,同时胸腺细胞功能呈现渐进性降低。
