重组子宫内膜抗原制备及其在蛋白芯片检测中的应用
2018-07-20王明珠罗莉蔡祥胜
王明珠,罗莉,蔡祥胜
(1.西安市第四医院生殖医学中心,西安 710004;2.广东药科大学第一附属医院,广州 510080)
抗子宫内膜抗体(EMAb)是造成女性不孕的常见原因[1]。正常位置的子宫内膜对机体无抗原性,但异常位置的子宫内膜可以作为抗原激活机体的免疫系统[2],常见于子宫内膜异位症患者。其产生的条件与异位内膜刺激以及免疫失调等因素相关,另外和生殖道的炎症反应等因素也相关[3]。抗子宫内膜抗体会引发子宫内膜产生抗原抗体免疫反应,在子宫内产生局部免疫反应,刺激机体的补体系统,导致子宫内膜发生病理性损伤[4]。破坏子宫内膜结构,影响内膜发育和内分泌功能[5]。子宫中营养胚胎的糖原水平降低,免疫复合物的水平升高,导致受精卵的着床失败以及胚胎发育不良,从而引起不孕或流产[6-7]。抗子宫内膜抗体针对的抗原为孕激素依赖蛋白(PAEP)、S100P和Nidogen-1等蛋白[8-9]。目前临床检测EMAb主要采用酶联免疫法吸附(ELISA)方法。ELISA影响因素多,不能确定抗体结合部位。子宫内膜抗原需从组织匀浆中提取,不仅组织来源困难而且也难于分离到高纯度的蛋白。另外抗原成分复杂,特异性差,检测批间差异较大。本研究通过生物信息学方法设计一种由多个蛋白的抗原表位组成的重组多表位子宫内膜抗原,使用原核分泌表达系统进行表达[10-12],并将其应用于蛋白芯片检测抗子宫内膜抗体。
材料与方法
一、实验材料
1.大肠杆菌DH5α(dlacZDeltaM15DeltalacZYA-argFU169recA1endA1hsdR17(rK-mK+)supE44thi-1gyrA96relA1)用于重组质粒扩增。大肠杆菌YK537 (supE44hsdRhadMrecA1phoA8leuB6thilacYrpsL20galK2ara-14xyl-5mlt-1) 用于目的蛋白表达。PhoA质粒用于构建表达载体。菌株与质粒均为广东药科大学第一附属医院检验科赠与。
2.血清样本:选取2015年1月至2017年8月在西安市第四医院生殖医学中心因不孕就诊的71例患者,收集血清。患者年龄23~39岁,平均年龄(31.6±2.3)岁;排除因生殖器官病变以及病毒感染引起的不孕症患者。
二、主要试剂和仪器
内切酶NheI和BamHI、质粒提取试剂盒(大连宝生物),Ni-NTA His-Bind Resin亲和层析柱(Merck,德国),Biodot-AD1510点样仪(BioDot,美国),酶标仪(Thermo,美国)。
三、实验方法
1.目的基因合成和表达载体构建:使用DNASTAR软件于子宫内膜相关的PAEP、S100P和Nidogen-1序列分析抗原表位,设计新的人重组子宫内膜(rhEM)多肽抗原序列,在不改变氨基酸序列的条件下,合成重组子宫内膜抗原序列质粒pGEM-T-EM和引物模版(上海生工生物)。引物序列以pGEM-T-EM为模版扩增目的片段,引物序列为:rhEM-F:5′-GGTGGTGCTAGCGCTCAGAAGGGTAAACGTAACACCTTCC-3′,rhEM-R:5′-GGTGGTGGATCCGGTTTTGGTTTTAGAGTCTTTTTGG-3′。PCR产物和载体pGEM-T经过酶切连接并进行扩增,随后酶切鉴定。目的片段和PhoA分别用NheI和BamHI酶切后连接,胶纯化后连接转化感受态细胞,于含氨苄青霉素LB平板中培养,挑克隆于5 ml LB培养基中扩大培养后,提质粒酶切鉴定,将阳性克隆送测序(图1)。
2.rhEM蛋白在YK537中表达:挑取PhoA-EM/YK537单菌落于5 ml LB培养基37℃,振摇培养过夜。收集菌并转移到低磷培养基[低磷培养基为每100 ml培养基中含蛋白胨1 g,酵母浸膏0.25 g,MgSO4·7 H2O 0.05 g,1 mol/L Tris-Cl(pH 8.0)5 ml,苯酚红0.2 ml,葡萄糖1 g]培养10 h后,离心收集沉淀,然后重悬至1 000 ml TSE溶液中(20 mmol/L Tris-Hcl,pH 7.0,20%葡萄糖,1 mmol/L EDTA)。冰浴30 min后,5 000 rpm离心,收集沉淀并弃去上清。之后将沉淀重悬至1 000 ml的TE溶液中(20 mmol/L Tris-Hcl,pH 7.0,1 mmol/L EDTA),收集上清保存于-20℃准备下一步纯化。
3.rhEM抗原蛋白分离与纯化:将收集的上清通过Ni-NTA His-Bind Resin进行亲和层析柱纯化。蛋白稀释于含0.2 mol/L NaCl的20 mmol/L Tris-HCl(pH 8.0)中并进行SDS-PAGE分析。
4.rhEM抗原蛋白的聚丙烯酰胺凝胶电泳(SDS-PAGE),免疫印记和高效液相色谱法(HLPC)分析鉴定:纯化后的重组EM抗原蛋白通过12% SDS-PAGE电泳和免疫印记(Western blot)鉴定。按照Bio-rad电转仪操作方法进行,首先剪硝酸纤维膜(PVDF膜)适当大小,泡甲醇20 min,然后同滤纸及海绵垫一起泡在转移缓冲液中。按照黑板-海绵垫-3层滤纸-PAGE胶-PVDF膜-3层滤纸-海绵垫-白板的顺序,将胶固定好,黑板对着转移槽的黑板,黑板一边放置冰盒,将转移槽放在冰浴中200 mA,转膜90 min后,将PVDF膜取出用0.01 M PBS漂洗,加5%脱脂奶粉封闭2 h。然后将1∶100封闭液稀释的羊抗人的6His单抗点到PVDF膜上,4℃湿盒中孵育过夜。第二日,取出PVDF膜用PBS洗膜10 min,洗2次。室温下与结合有辣根过氧化物酶(HRP)的兔抗羊的二抗(1∶200)孵育90 min。用含0.05% Tween 20的PBST洗膜10 min,洗2次,再用PBS洗膜10 min。将PVDF膜在二氨基联苯胺(DAB)显色液中显色,至印记带出现后,用H2O终止显色。按厂家操作说明步骤对目的蛋白进行HPLC鉴定(贝克曼,美国)。
5.蛋白芯片检测方法的建立以及临床应用:采用棋盘法(0.3 mol/L包被缓冲、0.2% 甘油、0.01% Triton X-100和1.5%甘露醇)确定包被芯片的EM抗原浓度。此外,通过2倍连续稀释法优化所需血清浓度。采用Biodot-AD1510点样仪将EM抗原稀释液点样到蛋白芯片上。蛋白质芯片检测过程如下:室温下PBS缓冲液冲洗芯片5 min,用纸巾拍干芯片,添加75 μl 10倍稀释的血样到每个孔,置于恒温摇床(37℃,150 r)孵育30 min。接下来,加入75 μl 结合HRP的单抗,将芯片放入摇床(37℃,150 rpm)振摇30 min。将芯片取出用PBST冲洗。晾干芯片。采用市售常用抗子宫内膜抗体ELISA检测试剂盒(广州康遂生物)并根据产品操作说明检测抗子宫内膜抗体。用蛋白芯片和ELISA方法检测了71份不孕症患者血清标本。
结 果
一、rhEM蛋白原核表达系统的建立
重组EM的基因序列位置于phoA质粒中碱性磷酸酶信号序列下游,通过phoA中碱性磷酸酶启动子就可以控制蛋白的表达。多抗原表位的重组蛋白EM序列与表达质粒连接后成功转入表达载体YK537。rhEM蛋白片段约500 bp(图2)。
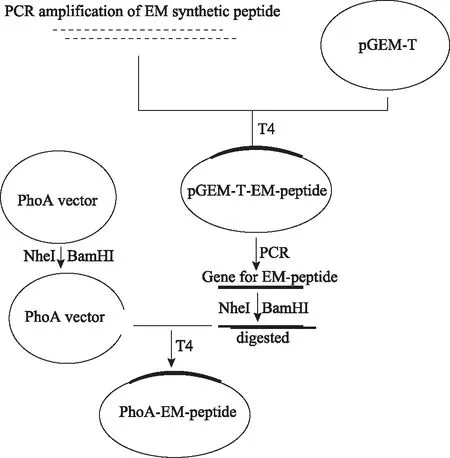
图1 phoA载体和rhEM的构建示意图
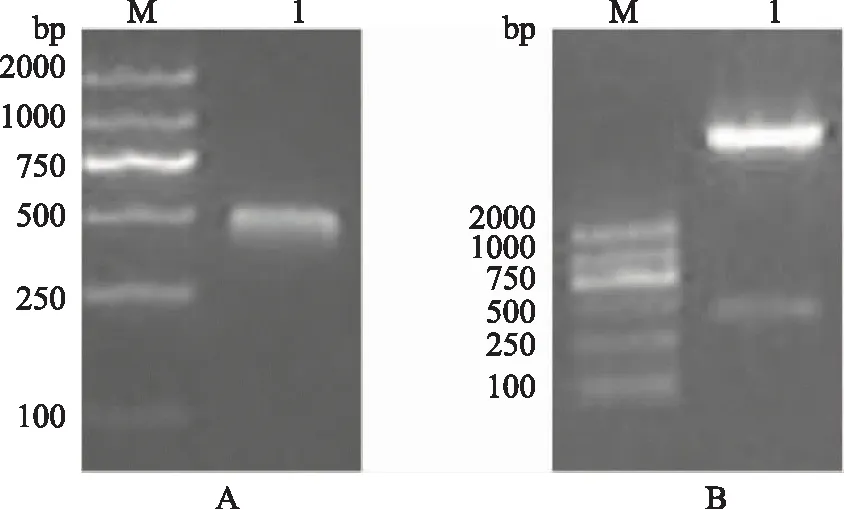
A.rhEM的PCR鉴定电泳图,M:marker,1:rhEM蛋白的基因片段,大小约500bp;B.双酶切鉴定电泳图,M:marker,1:phoA和rhEM的双酶切产物图2 PCR和酶切鉴定rhEM基因和phoA载体
二、rhEM蛋白的表达和纯化
rhEM蛋白的重组通过宿主菌YK537分泌表达。携带phoA质粒的宿主菌株在30 L发酵罐中培养12 h,将质粒重组EM蛋白分泌到周质腔。18 h后,重组蛋白约占总蛋白的20%(图3A)。达到最大生产重组EM抗原20 mg/L的产量。
通过TSE溶液抽提后,接着使用Ni-NTA His-Bind树脂纯化rhEM抗原蛋白。大多数rhEM蛋白紧密结合的Ni-NTA His-Bind树脂。0.4 mol/L咪唑洗脱含有大部分rhEM蛋白,纯度约为90%。将0.4 M咪唑溶液洗脱的液体混合,超滤浓缩后,进一步使用分子筛层析柱进行分离(图3B)。在SDS-聚丙烯酰胺凝胶电泳和高效液相色谱分析中显示,rhEM蛋白纯度均达到95%以上(图3C、D)。免疫印迹法确定了一条强染色条带为rhEM蛋白(图3E)。
三、蛋白质芯片和ELISA两种方法检测抗子宫内膜抗体
分别用市售常用检测抗子宫内膜抗体ELISA检测试剂盒和本研究的蛋白质芯片检测71例不明原因不孕患者。酶联免疫吸附试验检测到阳性样本21份,50份样本呈阴性。蛋白质芯片鉴定阳性23份,阴性品48份(图4)。ELISA试剂盒与蛋白芯片检测结果的符合率为96.2%,阳性符合率为91%,阴性符合率为96%。用蛋白芯片法检出阳性血清23份(阳性率为32%);ELISA检出9份阳性血清(阳性率为30%)(表1)。总的来说,比较两种方法,分别用受试者工作特征曲线(ROC曲线)分析评价,受试者工作曲线下面积(AUC)分别为蛋白质芯片的0.89和ELISA的0.96(图5),表明蛋白芯片的检测性能与ELISA法检测不孕不育患者的相似。
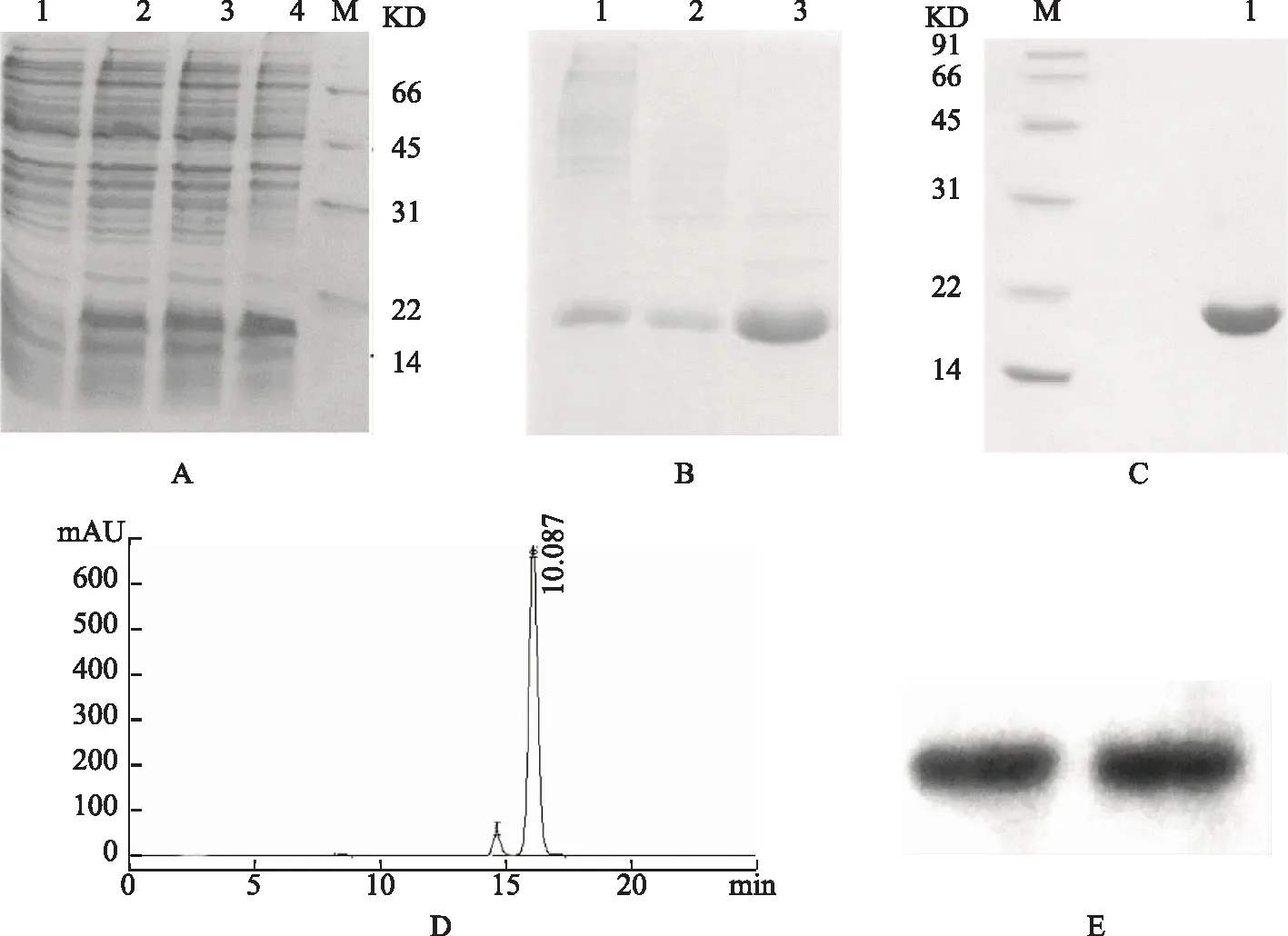
A.rhEM蛋白在YK537中表达的SDS-PAGE电泳图。M:Marker,1:未携带质粒的YK537,2:在发酵罐中培养12h,3:诱导蛋白表达前,4:诱导蛋白表达后;B.亲和层析后SDS-PAGE电泳图,1:周质腔抽提,2、3:镍柱亲和层析;C.分子筛层析后SDS-PAGE电泳结果;D.高效液相色谱结果;E.Western blot结果图3 重组子宫内膜抗原的表达与纯化

A.抗子宫内膜抗体阴性结果;B.抗子宫内膜抗体阳性结果图4 蛋白芯片检测结果
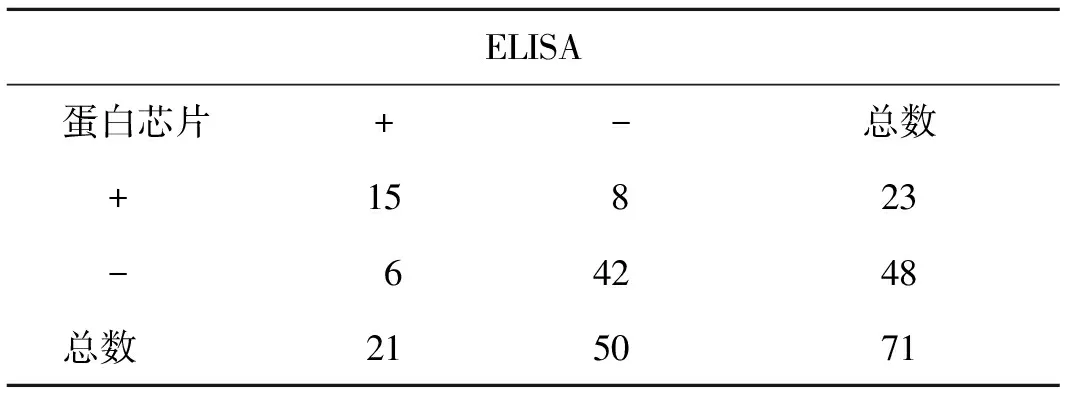
ELISA蛋白芯片+-总数+ 15823- 64248总数 215071
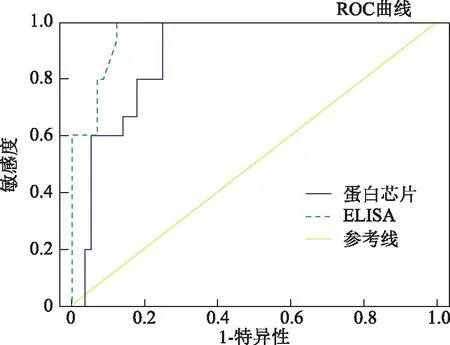
曲线下面积分别为蛋白芯片0.89,ELISA 0.96图5 受试者工作曲线(ROC曲线)
讨 论
对于免疫不孕患者,不育相关抗体的检测越来越受到临床的重视[13]。抗子宫内膜抗体的产生会导致受精卵的着床失败以及胚胎发育不佳,进而引起不孕或者流产[14]。检测抗子宫内膜抗体对于诊断和治疗有重要意义。目前文献所报道的不育抗体阳性率差别很大,其中一个重要原因是现在所采用的子宫内膜抗原制备方法仍比较粗糙,常用子宫内膜组织研磨后提取蛋白作为抗原成分制备检测试剂盒。导致各实验室检测结果一致性较差。本研究使用的重组子宫内膜抗原,通过大肠杆菌分泌表达,抗原蛋白纯度高,能减少天然提取时无法避免的干扰,以重组子宫内膜抗原蛋白制备的蛋白芯片使不同批次间检测结果的差异最小化,结果更为可信。
大肠杆菌表达蛋白由于其简便易行和低成本的优点已经成为常用的生物工程技术,而蛋白表达的关键在于保持其生物活性[15]。一般情况下,蛋白是以可溶还是包涵体形式存在,都表达于胞浆内,必须经过超声波破碎菌体后才能使蛋白释放出来,不但对蛋白本身有破坏作用,而且也增加了纯化的难度与成本[16]。在本研究中使用信号肽使重组子宫内膜蛋白分泌到大肠杆菌周质腔,优点在于使蛋白处于有利于二硫键形成和提高可溶性的环境,且不需要破菌提纯,大大简化提纯步骤并提高产量。为抗体检测的标准化提供了基础。再加上蛋白芯片检测技术高通量,高灵敏,所需上样量小等特点,将会给不孕抗体的检测提供更多技术选择[17]。
目前,仍缺少检测不孕相关抗体的金标准。本研究利用蛋白芯片检测结果与市售常用的ELISA比较,结果显示蛋白芯片和ELISA检测不孕症患者抗子宫内膜抗体基本符合。尽管如此,我们还需要进行更深入的研究,通过不断地优化抗原和改进工艺,实现对抗子宫内膜抗体的准确诊断。
