枸杞叶发酵物生物活性成分及营养成分的变化研究
2018-07-18杨建平郭建来聂芙蓉韩占兵常选妞
杨建平,郭建来,聂芙蓉,韩占兵,常选妞*
(1.河南牧业经济学院动物科技学院,河南郑州 450046;2.河南省饲料资源开发及安全评价工程技术研究中心,河南郑州 450046)
枸杞(Lycium barbarum)属茄科枸杞属落叶灌木植物,适应性强。传统医学认为枸杞具有“滋肝明目,清肺补肾”之功效,现代临床医学证明枸杞具有抗氧化、抗肿瘤、延缓衰老、增强免疫能力、软化血管、降低血脂等功效,因此枸杞产品日益受到消费者的喜爱。现有研究表明,枸杞叶化学成分与枸杞子类似,主要有多糖类、多酚类、甜菜碱、维生素及多种微量元素,有些含量甚至比枸杞子还要高(陈雅林,2017),具有很高的营养保健功效。但目前枸杞叶并未引起足够的重视,对其相关研究报道较少。因此开展对枸杞传统非药用部位的开发利用具有重要的理论及实践意义。固态发酵技术可改变饲料原料的适口性,提高饲料原料的营养价值,能够促进营养物质的消化吸收和畜禽生长、抵御病原体侵袭、刺激机体免疫器官的成熟、调节物质代谢及降解饲料原料中可能存在的毒素等作用(许镨文,2012)。大量研究结果表明,植物茎叶发酵有利于植物废弃物的高效利用,减少对环境的污染,有利于开辟新的饲料资源,具有良好的经济效益和社会效益(周昊,2014)。本研究以枸杞叶为原料,通过乳酸菌、枯草芽孢杆菌发酵,观察发酵底物中总黄酮、有机酸、粗蛋白质、氨基酸等物质的含量变化,探讨不同菌种发酵对枸杞叶生物活性成分含量的影响,为枸杞叶在饲料中的应用提供参考数据。
1 材料
1.1原料与试剂枸杞叶产自宁夏,干燥粉碎,过60目筛;植物乳杆菌、枯草芽孢杆菌均由本实验室培养选育;营养肉汤培养基、营养琼脂培养基、MRS肉汤培养基购买北京奥博星生物技术有限公司;芦丁对照品(纯度≥98%)购自成都曼斯特生物科技公司;没食子酸对照品(纯度≥98%)乳酸、乙酸、丙酸对照品 购自北京德威钠生物技术有限公司;氨基酸混合标准品(2.5 μmol/mL)购自美国Sigma公司;其他试剂均为分析纯
1.2仪器与设备电子天平 梅特勒公司;高速离心机 Sigma公司; GC-2010plus气相色谱仪岛津公司;UV-160紫外可见分光光度计 莱伯特公司;
2 发酵处理方法
2.1种子液制备
枯草芽孢杆菌:挑取少量冻存的枯草芽孢杆菌菌种划线接种到已灭菌的营养琼脂培养基上,37℃恒温培养24 h进行菌种活化,然后将活化的菌种接种于已灭菌的营养肉汤培养基中,置于恒温摇床中,温度37℃,转速180 r/min,培养24 h备用。
植物乳杆菌:挑取少量冻存的植物乳杆菌菌种划线接种到已灭菌的MRS琼脂培养基上,37℃恒温培养24 h进行菌种活化,然后将活化的菌种接种于已灭菌的MRS肉汤培养基中,置于恒温培养箱中37℃培养24 h备用。
2.2固体发酵试验
发酵条件:一定量的枸杞叶粉,初始含水量35%,接种量10%。37℃培养120 h。
试验分为三个组,A组添加10%植物乳杆菌,B组添加10%枯草芽孢杆菌,C组添加5%的植物乳杆菌和5%的枯草芽孢杆菌。
3 含量测定
3.1常规营养成分的测定粗蛋白质含量测定依据GB /T 6432—1994《饲料中粗蛋白质测定方法》;粗纤维含量测定依据GB /T 6434—2006《饲料中粗纤维的含量测定方法》;粗灰分含量测定依据GB /T 6438—2007《饲料中粗灰分的测定》;粗多糖测定按照SN/T 4206-2015方法;乳酸测定按照GB/T 23877—2009方法;水分含量测定依据GB/T 6435 - 2014《饲料中水分的测定》;氨基酸的测定依据GB /T 18246—2000《饲料中氨基酸的测定》。
3.2有机酸测定供试品溶液的制备:称取发酵枸杞叶3.0 g于250 mL具塞锥形瓶中,准确加入10 mL丙酮,盖塞,超声提取15 min,过滤,滤液过0.45 μm供气相色谱用。
气相色谱条件:检测器:FID检测器;温度:270℃;进样口温度:250℃;分流比:10;流速:5.0 mL/min;程序升温:100℃(保留0.5 min)→8℃/min升到180℃(保留1 min)→20℃/min升到230℃(保留10 min);柱子:DB-WAX。
3.3总黄酮含量测定
3.3.1供试品溶液的制备取发酵枸杞叶0.5 g于50 mL离心管中,加70%乙醇15 mL,80℃水浴80%功率超声提取15 min,4000 r/min离心5 min,提取液减压抽滤。将滤液定量转移至50 mL容量瓶中,加相同浓度的乙醇定容至刻度,摇匀即得。
3.3.2对照品溶液的制备精确称取芦丁对照品0.005 g,置于小烧杯中,用体积分数70%的乙醇溶解并转移至25 mL容量瓶中定容,摇匀,即得浓度为0.200 mg/mL的芦丁标准品溶液。
3.3.3总黄酮含量的测定吸取2.00 mL 芦丁对照品溶液和样品试液于25 mL容量瓶中,用70%乙醇补充至12.5 mL,加入0.7 mL 亚硝酸钠(1:20),摇匀,放置 5 min 后,加入 0.7 mL 硝酸铝(1:10),6 min 后再加入 5 mL 4.3%的氢氧化钠,混匀,用70%的乙醇定容,10 min 后在波长510 nm 处测定其吸光度,于对照品吸光度比较计算含量。
3.4总多酚含量测定
3.4.1试液的制备称取0.5 g 粉碎的样品于250 mL烧瓶中,准确加入50.00 mL体积分数60%的乙醇溶液,提取液中盐酸含量0.024%,搅拌均匀,在恒温水浴锅中安装好回流装置,水浴温度75℃,提取50 min。提取液以3000 r/min离心20 min,过滤,滤液定量转移至50 mL的容量瓶中,用60%的乙醇定容,摇匀即得供试液。
精确称量没食子酸标准品25 mg,用水溶解后定容于250 mL容量瓶中,得到0.1 mg/mL的标准贮备溶液。分别移取没食子酸标准储备溶液0.00、0.25、0.50、0.75、1.00、1.25、1.50 mL置 于 25 mL具塞试管中,分别加入福林酚试剂1 mL,摇匀后再分别加入质量分数12% Na2CO3溶液2 mL,用水定容至25 mL,摇匀。室温下避光反应2 h 后,在765 nm 波长下测定吸光度。
3.4.2样品多酚含量的测定分别吸取1.00 mL多酚提取液和没食子酸对照品溶液于25 mL具塞试管中,分别加入福林酚试剂1 mL及质量分数为12%的碳酸钠溶液2 mL并定容至刻度,在室温下避光反应2 h,在765 nm波长处测定吸光度,计算提取液中的多酚含量。

表1 发酵前后营养成分的含量变化(干物质计)g/100g
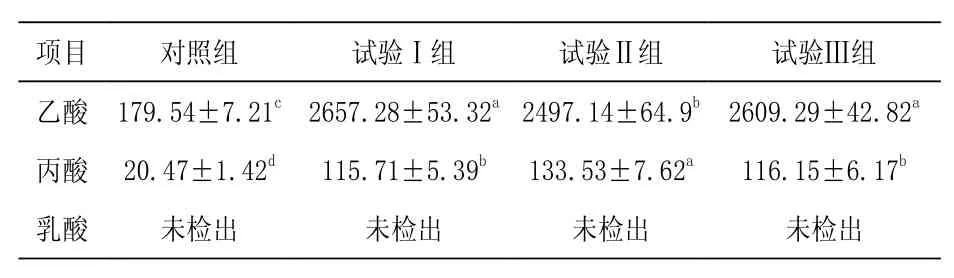
表2 发酵前后枸杞叶中有机酸的含量变化mg/kg
4 数据处理
试验结果使用SPSS19.0 统计软件,Duncan's多重比较检验均值的差异显著性,当P<0.05时,表示差异显著,结果用“平均值(x)±标准差(SD)”表示。
5 结果与分析
5.1不同菌种发酵对枸杞叶营养成分的变化
由表1可知,与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的粗蛋白质含量增加,但差异不显著(P>0.05);与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的粗纤维含量显著增加(P<0.05),分别增加26.65%、26.36%和26.22%;与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的粗灰分含量显著降低(P<0.05),分别降低6.93%、7.09%和10.13%;与对照组相比,三个试验组的氨基酸总量显著降低(P<0.05),分别降低7.01%、7.22%和8.34%;与对照组相比,试验Ⅰ组和Ⅲ组的天冬氨酸和谷氨酸显著降低(P<0.05),试验Ⅱ组和Ⅲ组的缬氨酸显著降低(P<0.05),试验Ⅰ组、Ⅱ组和Ⅲ组的异亮氨酸、亮氨酸和苯丙氨酸显著降低(P<0.05),试验Ⅰ组、Ⅱ组和Ⅲ组甘氨酸显著升高(P< 0.05)。
5.2不同菌种发酵对枸杞叶有机酸含量的影响由表2可知,与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的乙酸含量显著升高(P<0.05),分别增加1 380.05%、1 290.85%和1 353.32%,试验Ⅱ组的乙酸含量显著低于试验Ⅰ组和Ⅲ组(P<0.05);与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的丙酸含量显著升高(P<0.05),分别增加465.27%、552.32%和467.42%,试验Ⅱ组的丙酸含量显著高于试验Ⅰ组和Ⅲ组(P<0.05)。三个试验组的乳酸含量均未检出。
5.3不同菌种发酵对枸杞叶粗多糖、黄酮和多酚含量的的影响从表3可见,与对照组相比,试验Ⅰ组和Ⅱ组的粗多糖含量显著降低(P<0.05),分别降低17.30%和10.55%,试验Ⅲ组的粗多糖含量无显著变化(P>0.05);与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的黄酮含量显著降低(P<0.05),分别降低49.10%、58.11%和55.86%;与试验Ⅰ组相比,试验Ⅱ组和Ⅲ组的黄酮含量较低,且差异显著(P<0.05);与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组的多酚含量显著降低(P< 0.05),分别降低 26.67%、67.27%和 33.94%,与试验Ⅱ组相比,试验Ⅰ组和Ⅲ组的多酚含量较高,且差异显著(P<0.05)。
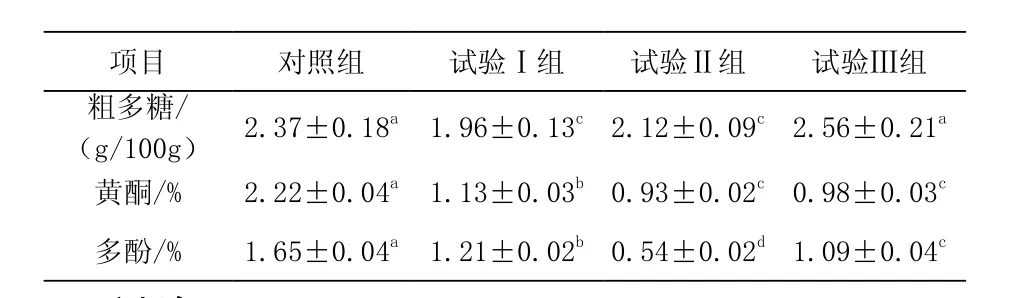
表3 发酵前后枸杞叶中粗多糖、黄酮和多酚的含量变化
6 讨论
6.1枸杞叶发酵对常规营养成分含量的影响孙林等(2017)研究发现,以菜籽粕为原料,用枯草芽孢杆菌、植物乳杆菌和混菌发酵,发酵产物中粗蛋白质含量和多肽含量较发酵前均有所增加。本试验中,三个不同菌种发酵的枸杞叶粗蛋白质含量都有升高的趋势,可能是发酵用微生物本身含有的菌体蛋白,而提高了粗蛋白质的含量(戚晓舟,2016),而粗纤维含量显著增加和粗灰分含量显著降低,与微生物生长代谢过程中,氧化消耗糖类物质有关。王刚(2011)研究发现,枯草芽孢杆菌发酵菜籽粕,能够较好的把大分子的蛋白质降解为小分子的蛋白质、肽和氨基酸,诸葛斌等(2011)采用混菌发酵棉籽粕,发酵产物中的游离氨基酸含量显著高于单个菌株发酵产物中的含量,且均有较大程度的提高。本试验结果表明,三个发酵组的氨基酸总量显著降低,植物乳杆菌发酵组中仅有甘氨酸显著升高,枯草芽孢杆菌发酵组仅有天冬氨酸、脯氨酸和丙氨酸显著升高,混菌发酵组精氨酸和甘氨酸显著升高,具体原因可能与发酵底物、菌种、接种量以及发酵工艺等相关因素有关,有关发酵对游离氨基酸的影响研究还有待进一步探索。
6.2枸杞叶发酵对粗多糖和有机酸含量的影响由于微生物生长代谢过程中,氧化消耗糖类物质,造成糖类物质的减少(和小黑,2014)。本试验结果表明,接种植物乳酸杆菌和枯草芽孢杆菌的枸杞叶发酵产物中粗多糖含量显著下降,这可能与植物乳酸杆菌和芽孢杆菌可降解植物中的碳水化合物有关(孙琦,2016)。接种混菌的枸杞叶发酵产物中多糖含量升高,可能是枯草芽孢杆菌生长过于迅速,在一定程度上抑制了植物乳杆菌的生长(王增元,2017),从而影响了植物乳酸杆菌降解粗多糖的能力。
单胃动物肠道中挥发性脂肪酸主要包括乙酸、丙酸、丁酸等。乙酸存在外周血液中,对于维持正常的结肠上皮组织具有重要意义;丙酸主要参与肝脏内的吸收与代谢,它的影响主要体现在对碳水化合物和胆固醇的代谢方面(毛倩,2009)。目前认为有益微生物进入肠道后能产生乳酸、乙酸、丙酸和丁酸等挥发性脂肪酸使肠内环境酸化,从而抑制病原菌的生长繁殖,这是益生素的作用机理之一(刘辉,2008)。本试验结果发现,三个发酵组的有机酸含量显著高于对照组,且不同的菌种发酵产物中有机酸含量不同。其中,植物乳酸杆菌组的乙酸含量高于枯草芽孢杆菌组,枯草芽孢杆菌组丙酸含量高于植物乳酸杆菌组,挥发性脂肪酸含量的增加可能是生产性能改善的原因之一。但三个试验组的乳酸含量均未检出,可能是发酵时间较短或与发酵底物有关。
6.3发酵对枸杞叶中黄酮和多酚含量的影响
本试验条件下,植物乳酸杆菌组、枯草芽孢杆菌组和混合发酵组的黄酮含量均显著降低,但三个试验组的下降幅度不同,枯草芽孢杆菌及混合发酵的下降更为显著。可能是发酵过程中,益生菌代谢的丰富酶系对黄酮类物质发生了部分转化,破坏了黄酮类化合物能发生显色反应的邻苯二酚结构(郭孝萱,2017)。徐丹等(2017)研究也表明,桑叶发酵会降低其黄酮含量,与本试验结果一致。
7 结论
本试验条件下,利用植物乳杆菌、枯草芽孢杆菌单一菌种发酵或混合发酵菌种发酵枸杞叶,发酵产物中粗蛋白质、乙酸和丙酸含量提高,黄酮和多酚含量下降。
