油茶皂苷W抗肿瘤活性研究
2018-07-17吴江平
吴江平
(安徽省中医药科学院,亳州中医药研究所,安徽 亳州 236800;苏州大学药学院,江苏 苏州 215123)
张珺,刘超祥
(安徽省中医药科学院,亳州中医药研究所,安徽 亳州 236800)
刘艳丽,许琼明,李笑然,杨世林
(苏州大学药学院,江苏 苏州 215123)
油茶(CamelliaoleiferaAbel)是山茶科(Theaceae)山茶属(CamelliaLinn)植物,油茶皂苷W是从油茶根30%乙醇大孔树脂洗脱部位中提取分离得到的一种齐墩果烷型皂苷类单体化合物,化学名称为22α-O-当归酰基-15α,16α,28-三羟基齐墩果-12-烯 3β-O-β-D-木糖-(1→2)-β-D-半乳糖-(1→4)-[β-D-半乳糖-(1→2)]-β-D-葡萄糖醛酸苷,其分子式为C58H92O26,相对分子质量为1204.5877。迄今为止,国内外对油茶皂苷单体化合物的药理活性研究较少。Chen等[1]研究表明,油茶皂苷单体化合物通过诱导细胞周期阻滞与凋亡来抑制肿瘤细胞MCF-7的增殖。笔者在前期从油茶根中分离出一系列的油茶皂苷单体化合物,体外试验结果表明其均具有良好的抗肿瘤活性,对人非小细胞肺癌细胞(简称A549细胞)、人乳腺癌细胞(MCF-7)以及人肝癌细胞(SMMC-7721)均具有不同程度的抑制作用且呈现出时间与剂量的依赖关系,研究发现油茶皂苷W能够诱导肿瘤细胞发生凋亡,且能够诱导肿瘤细胞周期阻滞于G2/M期[2~4]。为了给开发新型抗肿瘤药物提供科学依据,笔者对油茶皂苷W的体内外抗肿瘤活性进行了探讨。
1 材料与方法
1.1 材料、仪器与试剂
实验细胞株与A549细胞、H22小鼠肝癌细胞均购自中国科学院上海细胞库。实验动物ICR小鼠为清洁级,18~22g,雄性,购于上海斯莱克实验动物有限责任公司。油茶皂苷W由苏州大学天然药物化学教研室提供,HPLC-ELSD显示纯度>98%;LC-3(兔多克隆抗体,ab51520)、Beclin-1(兔单克隆抗体)购自美国Abcam公司;β-actin(鼠单克隆抗体,3700)购自美国CST公司;羊抗兔多克隆抗体(Lot#111066)、羊抗鼠多克隆抗体(Lot#110692)购自美国KPL公司;RPMI-1640培养液、小牛血清(NBS)购自美国GIBCOBRL公司;氯喹(CQ)购自美国Sigma公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自美国Biosharp公司;注射用环磷酰胺(CTX)为江苏恒瑞医药股份有限公司产品;去甲斑蝥素(Norcantharidin)购自美国Sigma公司;Gimesa染液为南京建成科技有限公司产品;细胞裂解液(RIPA裂解液、PMSF)和Annexim V-FITC/PI染液PBS缓冲液(磷酸盐缓冲盐水)为碧云天生物科技有限公司产品。
BB-15型二氧化碳培养箱:德国Thermo Scientific公司;Thermo MVLTISKANFC型酶标仪:德国Thermo Scientific公司;LI-COR型红外激光成像系统:美国Odssey公司。
1.2 方法
1.2.1 细胞培养
将A549细胞置于含青霉素80万U/L、链霉素100万U/L、10%小牛血清(NBS)的RPMI-1640完全培养液中,在37℃、5% CO2的恒温培养箱中培养。用0.25% Trypsin溶液消化细胞进行传代。取3代以后并处于对数生长期的细胞进行计数,然后在37℃、5% CO2恒温培养箱中孵育24h,待细胞完全贴壁后用于各项实验。
1.2.2 MTT实验
收集对数生长期的A549细胞,用含10%小牛血清的RPMI-1640培养基调整细胞悬液浓度至1×105个/mL,每孔加入100μL细胞悬液,置于5% CO2、37℃培养箱中培养24h。分别加入终浓度为3、6、9μmol/L的油茶皂苷W,以终浓度为10μmol/L的Norcantharidin溶液处理作为阳性对照组,分别处理12、24、48h。然后于每孔中加入10μL浓度为5mg/mL的MTT溶液并继续培养4h,弃除上清液,在每孔分别加入100μL DMSO溶液后置于摇床上缓慢振摇15min,使结晶充分溶解,利用酶标仪检测波长为490nm处各孔的光密度值(D)。实验重复3次,取其均值计算油茶皂苷W对肿瘤细胞增殖抑制率,细胞增殖抑制率计算公式如下:
细胞增殖抑制率=(1-D1/D2)× 100%
(1)
式中,D1表示给药组的光密度值,D2表示对照组的光密度值。
1.2.3 细胞形态实验
取对数生长期的A549细胞,用含血清培养基调整细胞浓度为1×105个/mL,混匀后吸取1mL细胞悬液于6孔板中,每组均设3个复孔,在37℃、5% CO2条件下培养24h,次日分组给予200μL/孔 终浓度分别为3、6、9μmol/L的油茶皂苷W,对照组加入等体积的PBS缓冲液,孵育24h后,弃去培养基并用PBS洗涤,用Gimesa染液染色5~10min,用自来水冲洗,于室温晾干后置于显微镜下观察细胞形态并拍照。
1.2.4 MDC自噬荧光强度实验
取对数生长期的A549细胞,用含血清的培养基调整细胞浓度至1×105个/mL并接种于六孔板中(1mL/孔),每组均设3个复孔,在37℃、5%CO2条件下培养24h后,给药组分别加入终浓度为3、6、9μmol/L的油茶皂苷W,对照组加入等体积PBS,恒温孵育6h后,收集培养基吸至离心管中,PBS洗涤1次并收集洗涤液,用胰酶消化细胞并收集后在1200r/min的条件下离心3~5min收集细胞。各组细胞分别加入500μL含浓度为50μmol/L MDC的培养基,放在37℃震荡培养箱内,避光孵育60min,用PBS液洗涤并离心2次后再加入PBS重悬,利用流式细胞仪上样检测荧光强度。
1.2.5 Western Blot 实验
收集终浓度分别为3、6、9μmol/L的油茶皂苷W处理24h后的A549细胞,分别加入200μL细胞裂解液,裂解30 min后于冰上进行细胞破碎,然后在4℃、12000r/min的条件下离心15min并取上清,利用改良的福林酚法测定蛋白含量。用12%~15%SDS-PAGE进行电泳分离蛋白,并转移至NC膜。采用5%脱脂牛奶对膜进行封闭处理,然后在4℃恒温条件下加入浓度为千分之一的一抗溶液5mL并于摇床中震荡孵育过夜;次日,采用TBST溶液洗涤一抗溶液3次,每次10min,然后在室温条件下加入浓度为万分之一的二抗溶液5mL再孵育2h。利用LI-COR型红外激光成像系统扫描,对蛋白条带用Quantity one软件分析。
1.2.6 Annexin V-FITC/PI双染实验
试验设置4个组别,分别是对照组、6μmol/L油茶皂苷W组、CQ组(50μmol/L)和6μmol/L油茶皂苷W+CQ组。取对数生长期的A549细胞,用含血清的培养基调整细胞浓度至1×105个/mL,接种于六孔板中,每孔体积为1mL且均设3个复孔。在37℃、5%CO2条件下培养24h后,CQ组与6μmol/L油茶皂苷W+CQ组预先加入200μL 浓度为50μmol/L的CQ,其他各组分别加入等体积的PBS,继续孵育2h后,中剂量组与6μmol/L油茶皂苷W+CQ组均再加入200μL浓度为6μmol/L的油茶皂苷W,其他各组加入等体积的PBS。继续孵育24h后,收集细胞并采用Annexin V-FITC/PI染料染色,利用流式细胞仪上样分析,统计各组细胞的凋亡率。
1.2.7 小鼠体内H22移植瘤模型实验
1)H22实验 将冻存于液氮罐里的H22小鼠肝癌细胞取出,放入37℃恒温水浴中使细胞快速解冻,加入细胞培养液离心收集细胞,用细胞培养液洗涤细胞2次,再用细胞培养液重悬细胞,经ICR小鼠腹腔传细胞3代以上,待细胞在小鼠体内生长1周左右后,对腹部出现明显膨大的小鼠采用颈椎脱臼法处死,用75%医酒精消毒腹部并对腹部进行解剖,采用规格为2mL的一次性无菌注射器抽取小鼠腹腔乳白色腹水,将腹水放入已灭菌的离心管中离心,用0.9%氯化钠生理盐水重悬细胞,利用细胞计数板调整细胞密度至5×106个/mL,给已适应饲养环境的ICR小鼠右腋接种0.2 mL/只细胞悬液进行造模。次日将小鼠按平均体重随机分为模型组、阳性对照组(CTX 40mg/kg)、油茶皂苷W(1、2mg/kg)组,每组12只,按小鼠体重0.1mL/10g给药。模型组每天一次腹腔注射0.9%氯化钠生理盐水;油茶皂苷W(1、2mg/kg)组每天一次腹腔注射药物,阳性对照组每2d一次腹腔注射CTX(40mg/kg),连续给药10d,每天称取小鼠体重。第11天后,采用颈椎脱臼法处死小鼠,取材、剥离瘤体并称取瘤重,计算抑瘤率,公式如下:
抑瘤率=(1-W1/W2)×100%
(2)
式中,W1表示给药组平均瘤重,g;W2表示模型组平均瘤重,g。
2)HE染色实验 取小鼠肿瘤组织置于pH 7.4、10%福尔马林磷酸缓冲液中,4℃条件下保存备用。制备样品时将将小鼠肿瘤组织包埋在石蜡进行组织切片,用苏木精和伊红染色,于光镜下观察。
3)肿瘤组织制备与观察 将肿瘤组织切成体积为1mm3大小后迅速放入预冷的2.5%戊二醛溶液中,在4℃条件下保存备用。取已固定的肿瘤组织采用磷酸缓冲液冲洗2遍,每次15min,然后用锇酸固定1h;1h后用缓冲液冲洗2次,每次15min,接着分别采用30%、50%、70%丙酮梯度脱水15min,然后置于醋酸铀中过夜。第2天,依次梯度采用80%、90%、100%丙酮脱水15min,置于电镜包埋剂∶100%丙酮=1∶1混合液中浸润1h后,再置于纯包埋剂浸透2h。将处理好的样品放入模具或软囊中进行包埋后放入烘箱聚合,然后将聚合好的样本嵌入环氧树脂中,用玻璃刀切成超薄切片并固定于铜栅格中,用醋酸铀和柠檬酸铅混合液进行染色,采用高分辨透射电镜观察肿瘤组织结构变化。
1.2.8 统计学分析
2 结果与分析
2.1 油茶皂苷W对A549细胞增殖的抑制作用
油茶皂苷W在3~9μmol/L的浓度范围内对A549细胞的增殖有不同程度的抑制作用(图1)。作用12h后的抑制率分别为(2.13±2.68)%、(20.02±5.32)%和(64.15±7.78)%;作用24h后的抑制率分别为(5.27±2.48)%、(47.63±6.97)%和(78.62±7.85)%;作用48h后的抑制率分别为(8.22±2.57)%、(55.07±5.56)%和(83.66±8.31)%。浓度为10μmol/L的 Norcantharidin各个时间点的抑制率分别为(10.18±2.55)%、(50.23±2.56)%和(68.55±3.63)%,这表明油茶皂苷W具有明显的抗肿瘤活性。
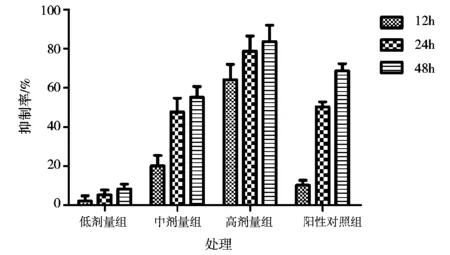
注:低剂量组、中剂量组、高剂量组油茶皂苷W浓度分别为3、6、9μmol/L,图2~5同。图1 不同浓度的油茶皂苷W对A549细胞增殖的抑制作用
2.2 油茶皂苷W对A549细胞生长形态的影响
不同浓度的油茶皂苷W刺激A549细胞24h后,采用Giemsa染色并在光学显微镜下观察细胞的集落与形态(图2)。对照组细胞生长状态良好,细胞核轮廓清晰,染色质明亮,细胞呈不规则贴壁;随着油茶皂苷W浓度的提高,细胞数目明显减少,细胞出现皱缩变圆,染色质浓缩,尤其在油茶皂苷W浓度为6、9μmol/L的时候细胞核出现大量变圆固缩。

图2 不同浓度的油茶皂苷W对A549细胞生长形态的影响
2.3 油茶皂苷W对A549细胞自噬的影响
不同浓度的油茶皂苷W作用于A549细胞6h,通过MDC荧光染色并用流式细胞仪检测荧光强度。结果显示,对照组MDC荧光强度为1.36±0.06,3、6、9μmol/L组MDC荧光强度分别为1.46±0.063、1.49±0.067与1.59±0.108(图3)。与对照组相比,随着油茶皂苷W浓度的提高,A549细胞自噬的强度依次增强,其中9μmol/L组与对照组相比MDC荧光强度差异具有显著的统计学意义(P<0.01)。因此,油茶皂苷W能诱导A549细胞发生自噬。
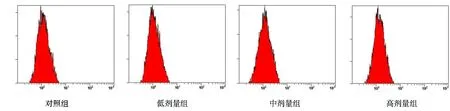
图3 不同浓度的油茶皂苷W对A549细胞自噬影响
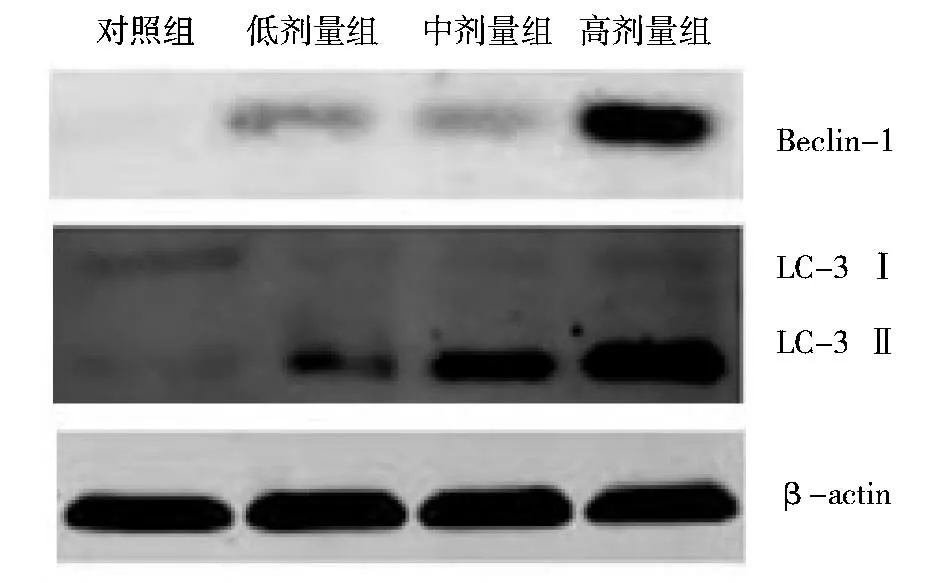
图4 不同浓度的油茶皂苷W对A549细胞中自噬相关蛋白表达的影响
2.4 油茶皂苷W对A549细胞中自噬相关蛋白表达的影响
不同浓度的油茶皂苷W作用于A549细胞24h后,能够明显上调Beclin-1蛋白和LC-3蛋白组的表达(图4)。以β-actin为内参照,从数据统计分析可知,Beclin-1蛋白及LC-3蛋白组的灰度值与对照组比较均具有统计学意义(P<0.05 与P<0.01),且呈现出一定的剂量依赖关系(图 5)。
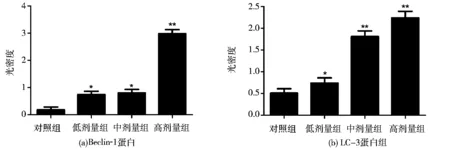
注:*、**分别表示与对照组相比P<0.05和P<0.01。图 5 自噬相关蛋白条带灰度统计分析柱状图
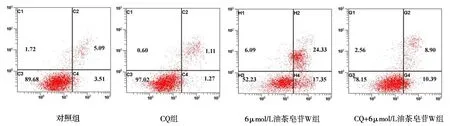
图6 不同浓度油茶皂苷W对A549细胞凋亡影响的流式细胞仪分析图
2.5 细胞自噬对细胞凋亡的影响
不同浓度的油茶皂苷W对A 549细胞凋亡影响的流式细胞仪分析结果如图6所示。对照组与自噬抑制剂(CQ)组的细胞凋亡率分别为(8.60±3.2)%和(2.38±1.3)%;6μmol/L油茶皂苷W组与6μmol/L油茶皂苷W+CQ组细胞的凋亡率分别为(41.88±1.2)%和(19.29±1.5)%。显示预先加入自噬抑制剂CQ,肿瘤细胞凋亡率能够明显降低,且差异具有十分显著的统计学意义(与对照组相比,P<0.001,图7),提示油茶皂苷W诱导肿瘤细胞发生自噬,进而促进细胞的凋亡。
2.6 油茶皂苷W对H22荷瘤小鼠的影响
2.6.1油茶皂苷W对H22荷瘤小鼠肿瘤生长的抑制作用
试验结果表明(表1),油茶皂苷W在1、2mg/kg剂量时,与模型组相比,抑瘤率分别达到25.51%(P<0.05)、54.73%(P<0.01),结果具有统计学意义,表明油茶皂苷W具有良好的体内抗肿瘤药效。

表1 油茶皂苷W对H22荷瘤小鼠肿瘤生长的影响
注:*、**、***分别表示与对照组比较P<0.05、P<0.01、P<0.001。
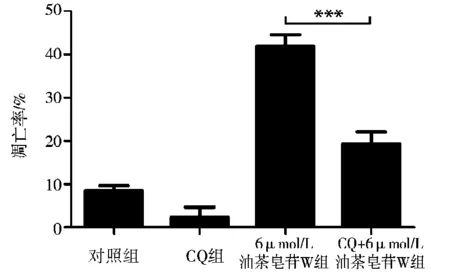
注:***表示6μmol/L油茶皂苷W+CQ组与6μmol/L油茶皂苷W组相比差异极显著(P<0.001)。图7 肿瘤细胞凋亡率统计分析柱状图
2.6.2 油茶皂苷W对H22荷瘤小鼠肿瘤组织病理形态影响
H22荷瘤小鼠肿瘤组织切片经HE染色后在光镜下观察发现(图8),模型组肿瘤细胞排列紧密、分布密集、呈深褐色,细胞体较大;CTX组肿瘤细胞大量坏死,细胞体积变小,细胞固缩,出现不规则坏死,出血;油茶皂苷W组在1、2mg/kg剂量时细胞出现一定程度的坏死和细胞体积缩小,且呈现出一定剂量依赖关系。因此,油茶皂苷W能够明显改变H22荷瘤小鼠的肿瘤组织形态,诱导肿瘤细胞死亡。
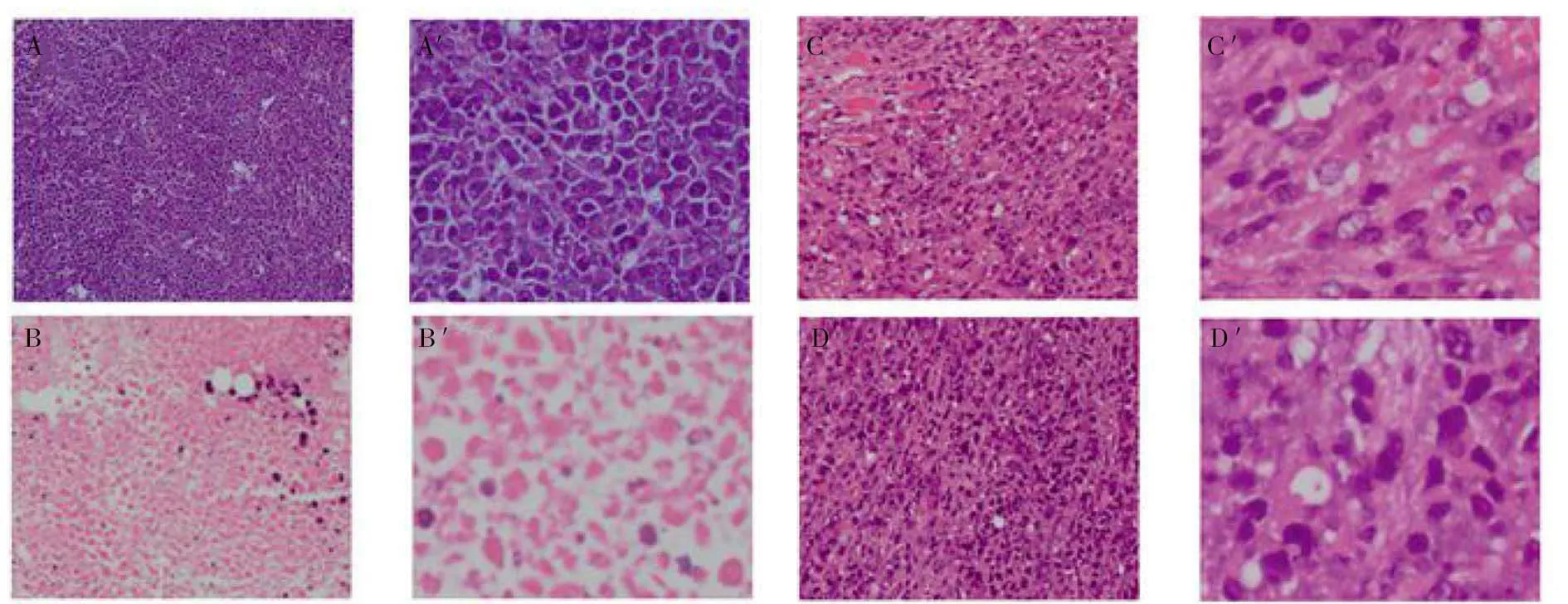
注:A-模型组(100×);B-环磷酰胺组(100×); C-2mg/kg油茶皂苷W组(100×);D-1mg/kg 油茶皂苷W组(100×);A′-模型组(400×);B′-环磷酰胺组(400×);C′-2mg/kg 油茶皂苷W组(400×);D′-1mg/kg 油茶皂苷W组(400×) 图8 肿瘤组织HE染色病理切片观察

注:A-模型组; B-环磷酰胺组;C-2mg/kg 油茶皂苷W组;D-1mg/kg油茶皂苷W 组图 9 透射电镜观察肿瘤细胞超微结构(5000×)
2.6.3油茶皂苷W作用于H22荷瘤小鼠肿瘤组织的超微结构观察
透射电镜观察肿瘤细胞超微结构发现(图9),模型组H22荷瘤小鼠细胞结构完整,轮廓清晰,细胞核大,核膜清晰,核仁明显,染色质分散; CTX组肿瘤细胞大部分发生崩解、染色质凝集、核膜碎裂等细胞死亡现象;1mg/kg油茶皂苷W组发现存在部分细胞核碎裂的现象,2mg/kg油茶皂苷W组存在明显的细胞核碎裂、边缘化以及核仁崩解等肿瘤细胞死亡现象,这在肿瘤组织超微结构上证明了油茶皂苷W具有明显的体内抗肿瘤活性。
3 结语
体外通过MTT法、Giemsa法检测不同浓度油茶皂苷W对A549细胞增殖的影响,结果表明,油茶皂苷W对肿瘤细胞具有良好的生长抑制作用,且呈现出时间与剂量的依赖关系;MDC自噬荧光实验和Western Blot实验表明油茶皂苷W抗肿瘤机制与其诱导肿瘤细胞发生自噬有关,且Annexin-FITC/PI双染实验表明通过抑制肿瘤细胞的自噬能够抑制其凋亡,推测油茶皂苷W可能是通过激活自噬引起细胞凋亡。此外,通过建立体内肝癌H22荷瘤小鼠模型,在小鼠腹腔注射不同浓度的油茶皂苷W,通过HE染色,光镜下观察到肿瘤组织呈现一定程度的坏死,运用透射电镜观察到肿瘤细胞出现了核浓缩、染色质边缘化等凋亡特征,这表明油茶皂苷W亦具有良好的体内抗肿瘤活性。
细胞的自噬性死亡在人类生理、病理等各种疾病的发生发展中有着重要作用[5~9]。癌症作为第一大杀手,极大地威胁着人类生命健康[10]。目前,临床上主要通过手术切除、化疗和放疗来治疗癌症,多数患者会出现免疫力低下等不良反应。在采用放疗与化疗的同时,使用某种辅助药物来诱导肿瘤细胞产生自噬,可以增加肿瘤细胞对放疗、化疗的敏感性,从而达到彻底根治肿瘤细胞的效果。目前,对细胞自噬与肿瘤的关系研究已成为抗肿瘤药物靶点研究的新方向[11~14]。本研究表明,油茶皂苷W能够诱导肿瘤细胞发生自噬,且通过激活自噬的同时能够诱导肿瘤细胞发生凋亡,这为开发油茶皂苷类化合物作为新型抗肿瘤药物提供了依据。
