鼠骨髓间充质干细胞移植对溃疡性结肠炎大鼠结肠的修复作用研究*
2018-07-14高福来纪桂贤张利利李莉崔红梅
高福来 纪桂贤 张利利 李莉 崔红梅
(秦皇岛市第一医院,河北 秦皇岛 066000)
溃疡性结肠炎(ulcerative colitis, UC)是指发生在结肠和直肠的一类慢性非特异性炎症,病变局限于肠粘膜及粘膜下层,患者表现为腹痛、腹泻、粘液脓血便等[1]。有文献报道[2],UC患者发生结直肠癌的风险随着患病时间会显著升高,30年后可达18%。癌症是UC患者死亡的主要原因。近年来UC在我国的发病率也有明显升高趋势。由于其病因及发病机制尚不明确,临床没有特异性治疗方法,主要采用对症治疗,效果一般,患者病情易反复,且迁延不愈,严重影响患者健康和生活质量[3]。陈巧玲等[4]研究采用重组色素上皮源性因子腺病毒(Ad-PEDF)转染小鼠骨髓间充质干细胞(MSCs)后,评估MSCs作为携带PEDF基因载体的可行性,为鼠骨髓间充质干细胞的进一步应用提供了借鉴。骨髓间充质干细胞(BMSCs)是具有多向分化能力的干细胞[5],通过不同的条件干预,能够分为神经元、干细胞、成骨细胞、脂肪细胞和内皮细胞等,在细胞替代治疗和基因治疗中具有重要的临床价值,但是国内外对于BMSCs治疗溃疡性结肠炎的研究较少。故在本次研究中,通过对UC模型大鼠采用骨髓间充质干细胞移植治疗,观察其对大鼠结肠的修复作用,现将结果报告如下。
1 材料与方法
1.1材料雄性BALA/c健康大鼠80只(SPF级),8周龄,体重151~200g,购自凯学生物科技(上海)有限公司,许可证号:NO.0152068。所有大鼠分笼饲养1周,环境条件为20~24℃,相对湿度55%~60%,自然光照周期。
1.2试剂胎牛血清,购于Invitrogen公司;DMEM培养基,购于Thermo公司;PBS缓冲液,购于Solarbio公司;葡聚糖硫酸钠(DSS),购于MP Biomedicals公司;D-乳酸(D-LAC)、二胺氧化酶(DAO)ELISA试剂盒,购于Sigma公司;IL-6、IL-10、TNF-αELISA试剂盒,购于北京百奥莱博科技有限公司;髓过氧化物酶(MPO)检测试剂盒,购于南京建成生物工程研究所;淋巴细胞分离液,购于天津灏阳生物有限公司。
1.3仪器石蜡切片机,购于LEITZ公司;光学显微镜,购于洛阳惠尔纳米科技有限公司;组织捣碎匀浆机,购于天津博天胜达科技发展有限公司;台式离心机,购于湖南赫西仪器装备有限公司;自动酶标仪,购于昆山吉和力仪器有限公司;超净工作台,购于苏州净化设备仪器公司。
1.4方法
1.4.1细胞提取取2只大鼠,采用10%的水合氯醛450mg/kg进行腹腔麻醉,腿部消毒,无菌条件下切开皮肤、肌肉,将两侧股骨分离取出,置于无菌纱布上,除尽股骨上的软组织,剪掉股骨两端。使用5ml注射器抽取2ml肝素生理盐水,从一端插入骨髓腔,冲洗出骨髓,收集骨髓于无菌离心管内。然后离心处理,3000r持续5min,弃去上清液,加入3ml生理盐水重悬;再取一个无菌离心管,加入密度为1.092的大鼠淋巴细胞分离液12ml,取3ml骨髓细胞悬液加入此管内,离心处理,3000r持续20min,此时管内分4层,从上向下吸取第2层液体,置于无菌离心管内,用5ml无菌血清DMEM培养液洗涤,再次离心,3000r持续5min,弃去上清液,加入2mlPBS缓冲液;取16μlPKH26加入一个装有2mlDihentC的离心管内,然后将骨髓细胞混合悬液加入此管中,孵育5min,缓慢摇匀,加入4ml胎牛血清,孵育1min,加入8mlDMEM培养液洗涤,离心,3000r持续10min,弃去上清液,用DMEM继续洗涤3次,弃去上清液,加入6ml生理盐水重悬。
1.4.2大鼠分组与造模选择75只大鼠,按照随机数字表法,将其分为正常组、模型组、低浓度组、中浓度组和高浓度组各15只。正常组大鼠给予正常饮食水饲养。其余4组大鼠建立UC模型:将DSS溶于蒸馏水中,配制成5%DSS溶液,给予大鼠饮用1周,然后给予大鼠蒸馏水饮用1周,如此反复4次,UC模型建立。低、中、高浓度组大鼠采用尾静脉注射BMSCs悬液0.4ml,细胞浓度分别为0.5×106/ml、1×106/ml和2×106/ml。模型组和正常组大鼠尾静脉注射0.4ml生理盐水。正常饮食水饲养。每组大鼠在移植后第0、7、21d各处死5只大鼠,对相关情况及指标进行观察检测。
1.5观察指标①大鼠活动和体征的观察:记录大鼠每天体重、大便性状和便血情况,并采用疾病活动指数(DAI)进行评分,每项分为0~4分,总分12分,分数越高,大鼠病情越严重。②大鼠血清相关指标的检测:抽取大鼠内眦静脉血2ml,离心处理,取上清液即为血清,使用检测试剂盒,按照说明书操作,检测TNF-α、IL-6、IL-8、D-LAC、DAO含量。③病理切片的制作:将大鼠处死后,取距离肛门10cm以上的结肠组织,使用10%甲醛固定,常规石蜡包埋处理,切片,HE染色后封片,光学显微镜下观察。④MPO的测定:将大鼠处死后,称取结肠组织,按照重量:体积=1:19的比例加入HTAB缓冲液,制成5%的组织匀浆,然后加入PBS缓冲液,在460nm波长下,测定吸光度值,计算出MPO的含量。

2 结果
2.1各组大鼠结肠组织病理切片观察①正常组大鼠结肠粘膜结构完整,无水肿、溃疡,无炎症。②模型组大鼠结肠粘膜明显减少或消失,充血水肿,有溃疡,大量炎性细胞浸润。③④⑤各浓度组大鼠结肠充血水肿情况好于模型组,溃疡和糜烂减少,炎性细胞减少,并且随着浓度的升高,结肠粘膜结构越好。
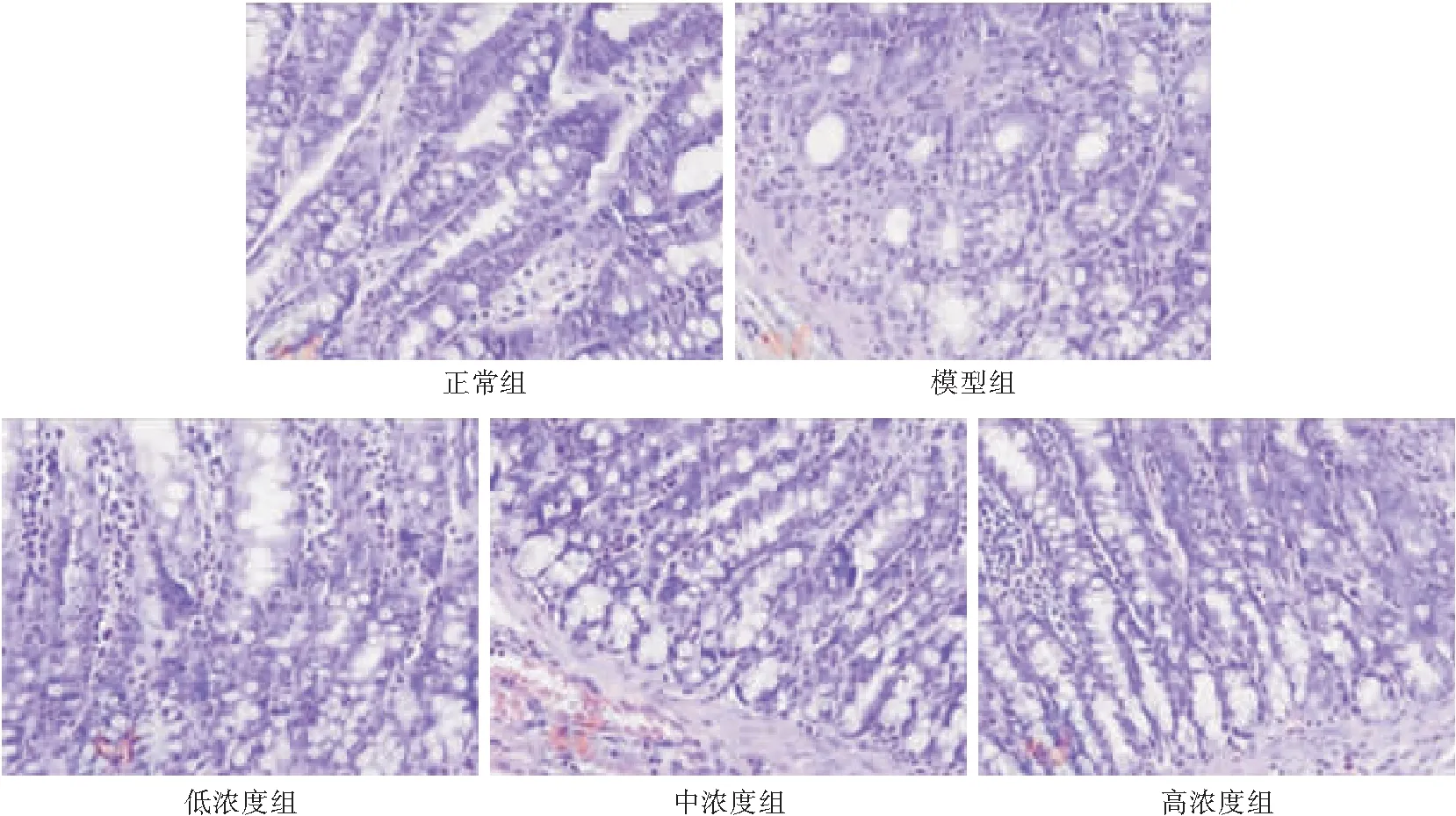
图1 各组大鼠结肠组织病理切片Figure 1 Colonic histopathological sections of rats in different groups注:①正常组,②模型组,③低浓度组,④中浓度组,⑤高浓度组
2.2各组大鼠血清TNF-α、IL-6、IL-8含量比较模型组大鼠血清TNF-α、IL-6、IL-8含量明显高于正常组,差异有统计学意义(P<0.05);低、中、高浓度组TNF-α、IL-6、IL-8含量均低于模型组,并且随着浓度的升高,各组TNF-α、IL-6、IL-8含量均降低,差异均有统计学意义(P<0.05),见表1。
2.3各组大鼠不同时间段血清D-LAC含量比较移植后第0d,正常组大鼠血清D-LAC含量明显低于其余各组,差异均有统计学意义(P<0.05);移植后第7d,模型组与低浓度组大鼠血清D-LAC含量高于其余组(P<0.05);移植后第21d,低、中、高浓度组大鼠血清D-LAC含量与正常组无差异(P>0.05),但低于模型组(P<0.05),见表2。
2.4各组大鼠不同时间段血清DAO含量比较移植后第0d,正常组大鼠血清DAO含量明显低于其余各组,差异均有统计学意义(P<0.05);移植后第7d,模型组与低浓度组大鼠血清DAO含量高于其余组(P<0.05);移植后第21d,各组大鼠血清DAO含量均无差异(P>0.05),见表3。
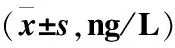
表1 各组大鼠血清TNF-α、IL-6、IL-8含量比较Table 1 Comparison of serum TNF-α, IL-6 and IL-8 content of rats in different groups
注:与模型组比较,①P<0.05;与低浓度组比较,②P<0.05;与中浓度组比较,③P<0.05

表2 各组大鼠不同时间段血清D-LAC含量比较Table 2 Comparison of serum D-LAC content in different time periods of rats in different groups
注:与模型组比较,①P<0.05;与低浓度组比较,②P<0.05

表3 各组大鼠不同时间段血清DAO含量比较Table 3 Comparison of serum DAO content in different time periods of rats in different groups
注:与模型组比较,①P<0.05;与低浓度组比较,②P<0.05
2.5各组大鼠不同时间段结肠MPO含量比较移植后第0d,正常组大鼠结肠MPO含量明显低于其余各组,差异均有统计学意义(P<0.05)。移植后第7d,模型组与低浓度组大鼠结肠MPO含量高于其余组(P<0.05);移植后第21d,各组大鼠结肠MPO含量均无差异(P>0.05),见表4。
2.6各组大鼠不同时间段DAI评分比较移植后第0、7、21d,正常组大鼠DAI评分均为0,明显低于其余各组,差异均有统计学意义(P<0.05);移植后第7、21d,各组DAI评分均下降,低、中、高浓度组低于模型组,且随着浓度的升高,DAI评分越低,差异均有统计学意义(P<0.05),见表5。
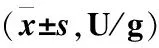
表4 各组大鼠不同时间段结肠MPO含量比较Table 4 Comparison of colonic MPO content in different time groups of rats in different groups
注:与模型组比较,①P<0.05;与低浓度组比较,②P<0.05

表5 各组大鼠不同时间段DAI评分比较Table 5 Comparison of DAI scores in different time periods of rats in different groups
注:与模型组比较,①P<0.05;与低浓度组比较,②P<0.05;与中浓度组比较,③P<0.05
3 讨论
骨髓间充质干细胞是来自于中胚层的干细胞,主要存在于骨髓中[6],因其具有增殖传代能力强、多向分化潜能、不存在伦理问题和排斥反应等特点,是最有前途的组织工程种子细胞[7],在不同条件下可以向成骨细胞、软骨细胞、脂肪细胞、心肌细胞以及神经细胞分化[8-9]。溃疡性结肠炎发病数近年来有明显增多趋势,患者病程长,病情进行性加重,而且会伴发大量严重并发症,如肠梗阻、肠穿孔、出血等[10],严重影响了患者的生活质量。由于其病因及发病机制不明,主要认为以炎症免疫机制[7]为主,尽管治疗方法较多,但大多为抗炎对症治疗,缺乏特异性,难以根治。骨髓间充质干细胞具有很强的分化能力,可以通过不同的条件诱导形成多种细胞组织,而且可以向炎症、损伤的组织迁移[12]。有文献报道称[13],BMSCs还有特殊的免疫特点,可以在异体内存活分化。因此采用BMSCs移植治疗UC的研究也逐渐增多,但对其作用机制的研究相对较少。
正常的肠道内环境的保护作用主要是依靠肠粘膜屏障,由肠粘膜上皮和细胞间连接复合体组成[14],能够分隔肠腔内物质,防止肠道内菌群失调。其中肠粘膜屏障功能的主要指标是肠道通透性[15]的检测,包括肠粘膜的形态学检查,血液D-LAC和DAO的检测。正常人体内D-LAC含量极低,一方面是自身不合成,另一方面是缺乏代谢的相关酶,主要是由肠道内细菌代谢或裂解产生。当肠道通透性增加时,细菌增多,产生大量的D-LAC进入血液。DAO是肠绒毛上皮细胞的标记酶,当肠粘膜受损时,细胞内的DAO大量入血[16]。两种物质均能够间接反映肠粘膜的损伤程度,从而提示肠道屏障功能。
结肠粘膜细胞作为维持肠道功能的结构基础,UC经常伴随结肠粘膜上皮细胞加速凋亡,而且由于肠道内产生大量的炎性细胞因子以及介质,进一步加剧了损伤肠粘膜屏障功能[17-18]。在本研究中,经过干细胞移植后,观察大鼠结肠镜下切片,发现模型组大鼠结肠粘膜明显减少或消失,充血水肿,有溃疡,大量炎性细胞浸润,提示UC大鼠肠道屏障功能被破坏。低、中、高浓度组大鼠结肠充血水肿情况好于模型组,溃疡和糜烂减少,炎性细胞减少,而且结肠的状态呈明显的浓度相关性,说明干细胞移植能够明显改善UC大鼠肠粘膜损伤情况,修复肠道屏障。模型组大鼠血清TNF-α、IL-6、IL-10含量明显高于正常组(P<0.05),说明溃疡性结肠炎的发生发展与炎症反应有关。TNF-α、IL-6、IL-8都是重要的促炎症细胞因子,可由巨噬细胞和T细胞分泌[19],通过诱导和促进炎症反应,使肠道黏膜屏障被破坏,以至于产生溃疡,而且加强了细胞通透性,引起中性粒细胞大量浸润[20],加重炎症。低、中、高浓度组TNF-α、IL-6、IL-10含量均低于模型组,并且随着浓度的升高,各组TNF-α、IL-6、IL-10含量均降低(P<0.05),说明干细胞移植具有抑制炎症反应的作用。移植后第7d,模型组与低浓度组大鼠血清D-LAC、DAO、组织MPO含量高于其余组(P<0.05);移植后第21d,低、中、高浓度组大鼠血清D-LAC、DAO、组织MPO含量与正常组无差异(P>0.05),这说明高浓度的干细胞移植治疗,可以明显修复大鼠肠道屏障,起效时间快。MPO是中性粒细胞的一种酶,可以用来反应结肠组织的炎症反应程度[21]。移植后第7、21d,各组DAI评分均下降,低、中、高浓度组低于模型组,且随着浓度的升高,DAI评分越低(P<0.05),这提示干细胞移植能够改善大鼠病情,缓解肠道症状[22]。
4 结论
采用鼠骨髓间充质干细胞移植治疗溃疡性结肠炎大鼠,能够明显改善大鼠病情,其机制可能是通过抑制炎症因子的分泌,从而减轻炎症反应,使肠道屏障功能恢复。但具体的作用机制还需要进一步深入研究。
