铝胁迫对草本植物生理的影响机制
2018-07-13黄玉婷刘大林张卫红
黄玉婷,吴 亚,刘大林,张卫红
(扬州大学动物科学与技术学院,江苏 扬州 225009)
经济的快速发展带来的环境污染问题日益严重,其中人类排放的大量二氧化硫、氮氧化物等物质溶解在雨中形成酸雨,酸雨落入土壤中,再加上生理酸性肥料的大量施用以及工厂排污对土壤的直接酸蚀,加快了土壤酸化,致使酸性土壤占世界可耕地土壤面积的50%[1],而我国酸性土壤占据了全国土地总面积的22.7%[2]。铝(Aluminum,Al)是地壳中含量最丰富的金属,约占其总质量的7.1%[3]。由于许多植物对微摩尔浓度的铝敏感,所以土壤可能具有铝毒性[4],而铝在土壤中通常以难溶性沉淀物的形式存在,对植物无毒,但当土壤呈酸性甚至pH低于5时,铝的活性增加,结合态铝转变为离子态,铝离子释放到土壤,对土壤中的植物产生毒害,并且随着pH的降低,高活性铝的含量迅速上升,植物生长受到严重制约,铝胁迫是限制酸性土壤上的草本植物生产的最主要因素[5]。
铝毒通过土壤进入植物体,再由食物链进入到人体中,人体摄入过多后会在机体中蓄积,难以迅速排出体外。所以铝对人体神经、骨组织、免疫系统等有影响[6]。草本植物生长快,生物学产量高,不仅是人类和畜禽的食物来源,还具有美化环境、防风固沙、制造氧气等作用。为此,综述铝胁迫对草本植物的农艺性状、光合呼吸作用、活性氧和抗氧化酶系统、渗透调节物质以及根系活动和次生代谢物的影响,并提出应对铝胁迫的对策,以期为减缓铝毒对草本植物甚至整个生物圈的各种危害提供帮助。
1 铝胁迫对草本植物农艺性状的影响
铝对植物的地上部分和地下部分都有毒害作用,但相对而言,铝对植物地上部分的毒害作用一般滞后于根部[7]。Rengel等Ribubsib[8]指出,在铝胁迫下一年生黑麦草(Loliummultiflorum)根系吸收的铝大部分残留在根系组织中,而向茎中运输的铝则为极少部分。此外,植物对铝的敏感性与铝在植物根尖的积累有关,根系伸长率随根尖铝的积累量的增加而减少[9]。
铝对植物的毒害作用主要表现在根上,根是植物吸收水分和养分的器官[10],而铝毒阻断了细胞分裂机制,导致根不能通过细胞分裂而伸长,使得根变得干而脆,主根粗短,根毛发育不良,根尖肿胀、颜色变褐[5]。崔雪梅等[11]对油菜(Brassicanapus)的研究发现,铝胁迫下油菜幼苗的相对根长显著减小,并且随着铝浓度上升,相对根长减小趋势更明显。Ryan等[12]研究表明,根尖是铝毒害的关键部位。根尖的分生区和伸长区对铝高度敏感,铝容易在此积累,因此分生区和伸长区的物理损伤远多于成熟区[13]。有研究指出,铝毒干扰根尖和侧根的细胞分裂,通过交联果胶增加细胞壁刚性,以及通过增加双螺旋的刚度来减少DNA复制,在土壤和植物根表面固定少量磷,降低根呼吸和一些酶的功能,减少细胞壁多糖的沉积,干扰细胞分裂素的产生和转运,同时改变质膜的结构和功能,从而使根生长受抑制[14]。
铝毒也会抑制地上部分的生长。萧凤迴等[15]研究表明,铝胁迫下绿豆(Vignaradiata)的上胚轴长度和重量均受到抑制,从而其株高降低,总生物量减少。此外铝胁迫抑制了植物营养物质的积累,使其叶面积变小[16]。但也有研究表明,低浓度铝对植物生长具有促进作用,只有当铝浓度超过植物耐受临界值之后才会表现出毒害作用[17]。刘影[5]研究发现,扁穗牛鞭草(Hemarthriacompressa)在低浓度铝处理时,其根长相对伸长率、相对株高、相对叶长和相对叶宽较未经铝处理组都有所增加,但在高浓度铝胁迫下,其根长相对伸长率、相对株高、相对叶长和相对叶宽则呈现下降趋势。陈振等[18]也有研究表明,狗牙根(Cynodondactylon)在低浓度铝处理对其生长具有促进作用,而在中等浓度和高浓度对其生长则表现出抑制作用,且狗牙根受毒害程度与铝离子浓度及胁迫时间均呈正相关关系(表1)。
2 铝胁迫对草本植物光合呼吸作用的影响
2.1 铝胁迫对叶绿素含量的影响
叶绿素是衡量植物光合能力强弱最重要的一类色素,其含量的高低与光合作用密切相关,而光合作用(photosynthesis)是植物生长最重要的途径,也是植物合成有机物并获得能量的根本来源。研究表明,铝毒害破坏了植物叶绿体被膜,导致叶绿素含量降低[19],其中叶绿素a和叶绿素b下降幅度较大,且叶绿素a比叶绿素b较敏感,所以叶绿素a/b的比值也大幅度下降,而叶绿素a/b比值的降低抑制了植物的收集并转化光能能力,降低了光合效率[20-21]。但李淮源等[22]研究表明,短期内铝胁迫使烤烟(Nicotianatabacum)烟苗中叶绿素含量显著增加,长期的铝胁迫对其含量没有明显影响;杨振德等[23]对桉树(Eucalyptusspp.)幼苗的研究也得出相同结果。该结果可能是烟苗以及桉苗对铝毒的抗逆性反应,也可能是与试验材料等外在因素有关,还需进一步研究证实。
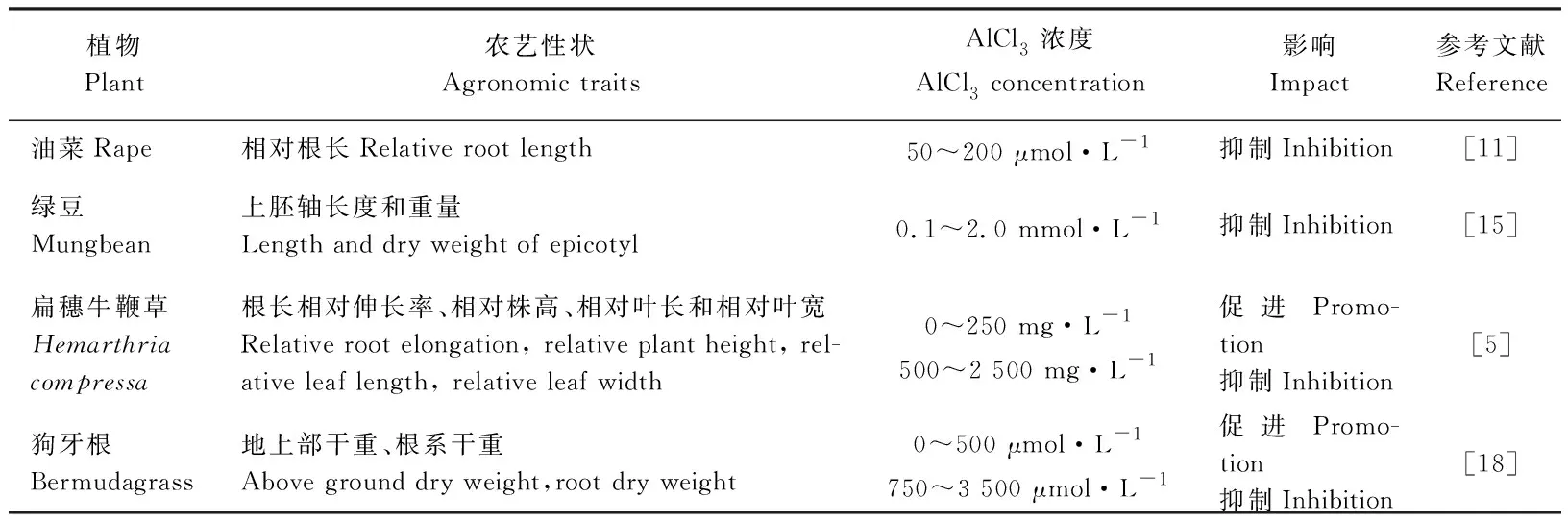
表1 不同铝浓度对草本植物的影响Table 1 Effect of different aluminum concentrations on herbaceous plants
2.2 铝胁迫对气孔特性的影响
光合速率和气孔导度存在一定的线性关系。气孔作为植物叶片中空气和水蒸气的通路,直接控制着CO2的进入和叶片的蒸腾作用[24],也间接地对叶片的光合作用产生了影响。Wong等[25]提出光合速率受气孔导度影响,同时光合速率对气孔导度具有反馈调节作用,即在正常光合作用时,气孔导度增大,光合作用受阻碍时,气孔导度减小,因此光合速率与气孔导度之间遵循严格的线性关系[19,21]。
逆境环境胁迫下,光合作用的限制因子分为气孔因子和非气孔因子[26]。李淮源等[22]研究表明,铝胁迫主要通过调节气孔导度或气孔开关从而影响光合作用。低浓度铝胁迫下,烤烟叶片净光合速率、气孔导度以及蒸腾速率反而升高;而在高浓度铝胁迫下,各项指标才明显降低。该研究结果在高浓度铝胁迫下由于烟苗气孔导度下降导致其光合速率下降,即受气孔因素影响。然而在肖宜安等[27]研究中,高铝胁迫下的车前(Plantagoasiatica)光合速率和蒸腾速率明显降低,气孔导度下降,胞间CO2浓度升高,严重抑制了叶片的光合作用。该种随着胞间CO2浓度升高,气孔限制值降低的结果从Farquhar和Sharkey[26]的观点(由胞间CO2浓度降低的同时气孔限制值增大推测出光合速率降低的起因是气孔导度降低)推测是非气孔因素抑制了叶片光合作用,即光合速率下降是由光合机构活性的降低所引起的,李亚敏等[28]对黄芩(Scutellariabaicalensis)的研究结果也证实了这一点(表2)。
2.3 铝胁迫对呼吸作用的影响
呼吸作用(respiration)是新陈代谢的基础,它不仅能产生各种中间产物和能量,用以合成多种有机物,还有利于物质的转化和运输。线粒体是呼吸作用的主要反应场所,是生物体的能量供应站。大量研究表明,铝胁迫下植物总呼吸速率降低[29],并且铝可以进入细胞质[30]和线粒体,进入线粒体的铝量占根系匀浆中铝的10%~20%[31]。铝抑制呼吸作用的原因可能是由于铝进入植物细胞的线粒体,从而抑制了己糖磷酸激酶活性,阻碍了己糖磷酸化作用;也可能首先是线粒体膜上H+-ATP酶和H+-PP酶活性受抑制,跨线粒体膜电化学势梯度下降,呼吸底物进入线粒体减少的结果[32]。
研究表明,铝抑制植物根系伸长的主要原因是由于植物细胞内活性氧(ROS)的过度积累[33-34]。细胞色素呼吸和交替呼吸组成了植物的呼吸作用,植物细胞线粒体电子传递至O2的末端氧化酶分别为细胞色素氧化酶(COX)和交替氧化酶(AOX)。由于其电子不易泄露致使细胞色素呼吸成为呼吸电子传递的主要方式,而在逆境条件抑制了细胞色素呼吸,因此阻碍了呼吸链电子传递,致使电子泄露程度较高并与O2结合形成活性氧。交替呼吸则是细胞色素呼吸的竞争途径,逆境条件导致细胞呼吸速率升高,过剩电子通过交替氧化酶传递给O2形成水,能有效减少线粒体内活性氧的产生[35-36]。刘强等[37]的研究显示,铝胁迫致使烟草叶片呼吸作用下降,其中细胞色素的呼吸速率明显下降,而活性氧的含量显著上升,证实了铝胁迫下烟草呼吸链电子传递受阻与体内ROS的产生以及铝毒害密切相关。

表2 铝胁迫对草本植物光合作用的影响Table 2 Effect of aluminum stress on the photosynthesis of herbaceous plants
3 铝胁迫对草本植物活性氧和抗氧化酶系统的影响
活性氧即氧的某些代谢产物以及一些反应的含氧产物。植物细胞能够通过多种如分子氧单电子还原过程、某些酶催化过程和某些低分子氧化物的自动氧化的途径,不断产生·O2-、H2O2和·OH等活性氧。正常条件下,活性氧的产生与清除平衡,不会对植物细胞产生伤害[38]。而逆境胁迫打破了这种平衡,使植物体内活性氧浓度升高,导致膜脂过氧化,产生毒害作用,严重时导致细胞死亡。近年来对豇豆(Vignaunguiculate)[39]、大豆(Glycinemax)[40]、小麦(Triticumaestivum)[41]、黑麦(Secalecereal)[42]以及烟草[43]等的研究都表明铝胁迫促使活性氧浓度上升(表3)。此外,有研究发现活性氧还能作为逆境信号,由信号传导促使植物对逆境作出反应,增强抗逆性[42,44]。

表3 草本植物中的活性氧对铝胁迫的响应Table 3 Response of active oxygen to aluminum stress in herbaceous plants
抗氧化酶是植物体内清除活性氧的重要酶类,它能维持活性氧的产生和清除平衡,保护细胞免受伤害。在一定的铝浓度内,活性氧浓度的升高可以提高抗氧化酶活性,清除活性氧物质,增强抗氧化胁迫能力[45]。抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)及谷胱甘肽还原酶(GR)等。植物细胞内的SOD在各种酶促活性氧清除系统中处于第一道防线,催化·O2-发生歧化反应生成相对稳定的H2O2和O2,清除·O2-。CAT和POD则是主要将H2O2变成H2O,从而清除H2O2。通过SOD、CAT以及POD三者协调一致的作用,可以降低活性氧浓度,使之维持在一个较低的水平,减少对植物的伤害。GR则是叶绿体中清除H2O2的重要酶之一[46]。张争艳[47]对大豆的研究以及陈志刚等[48]对多花黑麦草(L.multiflorum)的研究都表明,随着铝浓度的升高,SOD、POD和CAT的活性先增后减。这些酶活性的维持和提高是植物在铝胁迫下抵御逆境伤害机制的体现[38,48](表4)。

表4 草本植物中抗氧化酶对铝胁迫的响应Table 4 Response of antioxidant enzymes to aluminum stress in herbaceous plants
4 铝胁迫对草本植物渗透调节物质的影响
渗透调节指的是植物在逆境条件下通过主动增加溶质,提高细胞液浓度,降低渗透势,以有效地增强吸水和保水能力[49]。渗透调节物质主要包括两大类:一是由外界进入的无机离子,如K+、Cl-、Na+、Mg2+等;二是细胞自身合成的有机溶质,包括可溶性蛋白、可溶性糖、脯氨酸、甜菜碱等。在各类逆境条件下,植物的有机和无机渗透调节物质都起着重要作用[50]。
可溶性蛋白指可以以小分子状态溶于水或其他溶剂的蛋白,测定其含量也可以衡量植物在某种条件下是否会发生重金属胁迫,其含量的增加能维持植物细胞正常的渗透势[51]。肖祥希等[52]研究结果表明,铝胁迫下,龙眼的可溶性蛋白含量下降。马丽和杨盛昌[53]对海莲(Brugierasexangular)的研究也得出相似结果,导致该结果的主要原因有:蛋白酶活性提高加剧了蛋白质的水解;铝毒致使活性氧浓度上升,最终导致蛋白质的合成受抑制[38]。然而张华宁等[54]对大麦(Hordeumvulgare)的研究结果表明,铝毒导致大麦叶片中的可溶性蛋白含量先升高后降低,这可能是铝胁迫下植物细胞的相关基因得以表达,使植物体内蛋白质合成量增加[55],此外,铝胁迫促使抗性蛋白的产生[56],铝浓度的上升降低了蛋白质合成酶的活性,提高了分解酶的活性,降低了可溶性蛋白含量[54,57]。
可溶性糖是一种重要的渗透调节物质,在植物体内,其含量会受盐胁迫、水分胁迫、冷胁迫影响而产生显著变化[58]。胡雪华等[59]研究表明,在短期高浓度的铝作用下,车前的可溶性糖含量上升;而在长期高浓度铝的作用下,车前的可溶性糖含量明显下降。出现该现象的原因可能是植物在胁迫初期通过积累可溶性糖来增强抗逆性,但高浓度长期作用导致叶片受损,光合作用系统受到破坏,致使植物对CO2的固定减少,光合作用受到抑制,从而阻碍了可溶性糖的合成和正常运输,最终导致其含量下降。
作为有效的渗透调节物质,脯氨酸能通过保护膜和酶并清除自由基来维持逆境中植物的正常生长;当植物液泡中的钾离子浓度过高时,脯氨酸又能调节细胞质渗透平衡[60]。在土壤试验中,彭嘉桂等[61]发现,铝胁迫下大豆和玉米(Zeamays)叶片中脯氨酸的含量显著增加,植物叶片中游离脯氨酸含量的上升是适应逆境的表现。韦冬萍等[62]在油菜上以及李朝苏等[63]在荞麦(Fagopyrumesculentum)上也得到了证实。而胡雪华等[59]对车前的研究表明,在低浓度铝胁迫下车前脯氨酸没有显著变化,在中高浓度铝胁迫下脯氨酸含量先增加后减少。现阶段该方面的研究结果差异较大,所以铝胁迫与脯氨酸含量的关系还不是非常明确,仍需进一步探索研究(表5)。
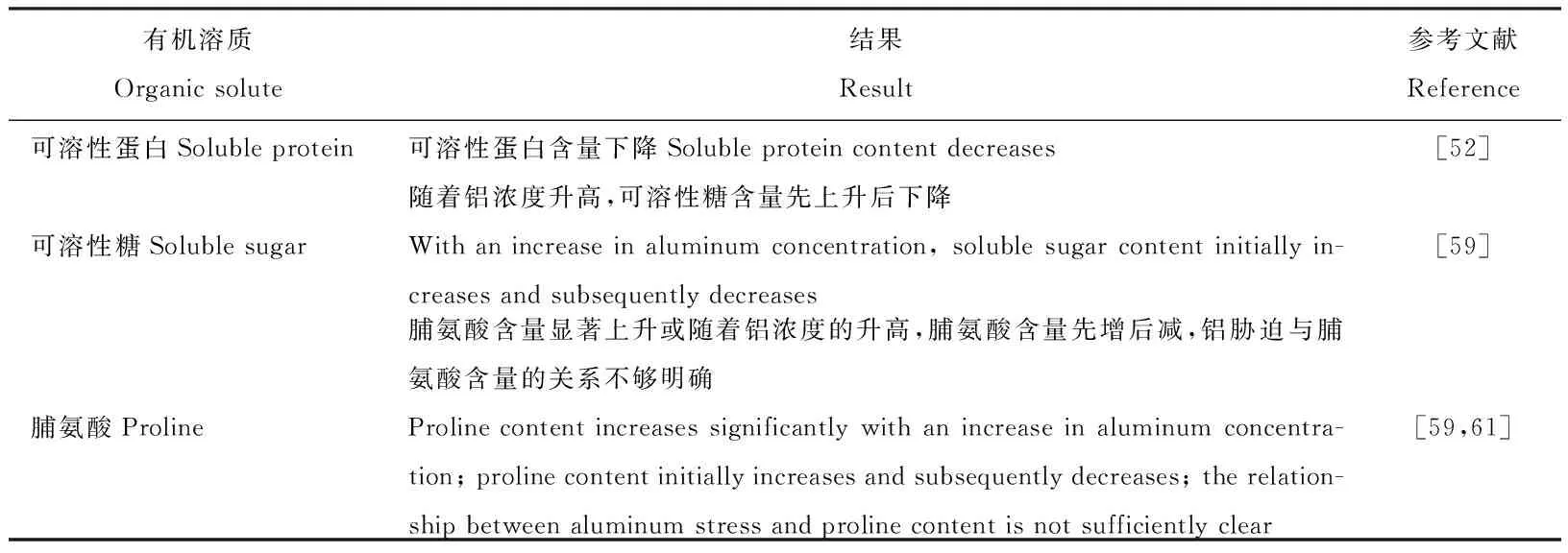
表5 铝胁迫对草本植物有机溶质的影响Table 5 Effect of aluminum stress on organic solutes in herbaceous plants
5 铝胁迫对草本植物根系活力和次生代谢物的影响
根系不仅是植物吸收水分和养分的器官,也是多种物质的同化、转化或合成的重要器官,它还是最先感受土壤逆境胁迫因子信号的器官[64]。
根系活力包括根系的吸收能力、合成能力和还原能力等。俞慧娜[65]研究表明,铝胁迫抑制了大豆的根系活力,随着铝浓度的升高,其根系活力先上升后下降。该结果与谢国生等[66]对水稻(Oryzasativa)的研究相同。李朝苏等[63]对荞麦的研究表明,铝胁迫对根系活力有抑制作用,并且铝浓度越高,抑制作用越强。可见,铝胁迫抑制草本植物根系生长,并导致其根系活力下降。
根系分泌物是植物根系向生长介质中溢泌或分泌的质子、离子和大量的有机物质,主要包括有机酸[67]、氨基酸、碳水化合物等。其中铝胁迫导致根系分泌大量有机酸,被认为是重要的植物耐铝机制之一。分泌出的有机酸与铝螯合,不仅缓解了铝对植物根系的毒害作用,还减少了根系对铝离子的吸收,Ma等[68]对荞麦的研究结果证实了该结论。之后,Ma[69]又将铝诱导根系有机酸分泌分成两种模式:模式Ⅰ中,铝胁迫下根系能迅速做出反应分泌有机酸,即铝处理与根系开始释放有机酸之间没有明显的延缓期;模式Ⅱ中,铝处理与根系开始分泌有机酸之间存在明显的滞后期。有机酸的分泌对铝具有高度的特异性,分泌位点定位于根尖,而铝对植物的毒害作用主要作用于根尖,所以有机酸在植物根系缓解铝毒过程中起重要作用。柠檬酸、苹果酸和琥珀酸都能与铝离子结合,其中柠檬酸与铝离子结合程度最高,并且有研究表明,通过表达植物或细菌来源的柠檬酸合成酶或苹果酸脱氢酶基因能够提高油菜、拟南芥(Arabidopsisthaliana)、烟草和紫花苜蓿(Medicagosativa)中有机酸的合成率[70]。
6 小结与展望
铝是酸性土壤上对植物产生毒害作用的主要因素。根系是与铝离子直接接触的部位,正常情况下,铝毒进入线粒体,抑制线粒体中酶的活性或细胞色素呼吸从而抑制植物呼吸作用,同时阻断细胞分裂机制,使得根系伸长以及根系活力受到抑制,而植物根系分泌出的有机酸与铝螯合,减少根系对铝离子吸收的同时还缓解了铝对植物根系的毒害作用。铝胁迫下叶绿素含量和气孔导度降低抑制了植物光合作用,从而阻碍了可溶性糖的合成与正常运输,并使植物地上部分生长受阻,但铝毒对地上部分的毒害一般滞后于根部。高浓度的铝胁迫使抗氧化酶活性下降,破坏活性氧产生与清除的平衡,使植物细胞中活性氧大量累积,导致细胞内蛋白质等生物大分子受到氧化损伤,抑制可溶性蛋白的合成,此外,铝胁迫促使抗性蛋白产生并加剧蛋白质分解致使可溶性蛋白含量下降,破坏渗透平衡,从而破坏植物细胞的吸水和保水能力。但铝胁迫与脯氨酸含量的关系还不是非常明确,还需后人进一步研究。
随着环境破坏的加深,酸性土壤已经成为我国农业发展的制约因素,植物应对铝胁迫的形势也越来越严峻,缓解酸铝胁迫对土壤和植物的毒害作用成为亟待解决的问题。目前,改良酸性土壤主要有两种方法,一是利用化学改良剂,除了传统的施用石灰改良外,人们又发现施加白云石、磷石膏、粉煤灰等矿物和工业副产物也能起到改良酸性土壤的效果[71]。另一种即是采取一定的生物措施来治理酸性土壤污染,例如,利用某些特定的动植物和微生物较快地吸走或降解土壤中的污染物质[72-73];利用植物自身分泌的有机酸来缓解铝毒也成为近几年研究的热点[74],与传统物理化学修复相比,生物措施不仅绿色环保,还对土壤环境扰动较小[75]。此外,鉴定并筛选出耐铝草本植物野生种质资源也能适当缓解铝毒带来的危害[76]。
