pH与氨氮对黄颡鱼幼鱼生长与肝脏超氧化物歧化酶的影响
2018-07-13崔平,强俊
崔 平,强 俊
(1.无锡职业技术学院,江苏无锡,214121;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏无锡 214081)


瓦氏黄颡鱼(Pelteobagrusvachelli)又名江黄颡,主要分布于长江及其支流中。分类上隶属于鲶形目黄颡鱼属,是该属中个体最大的一个种。该鱼肉质细嫩、味道鲜美、营养丰富、少肌间刺,是当前我国重要的水产养殖品种之一,产量逐年增加[10]。水环境中,pH与氨氮对水生生物的影响存在相互联系、相互制约的关系。然而,关于pH与氨氮对黄颡鱼幼鱼生长与肝脏抗氧化指标之间是否存在互作效应尚未见到相关报道。本研究在已有研究的基础上,选取pH与氨氮两个重要水环境影响因子,采用中心复合实验设计(central composite design,CCD)与响应曲面分析方法(response surface method,RSM)研究了不同pH与氨氮(ammonia nitrogen,AN)组合对瓦氏黄颡鱼生长、饲料系数与超氧化物歧化酶活性的影响。近年来,CCD和RSM逐渐开始应用于水产养殖实验,如罗非鱼(Oreochromisniloticus)的人工授精与孵化技术与养殖条件的优化等[11-13]。本研究不仅可以解析水体中不同pH与氨氮对黄颡鱼生长与生理的变化规律,还能为实际生产中优化其养殖条件,降低胁迫对其生长的抑制作用提供科学依据。
1 材料与方法
1.1 实验用鱼
瓦氏黄颡鱼选自中国水产科学研究院淡水渔业研究中心宜兴繁育基地。选择健康且活力良好的鱼。将实验用鱼放置在室内水泥池(水温(27±0.3) ℃,pH 7.4~0.2)中暂养10 d,增氧机持续增氧,自然光周期。暂养期间,每天投喂沉性饲料2次,饲料中主要包含粗蛋白质38%,粗脂肪5%,粗纤维12%,粗灰分15%,水分12%,总磷1%,钙1%。
1.2 实验设计与分组
正式实验前,通过查阅文献与预实验,确定能够抑制黄颡鱼生长的氨氮浓度[14]。正式实验采用CCD设计,响应值分别为特定生长率(specific growth rate,SGR),饲料效率(feed efficiency,FE)与肝脏超氧化物歧化酶活力(superoxide dismutase,SOD)。设计两个实验因子:pH(5~10)和氨氮(0.1~6.5 mg/L),分别用pH和AN字母表示。分为2因素5水平,计算机编码分别为-a,-1,0,1,a(表1),共计13个实验组。中心组合(计算机编码:0和0)重复5次,每次实验组合各设置3组平行。pH和AN的组合如表1所示。
1.3 实验管理
实验在39个塑料桶(0.8 m3)内进行。每个塑料桶加入曝气3 d的自来水0.6 m3。通过HCl 或 NaOH 调节水体pH值,采用德国WTW photoFlex测定水体pH值。利用电子恒温棒(量程为20~34 ℃)将水温控制在(27.5±0.5) ℃。同时,配制1 g/L的氯化氨母液,按照表1中的实验组合,配制相应的实验浓度,使用奈氏试剂法测定与调整养殖水体的氨氮浓度。每个实验组合中共放置75尾实验鱼(10.22±0.16) g,每个桶中各25尾。每天8∶00与17∶00各投喂1次,饲喂量为体重的1%~3%,实验周期为7周。在整个实验过程中,每3 d换水1/3,每隔6 h测定水中pH与氨氮浓度1次,及时调整浓度使其符合实验要求。养殖期间通过增氧机连续增氧,自然光周期。同时,我们利用虹吸法每天清除桶底的残饵与粪便。

表1 pH与氨氮浓度的试验设计与结果Tab.1 Experimental design and results of pH and concentrations of ammonia nitrogen (mean±SD)
注:(1) a =1.414 21为星号臂值,中心点重复5次;(2)表中pH和AN分别为pH值与氨氮浓度。
1.4 取样与分析
禁食24 h后,分别从每个养殖桶中随机选取8尾鱼称重。SGR与FE的计算方法如下:
SGR=100%×[Ln(终末体重)-Ln(初始体重)]/养殖周期
FE=总摄食量/(终末体重-初始体重)
另外每个实验桶随机选取3尾鱼(3组平行共计9尾实验鱼),利用MS-222(200 mg/L)深度麻醉1分钟后,解剖取其肝脏,放入-80 ℃冰箱中用于下一步的SOD活性检测。肝脏SOD活性的测定采用南京建成生物工程研究所生产的试剂盒,按照试剂盒中的说明进行操作。
1.5 数据分析
数据用平均值±标准差表示。基于响应面分析方法,使用最小二乘法拟合因子与响应值之间的二次多项式回归方程:

2 结果
2.1 pH与AN对黄颡鱼SGR的影响
pH与AN对黄颡鱼SGR的影响见表1所示。通过最小二乘法进行回归数据的拟合。模型拟合有效(P=0.081 6>0.05)。pH与AN的线性和二次效应对SGR具有显着影响(P<0.05)。pH×AN的互作效应对SGR无显著影响。pH与AN对SGR的实际二次多项式回归方程为:
SGR=-8.654+2.688 3pH+0.085 8AN+0.006 9pH×AN-0.180 3pH2-0.039 7AN2(R2=0.94;校正R2=0.89)
SGR的响应面见图1所示。通过动态曲面图,可以评估实验因子对黄颡鱼生长的互作效应。水体AN为0.1~6.5 mg/L时,幼鱼的SGR随pH值的上升呈先上升后下降的变化趋势。当pH为5~10时,幼鱼的SGR在AN浓度为0.1~1.7 mg/L时无显著差异;然而,AN浓度高于1.7 mg/L时,SGR显著下降。pH和AN对SGR无互作效应(P>0.05)。

图1 pH、氨氮浓度及其互作效应对黄颡鱼幼鱼特定生长率影响的等高线(A)和响应曲面(B)Fig.1 Contour plot (A) and its response surface plot (B) for the effects of pH and AN on specific growth rate of juvenile
2.2 pH与AN对黄颡鱼FE的影响
采用ANONA分析表1中FE实验结果,拟合模型的P值为0.001(P<0.05),缺适性检验的P值为0.126 3(P>0.05),表明FE拟合模型非常适合。pH的线性效应、AN的二次效应与pH和AN的互作效应对FE没有显著性影响。然而,AN的线性效应和pH的二次效应对FE有显著影响。pH与AN对FE的实际二次多项式回归方程为:
FE=-1.927 3+1.041 9pH-0.058 9AN+0.011 3pH×AN-0.071pH2-0.011 1AN2(R2=0.92;校正R2=0.83)
FE的曲线模型如图2所示。pH为5~7.5时,幼鱼的FE随着水体AN浓度的升高(0.1~6.5 mg/L)呈显著下降趋势。pH高于7.5,AN在0.1~2 mg/L时,FE无显著差异;然而,AN高于2 mg/L时,FE显著下降。水体AN为0.1~6.5 mg/L时,FE在pH为7.5时拥有最高FE,升高或降低pH均会引起FE的下降。利用RSM对FE进行优化,当pH和AN的组合为7.2和1.0 mg/L时,FE值最高(1.71),可信度为0.883。
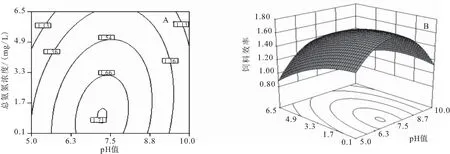
图2 pH、氨氮浓度及其互作效应对黄颡鱼幼鱼饲料效率影响的等高线(A)和响应曲面(B)Fig.2 Contour plot (A) and its response surface plot (B) for the effects of pH and AN on feed efficiency of juvenile
2.3 pH与AN对黄颡鱼肝脏SOD活力的影响
SOD活力的测量结果见表1。方差分析显示,SOD拟合模型方程有显著差异(P=0.004 1<0.05),模型的缺适性检验>0.05(P=0.089 3)。AN的线性效应与pH的二次效应对SOD有显著影响(P<0.05)。pH的一次效应、AN的二次效应与pH×AN的交互效应对SOD无显着差异。pH与AN对SOD的实际二次多项式回归方程为:
SOD=-45.600 1+37.848 3pH-1.487 7AN-0.216 3pH×AN-2.437 6pH2+0.029 8AN2(R2=0.88;校正R2=0.79)
由图3可以看出,水体pH为5~10时,黄颡鱼肝脏SOD活力随着AN的上升(0.1~6.5 mg/L)呈显著的下降趋势。当水体氨氮为0.1~2 mg/L,SOD随着pH上升(5~8)而增加;pH高于8时,SOD活力显著下降。高TAH环境下,低pH或高pH对黄颡鱼肝脏SOD活力有明显的抑制作用。

图3 pH、氨氮浓度及其互作效应对黄颡鱼幼鱼肝脏超氧化物歧化酶活力影响的等高线(A)和响应曲面(B)Fig.3 Contour plot (A) and its response surface plot (B) for the effects of pH and AN on the activity of superoxide dismutase in juvenile
2.4 黄颡鱼SGR、FE与肝脏SOD模型的优化
根据Montgomery[15]的方法,对不同pH与AN下的黄颡鱼SGR、FE与肝脏SOD模型进行共同优化。pH与AN分别为7.5与1 mg/L时,黄颡鱼的SGR、FE与肝脏SOD活力同时达到最高值,分别为1.47%/d,1.71和97.9 U/mg.prot,优化的可信度为0.836。
3 讨论

已有研究显示,水体中高氨胁迫下会明显抑制乌鳢(Anarhichasminor)[18]、虹鳟(Scophthalmusmaximus)[19]、罗非鱼[13]和大西洋比目鱼(Hippoglossushippoglossus)[20]的生长。本研究中,当AN为0~2 mg/L时,黄颡鱼的生长与饲料利用率无显著抑制作用;然而,高AN浓度对黄颡鱼的生长与FE有明显的抑制作用。然而,Li等[21]利用3 g左右的黄颡鱼(P.fulvidraco)实验发现水体中高AN(5.7 mg/L)和低AN (0.01 mg/L)胁迫下时,黄颡鱼的生长和存活率相比无显著差异。鱼体对AN胁迫的耐受力可能与其规格、品系与胁迫时间有关。本研究发现AN对SGR存在显著的二次效应。pH=7.5,水体AN在1.7 mg/L时可以获得黄颡鱼最大SGR(1.49 %/d),其可靠性为0.898。
环境胁迫下易引起鱼体氧化应激,增加组织的氧化损伤,主要涉及肝脏与脑神经元中的N-甲基-D-天冬氨酸酯型谷氨酸受体的过度活化[22],导致一系列活性氧簇(reactive oxygen species,ROS)过度产生,引起蛋白质的破坏[23]。在正常情况下,鱼体可以通过自身的抗氧化防御体系,如提高SOD,过氧化氢酶与谷胱甘肽过氧化物酶的活力来降低ROS对机体的损伤。本研究中,高AN与高pH或低pH环境对黄颡鱼肝脏SOD活力有明显的抑制作用,可能因为较强的应激胁迫使鱼体的肝脏功能发生紊乱,降低了抗氧化防御能力,增加了氧化损伤,进而抑制了黄颡鱼的生长。同时,pH的二次效应对SOD活力有显著影响,当水体AN为1 mg/L,肝脏SOD活力在pH为7.7时最高,为98.07 U/mg·prot,其可靠性为0.871。
