深圳湾和大鹏湾微生物群落结构及其功能预测比较分析
2018-07-11路璐
路 璐
(西华师范大学环境科学与工程学院,四川 南充 637009)
0 引言
微生物遗传多样性及其功能多样性是当今微生物生态学研究的热点和难点。海洋环境中的微生物多样性极其丰富,每升海水中有超过200万种微生物类群[1],它们通过参与碳氮硫等生命元素的生物地球化学转化过程、污染物的降解和转化等过程,在维持海洋生态环境的稳定和平衡中发挥着重要作用[2]。然而,微生物群落的结构极易受到水体理化性质和生物指标的影响,因此其可以作为评估环境质量的指标之一[3]。尤其在近岸海域中,海水环境常常受到陆地冲刷物、陆地污染排放物的影响,不同的近岸海域中由于受到各异的污染源影响,微生物的群落结构也发生了显著的变化[4-5]。在以往的研究中,大多数通过探究近岸水体的理化性质的空间分布规律,如重金属[6]、有机污染物[7]、和营养盐[8]等,来评估近岸海洋环境质量。而相比如淡水环境水体,近岸海水中微生物群落结构及其多样性的分布信息却知之甚少[9]。
传统的海洋微生物多样性研究方法,如实验室富集分离的培养方法,对微生物生理生态功能的认识提供了便利,然而,环境中绝大多数菌群是难培养或难分离微生物,截至2003年,全球范围内仅分离培养出4 800种细菌[10]。在纯培养体系中,组学技术可在基因组、转录组和蛋白组水平清楚阐释单一微生物菌株的重要生理过程。然而,特定微生物的生理代谢功能是与其它生物及自然环境长期相互作用的结果[11]。与纯培养体系相比,自然环境中微生物具有极其丰富的多样性,在整体水平上清楚认知复杂环境中微生物群落生理代谢过程的分子机制具有较大难度。因此,人们对环境中微生物的种类及其功能的认识还是十分有限。而近些年,以非培养为基础的分子生物学技术手段,如核酸分子限制性片段长度多态性(restricted fragment length polymorphisms,RFLP)、变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis,DGGE),高通量测序等的迅速发展,我们已经能够在群落水平探知微生物的多样性及其生理代谢功能,同时也发现了在传统的研究技术手段下以往无法发现的微生物种类及功能[12]。其中,Illumina Miseq测序技术以其高通量、快速、准确度高等优势成为获取环境微生物多样性信息的主要途径。16S rRNA基因在不同微生物种群中具有保守性,对环境样品中16S rRNA基因的高通量测序是探究海洋微生物群落结构多样性的有力工具。
本文的研究对象为采自于深圳湾和大鹏湾的近岸海水,尤其是深圳湾,靠近深圳市区,人口密集,受陆地环境压力影响较大。由于各类经济活动所带来的各类排海污染物、地表径流和降雨等进入深圳湾和大鹏湾,会持续对两个区域造成影响,从而可能在这两个海域形成不同海水生态环境,进而影响海水的微生物群落结构和生态功能。本研究采用Illumina Miseq测序平台,综合比较分析了深圳湾和大鹏湾近岸表层海水微生物多样性差异,并预测其微生物生态功能差异。该研究成果对该两处海域生态系统的保护修复和微生物资源开发利用提供基础数据和理论依据。
1 材料与方法
1.1 采样点描述
样品于2017年5月在大鹏湾和深圳湾采集,如封二图1所示,分别在离岸约200 m进行表层海水的采集。为避免表层漂浮物质的影响,用水样采样器采集深度在0.5~1 m的表层水,每个采样点分别在3个点(5 m×5 m)随机采集水体,混匀,共采集10 L水体,置于灭菌的玻璃采集瓶中。取其中的1 L水采用EMD MilliporeTmSterivex Sterile Pressure-Driven设备,原位进行过滤,将微生物过滤至0.22 μm孔径的滤膜上。滤膜置于干冰盒中冷藏保存,用于后续DNA提取。剩余的海水置于冷藏盒(4℃)中,10 h内运回实验室以备后续化学分析。
1.2 样品理化性质分析
表层水的溶解氧、pH和温度由原位YSI在线多参数水质分析仪(YSI 6600 multiparameter probe,USA)测定。水体的溶解性有机碳(dissolved organiccarbon,DOC)采用TOC分析仪(Elementar-TOC&WaterAnalysis,Germany)测定。每个样品指标设置3个重复测定。
1.3 水体DNA提取
对原位采样时过滤微生物细胞所得的滤膜,进行无菌环境下剪切为碎片,对滤膜采用FastDNA®Spin Kit for Soil(MP Biomedicals company),按照试剂盒说明进行样品DNA提取。提取的DNA分别用凝胶电仪成像和NanoDrop浓度测定(NanoDrop Technologies,Wilmington,Germany)等两种方法评估DNA提取质量。
1.4 Illumina Miseq测序及序列分析
对大鹏湾和深圳湾的海水总DNA,进行基于16S rRNA的Illumina Miseq测定,引物选用515/907扩增16S rRNA基因的V4~V5区段[13]。测序样品采 用 QIIME(Quantitative Insights Into Microbial Ecology,v1.8.0)进行分析。使用UCLUST序列比对工具,对获得的序列按97%的序列相似度进行归并和OUT划分,获得每个OUT所对应的分类学信息。并使用QIIME软件计算Alpha多样性指数。用R软件绘制对丰度前50位的属进行聚类分析并绘制热图。菌群代谢功能预测采用PICRUSt通过将现有的16S rRNA基因测序数据与代谢功能已知的微生物参考基因组数据库相对比,从而实现对细菌和古菌微生物群落代谢功能的预测[14]。
2 结果与分析
2.1 海水理化性质及Miseq测序结果和多样性比较分析
深圳湾较之大鹏湾,距离城区更近,可能受城市污水排放和海上桥梁建设等带来的人为污染更多。而大鹏湾远离城区,因此,两者的水体理化性质和群落结构,可能会有差异。Stewart等也同样提出,岸上的环境对近岸水体微生物群落有直接的影响,如通过水土流失,陆地源微生物进入水体,甚至有些致病菌对水体的污染可能对人类产生潜在的健康威胁[15]。如表1中所示,基于16S rRNA的Miseq测序共获得了105 214条序列。序列稀释曲线表明大鹏湾海水的微生物群落多样性高于深圳湾(封二图2a),且大鹏湾的微生物多样性指数(Shannon和 Simpson)和丰富度指数(Chao 1和ACE)也都高于深圳湾。在序列相似度为97%下分析表明,在门分类水平上大鹏湾和深圳湾分别有678个和345个OTUs,大鹏湾的OTUs明显比大鹏湾高出49.1%,且仅有99个OTUs相同(封二图2b),说明两个海域的水体中微生物种群有显著差异。Feng等对长江入海口的海水中研究也发现,距离入海口距离不同的位置,微生物多样性也有所差异[16]。
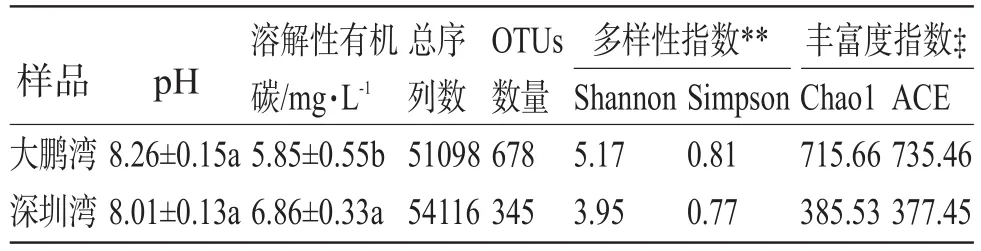
表1 海水理化性质及其Miseq测序结果
2.2 海水微生物群落结构比较分析
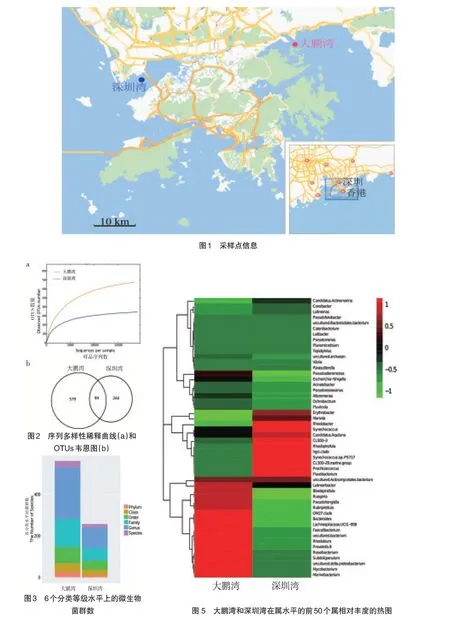
通过对测序数据的分析,分别在门、纲、目、科、属5个分类等级水平上对大鹏湾和深圳湾微生物群落结构做柱状图以比较其差异(封二图3和封三图4)。在门水平发现,大鹏湾和深圳湾的微生物群落结构可以分别分23和10个门(封二图3)。大鹏湾海水中的主导菌群为蓝藻细菌(Cyanobacteria)51.6%、变形菌门(Proteobacteria)20.1%、拟杆菌门(Bacteroidetes)10.0%、放线菌门(Actinobacteria)9.3%、厚壁菌门(Firmicutes)5.4%、浮霉菌门(Planctomycetes)2.9%,而相应的菌门在深圳湾中分别占64.6%、7.3%、9.9%、14.2%、0.1%、3.9%,且这五类菌群分别占大鹏湾和深圳湾微生物类群的99.3%和99.9%。这一群落结构组成与Yang在厦门海的研究以变形菌门(91%)为主的微生物类群差异较大[17]。蓝藻细菌的相对丰度在深圳湾高于大鹏湾。而深圳湾和大鹏湾水体微生物群落结构中较高丰度蓝藻细菌的存在,说明和近岸水域的富营养化所导致的蓝藻爆发有直接关系[18]。
如封三图4b,在纲水平发现,大鹏湾中的α-变形菌纲(Alphaproteobacteria)(8.3%)与γ-变形菌纲(Gammaproteobacteria)(7.2%)比例为1.1∶1,而在深圳湾中,α-变形菌纲(5.8%)是γ-变形菌纲(1.1%)的5.3倍。
如封二图3和封三图4c,能分类到目水平的微生物类群在大鹏湾和深圳湾中分别为79和45个,深圳湾中,分类到目水平的主要菌群为蓝藻细菌(Cyanobacteria subsectionl),占总菌群的62.6%。
在科水平(封三图4d),大鹏湾和深圳湾的物种丰度分别为136和60(封二图3)。其中,红杆菌科(Rhodobacteraceae)在大鹏湾和深圳湾中丰度分别为5.6%和7.3%,红杆菌科是海水中常见的菌科,在渤海湾[19]、厦门海[20]和南太平洋环流区7个站点的深海沉积物和底层海水样品中都有广泛分布[21]。且在深圳湾中的黄杆菌科(Flavobacteriaceae)(6.9%)和酸微菌科(Acidimicrobiaceae)(7.0%)的相对丰度比大鹏湾中相应的菌群高5.8和2.3倍,其中,黄杆菌科的菌群中很多有能降解有机物的功能,如异戊二烯降解[22]、烷烃降解[23]和多环芳烃降解[24]等。其在深圳的富集可能由于该海水中受有机物的污染较之大鹏湾严重。
为了进一步探究大鹏湾和深圳湾在属水平微生物群落结构的差别,封三图5所示更直观地显示了两个海域中不同菌群丰度的差异。在深圳湾中主导菌属为隶属于蓝藻菌门的原绿球藻(Prochlorococcus),在总微生物群落的比例为60.0%。原绿球藻作为海洋生态环境的最初生产力,主要分布在北纬40°至南纬40°的开阔海域中,在表层海水至150 m深度的深层海水中都有分布,且在光照和营养丰富的区域中丰度较高[25]。且研究表明原绿球藻在水温低于15℃时就难以生存[26]。深圳湾中原绿球藻较高的丰度可能由于该研究采样时间在夏天,表层海水温度在30℃,且深圳湾海水较之大鹏湾,水体营养程度更高[27],更促使原绿球藻富集。大鹏湾中的主导菌属为隶属于蓝藻菌门的未分类菌株(uncultured bacterium),只能分类到纲水平(Chloroplast)。该菌纲在很多海域中也有大量富集,均能在其基因组中检测到叶绿素基因,为化能自养菌,且该菌属中分离出的纯菌株很多与氮固定相关[28]。
2.3 PICRUSt代谢功能预测
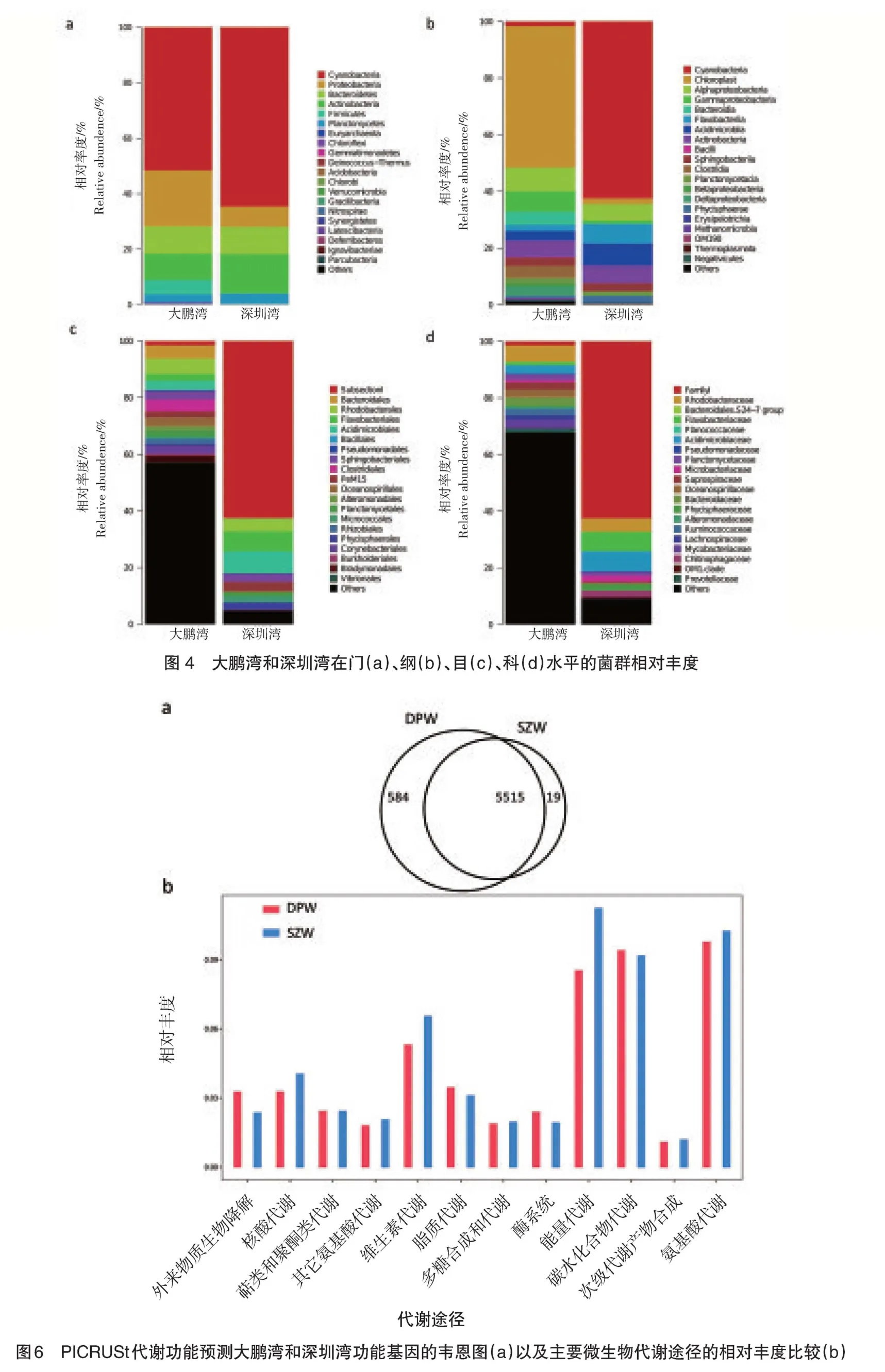
PICRUSt是通过微生物群落的16S rRNA基因序列与功能数据库对比,从而推测出微生物群落的功能信息。其中,KEGG数据库的核心为生物代谢通路分析数据库,KEGG图能实现对菌群代谢功能的预测。如封三图6a所示,韦恩图可以看得出,大鹏湾和深圳湾分别有6 099和5 534个预测的功能类群,其各特有的功能类群分别为548和19个,表明2种海洋水体的生态功能已有差异。如封三图6b所示,大鹏湾在生物降解功能、脂质代谢、酶系统和碳水化合物代谢等四个方面的功能基因都高于深圳湾,说明两个海域所接受的环境污染都不同,也导致其生态功能的差异。该规律在淡水环境中也有发现,当在不同的污染水平下,微生物群落的生态功能,如降解多环芳烃、降解农药污染物、以及抗性基因等功能的丰度都有显著差异[29]。
3 结论
本实验通过基于16S rRNA基因的Illumina Miseq高通量测序,研究表明深圳大鹏湾和深圳湾表层海水中微生物多样性显著差异,其微生物多样性及其群落结构的改变会直接影响水体的功能,可能具体会体现在物质转化、自净功能的改变等方面。
1)大鹏湾的微生物多样性和丰富度指数Shannon、Simpson、Chao1、ACE都明显高于深圳湾的微生物多样性和丰富度。
2)大鹏湾和深圳湾的微生物群落分别可分类为24和10个门,主导菌门都为蓝藻细菌门、变形菌门、拟杆菌门、放线菌门、厚壁菌门、浮霉菌门,分别占其总微生物群落的99.3%和99.9%,但各菌门的相对丰度有所差异。
3)大鹏湾和深圳湾在纲、目、科、属等水平的分类结果表明,2个海水水体的菌群结构都有差异。在属水平分析表明,隶属于蓝藻细菌门的原绿球藻(60.0%)属主导了深圳湾海洋水体,而大鹏湾的主导蓝藻菌属为未被分离出纯菌株的菌群。未来设计实验需进一步采用宏基因组等手段对其分类水平和功能进行鉴定。
4)PICRUSt代谢功能预测初步揭示了大鹏湾和深圳湾水体生态功能的差异,为未来从微生物角度进行生态环境评估和治理提供新思路和基础数据。
