糖化终末产物对人结肠癌HCT116细胞中ChREBP表达的影响
2018-07-11陈寒蓓
陈寒蓓, 林 宁, 苏 青
(上海交通大学医学院附属新华医院内分泌科,上海 200092)
蛋白质、脂类或核酸等大分子物质的游离氨基与还原糖的羰基在非酶促条件下,经过缩合、重排、裂解、氧化后产生的一组稳定终末产物,称为糖化终末产物(advanced glycation end products, AGEs)。随着年龄增加,体内的AGEs水平会缓慢增加。在糖尿病患者体内,由于高血糖加速了AGEs的产生,使其大量蓄积[1-2]。AGEs可直接通过交联影响蛋白质功能[3],而且还可以与细胞膜上特定的受体相结合,继而影响靶细胞的功能。AGEs与糖尿病慢性并发症、动脉粥样硬化、衰老等发生发展密切相关[4]。近年来,研究[5]认为,AGEs与肿瘤的形成相关。Tong等[6]发现,ChREBP在调节结肠癌细胞代谢和抑制p53的活性中发挥了重要的作用,其对于结肠癌细胞的高效率增殖起到了非常关键性的作用。前期工作[7]亦显示,AGEs可诱导HCT116细胞发生氧化应激。本研究探讨AGEs作用下人结肠癌HCT116细胞内是否通过氧化应激影响碳水化合物反应元件结合蛋白(carbohydrate responsive element binding protein, ChREBP)表达的变化,进一步研究糖尿病易于罹患肿瘤的发病机制。
1 材料与方法
1.1 实验材料
人结肠癌HCT116细胞株购自美国ATCC公司;高糖和无糖DMEM培养基、胰蛋白酶和胎牛血清均购自德国Biochrom公司;反转录试剂盒(PrimeScriptTMRT reagent Kit)、RT-PCR试剂盒(SYBR Premix Ex TaqTM)购自日本TaKaRa公司;小鼠源Tubulin单克隆抗体N-乙酰半胱氨酸(NAC)、MTS试剂盒购自美国Sigma公司;兔源ChREBP多克隆抗体购自美国Novus公司;辣根过氧化物酶(HRP)标记山羊抗兔抗体、标记山羊抗鼠抗体购自中国碧云天公司。
SMART CELL CO2培养箱购自美国Thermo公司;化学发光成像仪(Las 4000 mini)购自美国GE公司;荧光定量PCR仪(AB 7500 fast)购自美国ABI公司;蛋白电泳仪购自中国天能公司;全波长酶联免疫检测仪购自美国BioTek公司。
1.2 HCT116细胞培养
人结肠癌细胞HCT116按5×106/孔的密度接种于10cm培养皿中,使用含有2mmol/L谷氨酰胺、10%热失活的FBS、100U/mL青霉素、100μg/mL链霉素的高糖(25mmol/L葡萄糖)DMEM培养基,在37℃、5% CO2条件下培养,隔天传代1次。
1.3 AGEs的制备和鉴定
0.5g BSA溶解于10mL 0.2mol/L PBS中,加入D-葡萄糖0.9g,0.22m滤膜以抽滤除菌,37℃避光孵育120d。剪取长度约为15cm的透析袋,该透析袋的截留相对分子质量为8000~14000;称取8.00g NaHCO3、0.149g EDTA溶解于Milli-Q H2O中,测定其pH值为8.36;将透析袋置于上述配制溶液中煮沸10min,再将该透析袋置于Milli-Q H2O中煮沸5min,并用Milli-Q H2O充分冲洗透析袋。透析袋一头用手术缝线扎紧后,将AGEs置于透析袋中,另一头同样扎紧后置于PBS中避光透析,4h后PBS换液1次,继续透析过夜,24h后PBS换液,直至AGEs充分透析48h,以除去未结合的葡萄糖。以相同的方法去除D-葡萄糖以制备非糖化BSA作为对照。
AGEs的鉴定: 运用荧光光谱扫描鉴定,荧光光谱扫描显示BSA-AGEs的激发高峰位于360nm,发射高峰位于446nm。
1.4 提取细胞总mRNA和RT-PCR
HCT116细胞按1×106/孔接种于六孔板中,培养24h,使细胞同步化。换葡萄糖浓度为0mmol/L的DMEM培养基培养,同时实验组每孔加入200mg/L AGEs,对照组每孔加入200mg/L BSA,置37℃、含5% CO2恒温培养箱孵育细胞24h。
采用TRIzol试剂,提取细胞总mRNA,测定A260和A280检测RNA的质量和浓度。按反转录的试剂盒要求反转录合成cDNA。根据Gene Bank中目的基因mRNA序列,用Premier 5.0设计针对人ChREBP-α、ChREBP-β、总ChREBP、ACC、TXNIP、SCD1、Pepck、G6Pase、PPARα和INHBE及管家基因β-Actin cDNA的特异性引物,由生工生物工程(上海)股份有限公司合成。引物应满足以下要求: 在模板cDNA的保守区内;引物长度为18~35bp;退火温度控制在58~60℃;尽可能避免在3′端最后1个碱基为A;G-C含量控制在40%~60%;引物二聚体连续配对不超过3个,引物序列见表1。

表1 基因引物序列
PCR反应体系: 10μL反应体系,SYBR green Mix 5μL,10μmol/L上下游引物各0.2μL,cDNA 模板1μL,ROX Ⅱ 0.2μL,灭菌ddH2O 3.4μL。反应条件为: 95℃ 30s(预变性),95℃ 3s(变性),64℃ 30s(退火),60℃ 1min(延升),变性、退火、延伸共30个循环。扩增产物以β-actin作为内参比较相对定量。
1.5 Western印迹法检测
HCT116细胞按1×106/孔接种于六孔板中培养24h,使细胞同步化。换葡萄糖浓度为0mmol/L或25mmol/L的DMEM培养基培养,同时实验组每孔加入200mg/L AGEs,对照组每孔加入200mg/L BSA,在部分实验组中,在加入AGEs处理前先用NAC(100μmol/L)预培养30min。置37℃、5% CO2恒温培养箱孵育细胞24h。
提取处理过的HCT116细胞中的蛋白质,用BCA法进行蛋白定量,将定量后的蛋白样品在100℃变性5min,迅速置于冰上。蛋白上样后用SDS-PAGE电泳,电泳结束后马上进行转PVDF膜,根据膜上的蛋白标记条带来确定转膜是否成功,然后将剪去标记条带的膜用TBST洗涤1次后,放入封闭液中,在25℃摇床中轻摇2h。将上述PVDF膜置于含有适当浓度一抗液中,4℃轻摇过夜。将与辣根过氧化物酶耦联的二抗按1∶2000比例稀释,再将上述漂洗过的膜置于其中并室温平缓摇动2h。用TBST液室温漂洗3次,每次5min。用ECL化学发光剂显色,Bio-Rad凝胶成像仪检测分析结果。根据荧光的能见度,选取合适的曝光时间;保存图片,采用Image J软件进行灰度分析。
1.6 MTS比色法检测细胞增殖
将5×104/mL HCT116细胞悬液接种于96孔培养板内,培养24h使细胞同步化。换葡萄糖浓度为0mmol/L的DMEM培养基培养,实验组每孔加入200mg/L AGEs,对照组每孔加入200mg/L BSA,在部分实验组中,在加入AGEs处理前先用NAC(100μmol/L)预培养30min。置37℃、含5% CO2恒温培养箱孵育细胞24h。在96孔板中,每孔100μL培养基加20μl CellTiter 96®AQueous One Solution Reagent。在37℃、5% CO2的环境下孵育2h后,于490nm读取吸光度值(A490)。
1.7 统计学处理
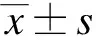
2 结 果
2.1 AGEs刺激对ChREBP转录的影响
RT-PCR结果显示,AGEs刺激后,在葡萄糖浓度为0mmol/L的DMEM培养条件下,HCT116细胞的ChREBP-β和总ChREBP mRNA水平都有增加,分别为2.5(P<0.05)和1.3倍(P>0.05),见图1。
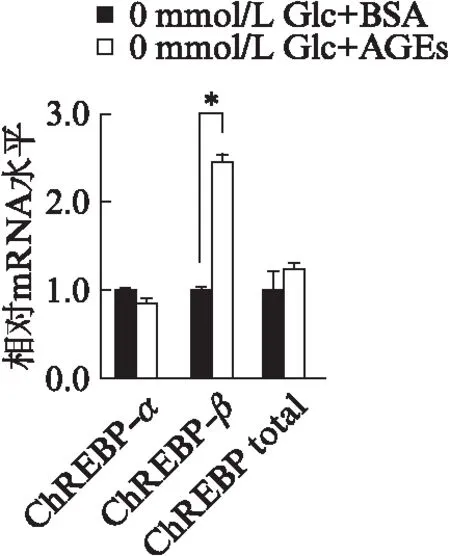
图1 RT-PCR检测AGEs刺激对HCT116细胞ChREBP mRNA转录的影响Fig.1 Effects of AGEs on ChREBP mRNA expression in HCT116 cells by RT-PCR与BSA组比较,*P<0.05
2.2 RT-AGEs刺激对ChREBP下游基因表达的影响
RT-PCR结果显示,AGEs刺激后,在葡萄糖浓度为0mmol/L的DMEM培养条件下,HCT116细胞的ACC、TXNIP和SCD1的mRNA水平都有增加,分别为1.7、3.8和1.8倍(P<0.05),而Pepck、G6Pase、PPARα和INHBE的mRNA水平都有降低,分别降至17.3%、23.5%、24.2%、26.0%(均P<0.01),见图2。
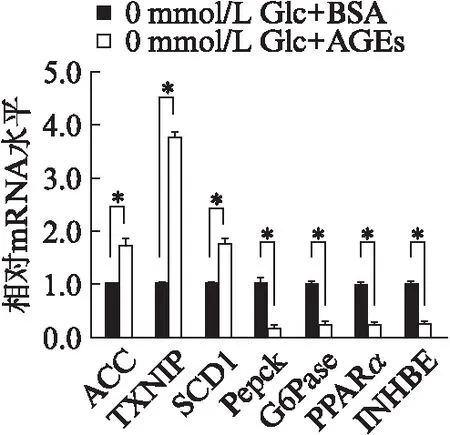
图2 RT-PCR检测AGEs刺激对HCT116细胞ChREBP下游基因转录的影响Fig.2 Effects of AGEs on target genes transcription of ChREBP in HCT116 cells by RT-PCR与BSA组比较,*P<0.05
2.3 AGEs诱导氧化应激对HCT116细胞中ChREBP表达的影响
Western印迹法结果显示,在葡萄糖浓度为0mmol/L的DMEM培养条件下,AGEs能促进ChREBP蛋白表达增加,但在AGEs加入前先用NAC孵育的细胞中,NAC能够明显降低AGEs诱导的ChREBP表达。同样,葡萄糖浓度为25mmol/L的DMEM培养条件下,ChREBP表达明显增加,然而此时AGEs不能进一步促进ChREBP表达增加,但在AGEs加入前先用NAC孵育的细胞中,NAC仍能够降低细胞的ChREBP表达,见图3。
图3 AGEs诱导ROS对HCT116细胞ChREBP表达的影响Fig.3 Effects of ROS on ChREBP expression in AGEs-induced HCT116 cells
2.4 AGEs诱导氧化应激对HCT116细胞增殖的影响
MTS结果显示,在葡萄糖浓度为0mmol/L的DMEM培养条件下,AGEs能促进HCT116细胞增殖,但在AGEs加入前先用NAC孵育的细胞中,NAC能够明显抑制AGEs诱导的细胞增殖(P<0.05),见图4。
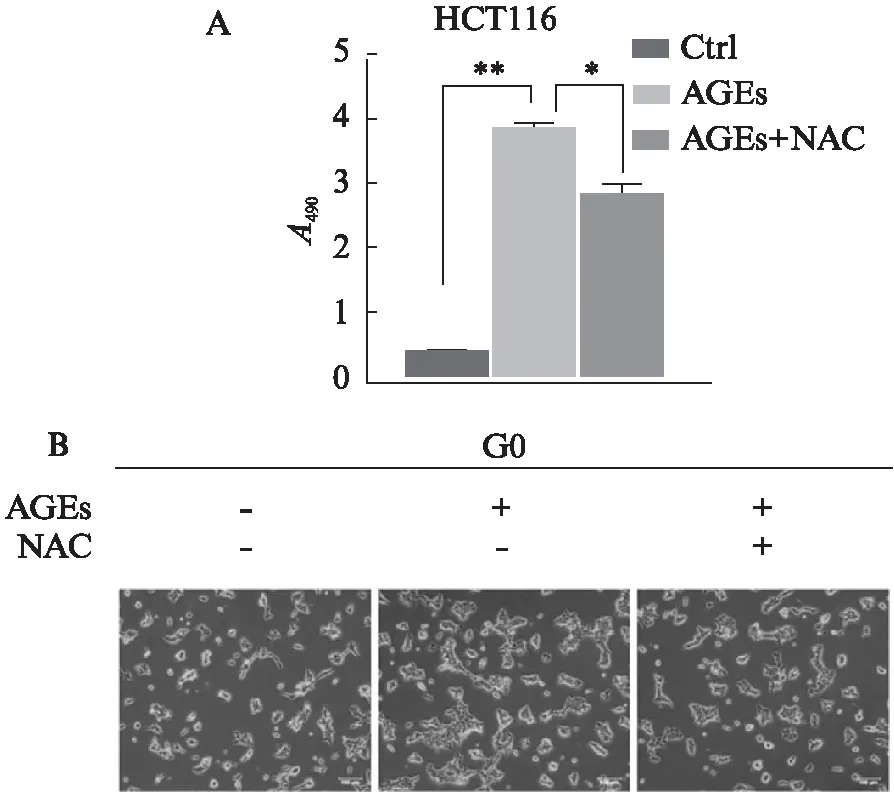
图4 ROS对AGEs诱导HCT116细胞增殖的影响Fig.4 Effects of ROS on AGEs-induced HCT116 cells proliferation与AGEs组比较,*P<0.05;与对照组比较,**P<0.05
3 讨 论
近年来,随着人类生活水平的提高以及生活方式的改变,2型糖尿病的患病率逐年攀升,2型糖尿病已成为公共卫生问题。2013年,中国成年人糖尿病患病率为11.6%,而糖尿病前期的患病率为50.1%[8]。早在1960年,流行病学研究已提示糖尿病和肿瘤发生之间可能存在一定的相关性。糖尿病患者容易罹患的肿瘤包括直结肠癌、肝癌、胰腺癌、乳腺癌和胆囊癌等[9-13]。
1912年,法国科学家Maillard首次发现还原糖的羰基与含氨基的蛋白质或脂质,通过非酶促糖化作用形成不稳定的Schiff碱,并经过分子重排形成酮氨类化合物(Amadori products),再经过脱水形成不可逆的AGEs[14]。AGEs与衰老及糖尿病慢性并发症(尤其是微血管并发症)密切相关。有研究[15]认为,AGEs还与肿瘤的形成相关。本研究前期工作[16]显示,无论是用MTS比色法,还是细胞计数绘制细胞生长曲线的方法,AGEs刺激组与对照组相比较,可促进HCT116细胞的增殖。
2001年,Yamashita等[17]发现了一种与碳水化合物反应元件相结合的蛋白质,命名为ChREBP。ChREBP在哺乳动物的肝脏、脂肪及小肠等组织中均有较高的表达[18]。ChREBP作为转录因子直接激活多个参与糖酵解和脂肪合成基因的表达,对于调控体内糖、脂肪代谢具有十分重要的作用。2012年,Herman等[19]发现了一种ChREBP的新型异构体,称为ChREBP-β。葡萄糖刺激ChREBP表达时首先诱导ChREBP-α的转录,其反式激活ChREBP-β的转录,而ChREBP-β是更有效的转录激活因子。Tong等[6]发现,ChREBP对于肝癌及结肠癌细胞的增殖是必须的。抑制ChREBP的表达,会导致脂肪酸的从头合成,有氧糖酵解和核苷酸的生物合成明显减少,从而抑制了肿瘤细胞的增殖。体内实验发现,抑制ChREBP可使依赖p53的肿瘤减缓生长。体内外实验研究结果表明,ChREBP在调节肿瘤细胞代谢和抑制p53活性中发挥重要的作用,从而促进了肿瘤细胞的增殖。ChREBP的表达受糖脂代谢途径中间代谢产物如葡萄糖和脂肪酸的调控。本研究发现,AGEs作为糖代谢的产物之一,经其刺激后HCT116细胞中的ChREBP-β和总ChREBP mRNA水平都有增加,ChREBP-β作为更有效的转录激活因子,其mRNA水平增加最为明显。RT-PCR结果显示,AGEs刺激后,HCT116细胞中受ChREBP激活的下游靶基因ACC、TXNIP和SCD1的mRNA水平都有增加,而被ChREBP抑制的下游靶基因Pepck、G6Pase、PPARα和INHBE的mRNA水平都有降低。本研究提示AGEs通过上调ChREBP从而促进了HCT116细胞的增殖。
在糖尿病患者体内,由于高血糖加速了AGEs的产生,AGEs的形成过程中由于葡萄糖和中间产物自氧化产生ROS,进一步促进AGEs的生成,ROS的产生与AGEs的生成是相互促进的[20]。前期工作显示,AGEs也可以与靶细胞膜上的受体RAGE相结合,刺激细胞产生ROS,AGEs可诱导内皮细胞、胰岛β细胞、胰腺星状细胞和HCT116细胞发生氧化应激[7,21-23]。本研究发现,在葡萄糖浓度为0mmol/L 的DMEM培养条件下,AGEs刺激后增加HCT116细胞中ChREBP的表达,但在AGEs加入前先用NAC孵育的细胞中,AGEs刺激所致ChREBP表达增加被明显抑制,AGEs刺激所致的HCT116细胞增殖也被明显抑制。同样,高糖处理所致ChREBP的表达增加亦能被NAC所抑制。因此本研究推测,AGEs和葡萄糖可能都是通过氧化应激,增加转录因子ChREBP表达,进而促进肿瘤细胞的增殖。
总之,本研究发现,AGEs通过激活氧化应激反应来上调ChREBP的表达,从而增加结肠癌细胞的增殖;提示AGEs-ROS-ChREBP通路可能为糖尿病患者恶性肿瘤发病率增高的原因之一,同时也预示通过强化降糖治疗使血糖达标,降低体内AGEs的含量,可能对于预防糖尿病患者恶性肿瘤的发生具有重要的意义,并为延缓糖尿病合并肿瘤的发生及进展开辟新的思路与途径。
