不同植物生长调节剂对蓝果忍冬叶片愈伤组织诱导的影响
2018-07-10霍俊伟薛晓晓刘庆帅刘化禹谢佳璇孙小娟员盎然
霍俊伟,薛晓晓,秦 栋,刘庆帅,刘化禹,谢佳璇,孙小娟,员盎然,陶 韬
(东北农业大学园艺园林学院,哈尔滨 150030)
蓝果忍冬(Lonicera caerulea L.)为忍冬科(Capri⁃foliaceae)忍冬属(Lonicera)小浆果,俗称蓝靛果,我国大小兴安岭、长白山山区野生资源丰富[1]。果实富含花色苷类、黄酮类及多酚类等生物活性物质,氨基酸、糖类、有机酸、矿物质等营养物质,具有较高营养和医疗保健价值[2],可预防癌症、心血管、糖尿病等疾病[3]。
实际生产中蓝果忍冬品种相对单一,缺乏优质苗木,难以满足市场需求,提高育种效率,培育具有不同特点新品种,建立蓝果忍冬组培快繁体系尤为必要。以离体再生技术为基础的遗传转化技术可提高育种效率,拓宽育种途径,加快苗木繁育。愈伤组织诱导是建立离体再生体系必要步骤,也是研究蓝果忍冬活性成分基础。
目前,蓝果忍冬组织培养和离体再生方面研究主要包括两方面:一是以带芽茎段、腋芽、茎尖等为外植体建立组培快繁体系,探索各培养阶段适合生长调节剂比例、合适基本培养基、培养条件等[4-5]。二是以茎段和叶片诱导愈伤组织建立再生体系[6-7]。
植物生长调节剂可影响外植体内源激素水平,促进离体器官生长和愈伤组织形成[8]。忍冬属植物愈伤组织诱导可用BA、KT、IAA、NAA、2,4-D等,如单独添加2,4-D各处理均可诱导金银花叶片产生愈伤组织,以1.0 mg·L-1最佳,添加KT可改善愈伤组织状态,提高诱导率,不定芽诱导培养基为MB+2.0 mg·L-16-BA+0.1 mg·L-1IBA[9]。细胞分裂素和生长素配合使用可有效诱导产生多种植物愈伤组织,但细胞分裂素浓度不易过高。MS培养基添加1.0 mg·L-1NAA和0.1 mg·L-16-BA可诱导蓝果忍冬茎尖、茎段、叶片产生愈伤组织,诱导率最高达86.7%[6-7]。4.4 μmol·L-16-BA与2.26 μmol·L-12,4-D配比可有效诱导灰毛毡忍冬叶片产生愈伤组织,诱导率达86.7%[10]。CPPU、TDZ、ZT也广泛应用于愈伤组织诱导[11],均具有高活性,诱导效率较高。CPPU在诱导苎麻产生愈伤组织时活性高于6-BA,再生效率更高[11]。非洲菊叶片愈伤组织诱导选用2 mg·L-1TDZ结合0.05 mg·L-12,4-D,培养15 d出愈率达80%以上,愈伤组织增殖培养则减小TDZ浓度[12]。TDZ也有负面作用,TDZ添加使花楸外植体褐化[13]。ZT是天然植物激素,可用于蓝莓组培快繁与再生[14]。此外KT、TDZ、ZT、6-BA等细胞分裂素相互组合再结合生长素类对某些植物诱导效果良好,6-BA 0.3 mg·L-1+NAA 0.1 mg·L-1基础上添加KT 0.2 mg·L-1有利于江南牡丹茎段愈伤组织分化[15]。MS+BA 1.0 mg·L-1+KT 0.5 mg·L-1有利于红掌叶片愈伤组织分化[16]。
本文针对蓝果忍冬组培快繁技术选择不同消毒条件组合探讨组培成活率[17],蓝果忍冬愈伤组织诱导中未见使用CPPU、TDZ、ZT及几种生长调节剂组合处理,不同生长调节剂对蓝果忍冬叶片愈伤组织诱导影响未见报道。
本试验选用两个引自俄罗斯蓝果忍冬鲜食品种为试材,通过培养无菌苗,采取叶片,添加一种和多种生长调节剂诱导叶片愈伤组织,以期为蓝果忍冬叶片再生体系建立奠定基础,为组培快繁研究提供科学依据。
1 材料与方法
1.1 材料及培养
试验于2017~2018年在东北农业大学园艺园林学院完成,以两个引自俄罗斯鲜食品种邱雷姆和娜雷姆为试材,MS培养基继代培养30 d,取无菌苗中上部叶片,接种时在叶片正面横切形成划痕,叶片背面接触培养基,接种到添加蔗糖30 g·L-1,琼脂7 g·L-1,pH 5.8,附加不同生长调节剂MS培养基,于人工气候室暗培养相应时间后转移至光下培养,培养40 d。暗培养条件为湿度75%,温度(25±1)℃。
1.2 试验处理及方法
1.2.1单一植物生长调节剂诱导叶片愈伤组织
以两品种无菌苗叶片为材料,以MS为基本培养基,选用6-BA、2,4-D、TDZ、ZT和CPPU 5种激素设计单因素试验,浓度均为0.5、1.0、2.0 mg·L-1。暗处理15 d后置于光下培养。叶片经培养基培养40 d后观察愈伤组织诱导情况。
1.2.2两种植物生长调节剂组合诱导叶片愈伤组织
选用6-BA和2,4-D激素组合,TDZ和ZT激素组合,设计两个复因素试验:暗处理15 d后置于光下培养。叶片在培养基培养40 d后观察愈伤组织诱导情况。
6-BA设2个水平:1.0、2.0 mg·L-1;2,4-D设3个水平:0.2、0.5、1.0 mg·L-1设计6个水平组合完全随机试验。TDZ设2个水平:1.0、2.0 mg·L-1;ZT设3个水平:0.1、0.3、1.0 mg·L-1设计6个水平组合完全随机试验。
1.2.33种植物生长调节剂组合诱导叶片愈伤组织
MS培养基中添加6-BA(0.5、1.0、1.5 mg·L-1),IBA(0.1、0.2、0.3 mg·L-1)和KT(0.5、1.0、1.5 mg·L-1),采用3因素3水平正交设计,按照L9(34)前3列安排试验,共9个处理组合(见表1)。暗处理35 d,统计出愈率,褐化率,观察愈伤组织状态。
1.3 数据统计与处理
出愈率(%)=愈伤组织数/外植体数×100%,褐化率(%)=褐化叶片数/外植体数×100%。
所有试验均重复3次,数据统计分析及作图采用SPSS 19.0和Excel 2007软件。

表1 蓝果忍冬叶片愈伤组织诱导正交设计Table 1 Orthogonal design of the blue honeysuckle leaves callus induction (mg·L-1)
2 结果与分析
2.1 单一植物生长调节剂对叶片愈伤组织诱导影响
添加不同单一生长调节剂对蓝果忍冬叶片愈伤组织诱导效果不同。2,4-D、ZT、CPPU诱导叶片产生愈伤组织,但添加6-BA和TDZ无法诱导产生愈伤组织(数据未列出);2,4-D、ZT、CPPU可诱导叶片产生愈伤组织,但出愈率和愈伤组织颜色、质地等差异较大(见表2~4,图1)。
3种调节剂中以2,4-D诱导效果最好,邱蕾姆和娜蕾姆出愈率均达90%以上,当2,4-D浓度达1.0 mg·L-1以上时,出愈率达100%;ZT和CPPU诱导率较低,ZT处理仅诱导邱雷姆出现少量愈伤组织,浓度2.0 mg·L-1处理下,邱雷姆叶片出愈率仅为13%,且愈伤组织呈黄色或棕褐色(见图1I~L),量极少,易褐化,污染严重,娜雷姆无愈伤组织产生且褐化污染严重。CPPU处理组诱导效果稍优于ZT处理,邱雷姆0.5、2.0 mg·L-1处理均可产生愈伤组织,出愈率分别为15%、21%,娜雷姆仅2.0 mg·L-1时有愈伤组织出现,出愈率为15%,同样量少易褐化,污染严重。3种调节剂相比,ZT和CPPU启动叶片产生愈伤组织时间长,出愈率低且有褐化和污染现象,不适合作蓝果忍冬叶片愈伤组织诱导剂。
2,4-D诱导愈伤组织形态复杂。接种一周划痕处出现颗粒状突起,愈伤启动,接种10 d叶片划痕处形成淡黄色透明愈伤组织(见图1A)。随后5 d暗培养,愈伤组织快速增大,将愈伤组织转移至光周期16 h/8 h光下培养,愈伤组织渐渐转绿,部分愈伤组织质地变硬,部分愈伤组织颜色变为稀软红棕色(见图1B~H)。随2,4-D浓度升高,邱雷姆愈伤量先增后减,娜雷姆愈伤量先减后增(见表2)。
从愈伤量比较,邱雷姆2,4-D浓度1.0 mg·L-1时诱导效果最佳,娜雷姆2,4-D浓度2.0 mg·L-1时诱导效果最佳。若考虑愈伤组织后续再生芽诱导培养,则娜雷姆选2,4-D浓度0.5 mg·L-1时较好,此浓度下愈伤组织致密紧实,呈颗粒状,有利于不定芽再生。
2.2 添加两种植物生长调节剂对叶片愈伤组织诱导影响
由图2、表5、6可知,不同生长调节剂组合对蓝果忍冬叶片愈伤组织诱导效果不同。6-BA与2,4-D各组合均可有效诱导叶片产生愈伤组织,但TDZ和ZT组合诱导率极低,仅邱雷姆出现少量愈伤且呈黄棕色,易褐化(见图2J)。
6-BA与2,4-D组合各处理诱导率均可达100%,且愈伤组织多呈绿色、黄绿色、深绿色或淡黄色,表面有瘤状突起,颗粒状,质地紧实,愈伤量多,愈伤组织生长快,无褐化(见图2A~F)。这与单独添加2,4-D诱导的愈伤组织有差异,可能是细胞分裂素与生长素相互作用结果。各处理愈伤量略有差异,当6-BA浓度为1.0 mg·L-1时,邱雷姆叶片愈伤量随2,4-D浓度升高而增多,娜雷姆愈伤量则先增后减,2,4-D浓度0.5 mg·L-1时愈伤量达最多,但少于邱雷姆。6-BA浓度为2.0 mg·L-1时,两品种均在2,4-D浓度0.5 mg·L-1时达最大愈伤量。各处理娜雷姆愈伤量少于邱雷姆,原因是品种差异所致。

表2 2,4-D对叶片愈伤组织诱导的影响Table 2 Effect of 2,4-D on callus induction of leaf
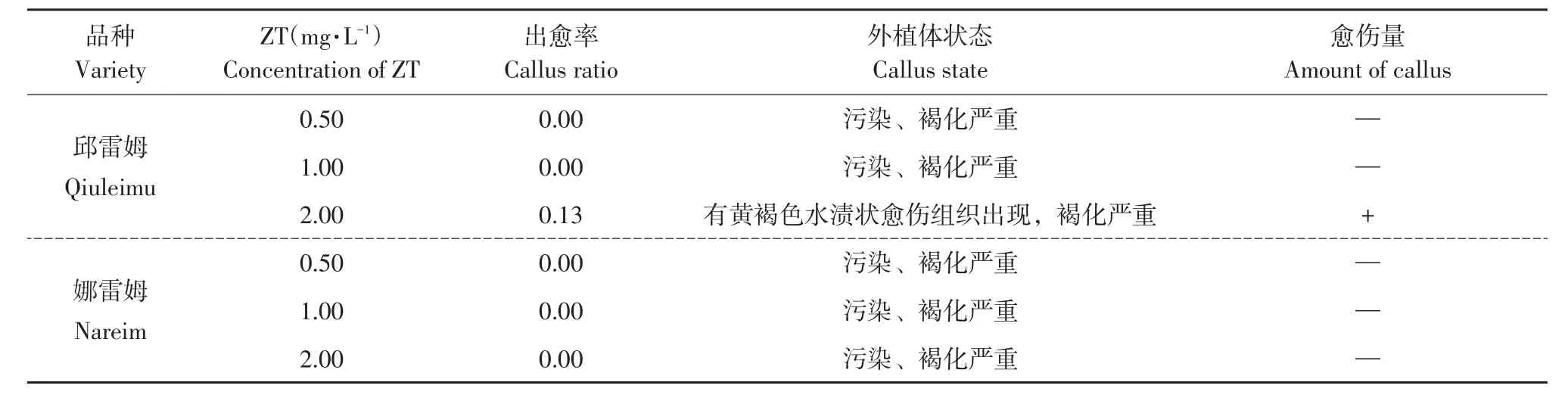
表3 ZT对叶片愈伤组织诱导的影响Table 3 Effect of ZT on callus induction of leaf
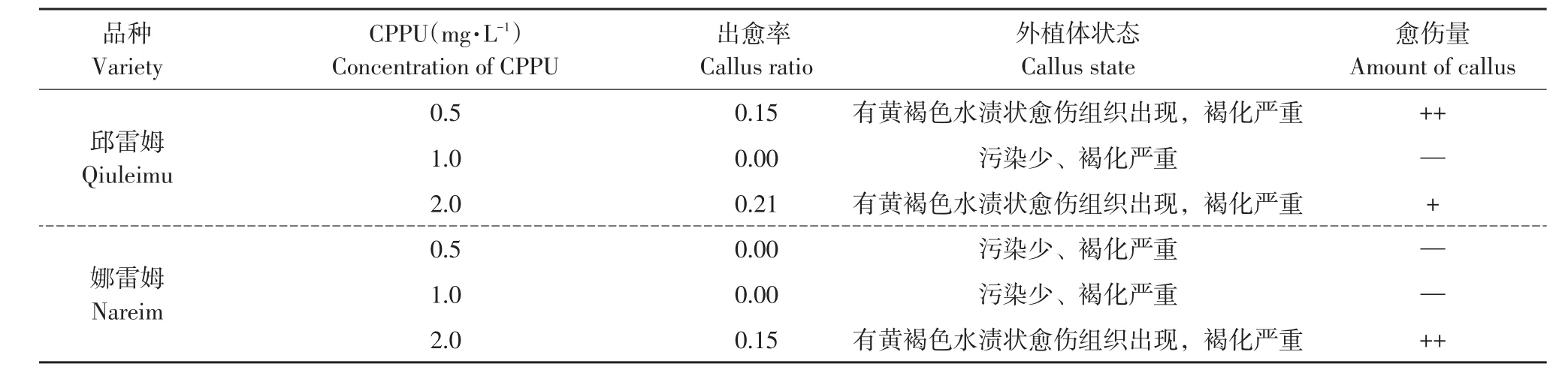
表4 CPPU对叶片愈伤组织诱导的影响Table 4 Effect of CPPU on callus induction of leaf

图1 2,4-D、ZT、CPPU诱导的叶片愈伤组织Fig.1 Leaf callus induced by 2,4-D,ZT and CPPU
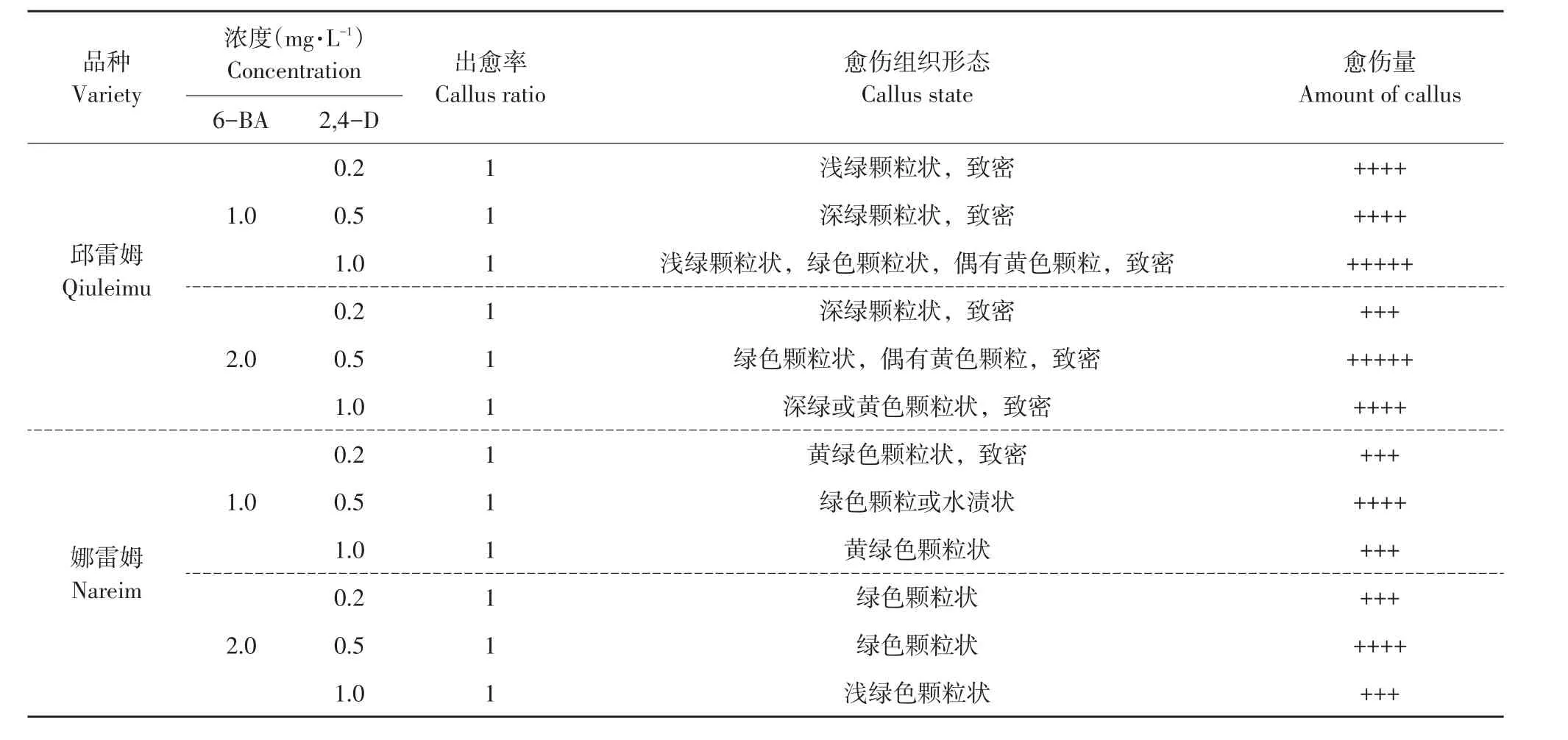
表5 6-BA与2,4-D组合对叶片愈伤组织诱导的影响Table 5 Effect of combination of growth regulators(6-BA,2,4-D)on callus induction of leaf
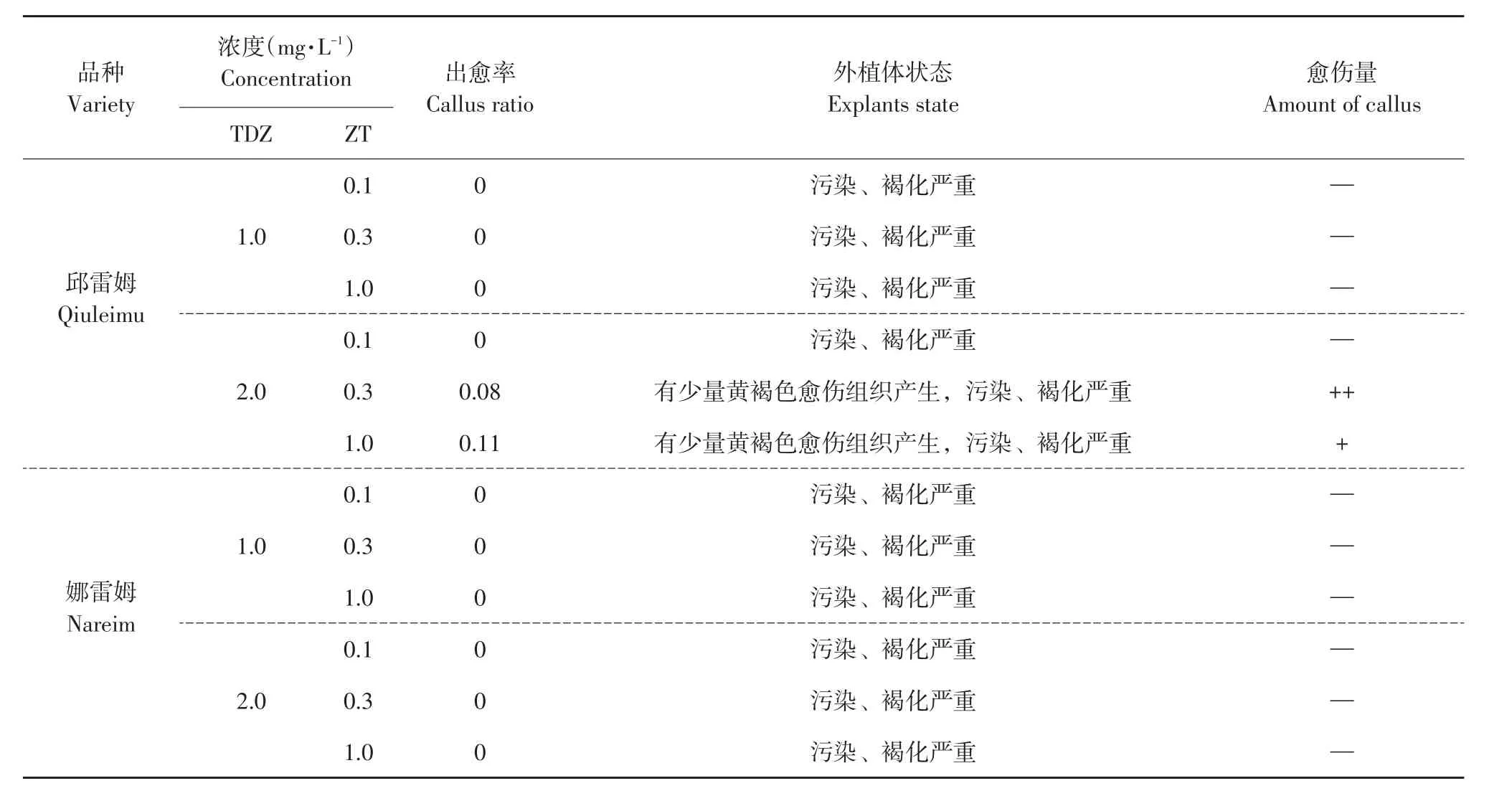
表6 TDZ与ZT组合对叶片愈伤组织诱导的影响Table 6 Effect of combination of growth regulators(TDZ,ZT)on callus induction of leaf

图2 两种生长调节剂组合诱导的愈伤组织Fig.2 Leaf callus induced by a combination of two growth regulators
2.3 添加3种植物生长调节剂对叶片愈伤组织诱导影响
3种调节剂6-BA、IBA、KT的9种组合处理对蓝果忍冬不同品种叶片愈伤组织诱导效果不同(见表7),方差分析表明,影响邱雷姆叶片愈伤组织诱导主次因素为IBA>6-BA>KT,影响娜雷姆叶片愈伤组织诱导主次因素为KT>IBA>6-BA(见表8~9)。两品种存在差异,可能与不同品种对细胞分裂素敏感性有关。MS+6-BA 1.0 mg·L-1+IBA 0.3 mg·L-1+KT 0.5 mg·L-(1处理6)对两品种诱导率均达95%以上,可作为通用体系。
3种调节剂组合各处理诱导的愈伤组织形态基本相同,均为黄色颗粒状,质地较硬(见图3)。结合表7和图3,从诱导率、愈伤量或褐化比较,邱雷姆诱导效果均好于娜雷姆,可能与品种差异有关。
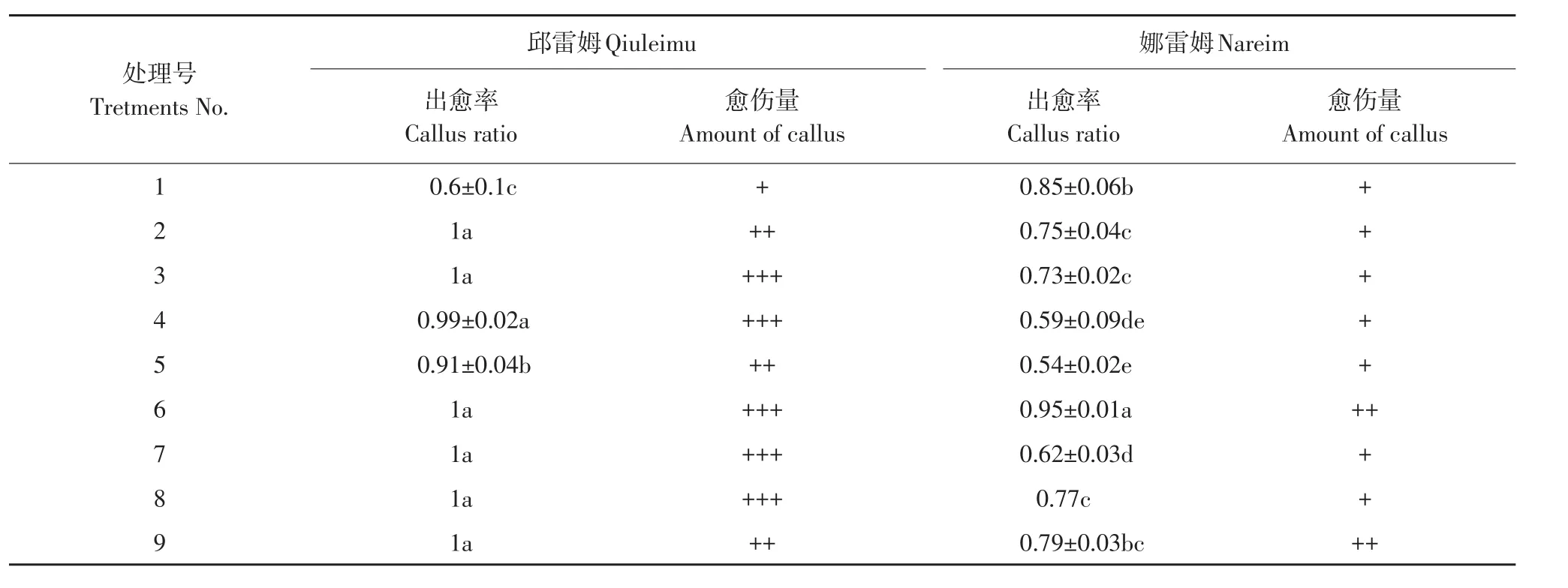
表7 6-BA、IBA、KT组合对叶片愈伤组织诱导的影响Table 7 Effect of combination of growth regulators(6-BA,IBA,KT)on callus induction
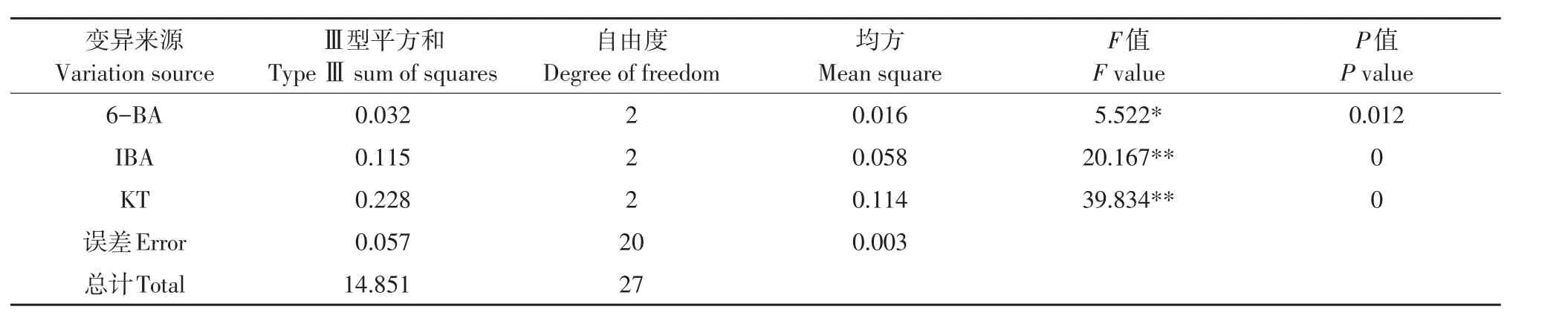
表8 娜雷姆叶片愈伤诱导率结果方差分析Table 8 ANOVE analysis result of leaf callus induction rate in Nareim
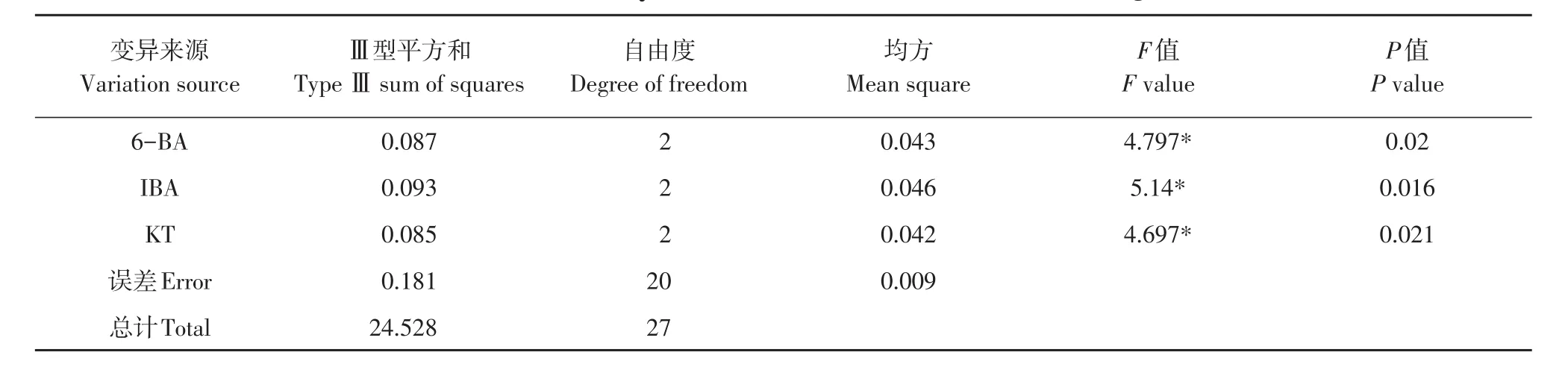
表9 邱雷姆叶片愈伤诱导率结果方差分析Table 9 ANOVE analysis result of leaf callus induction rate in Qiuleimu
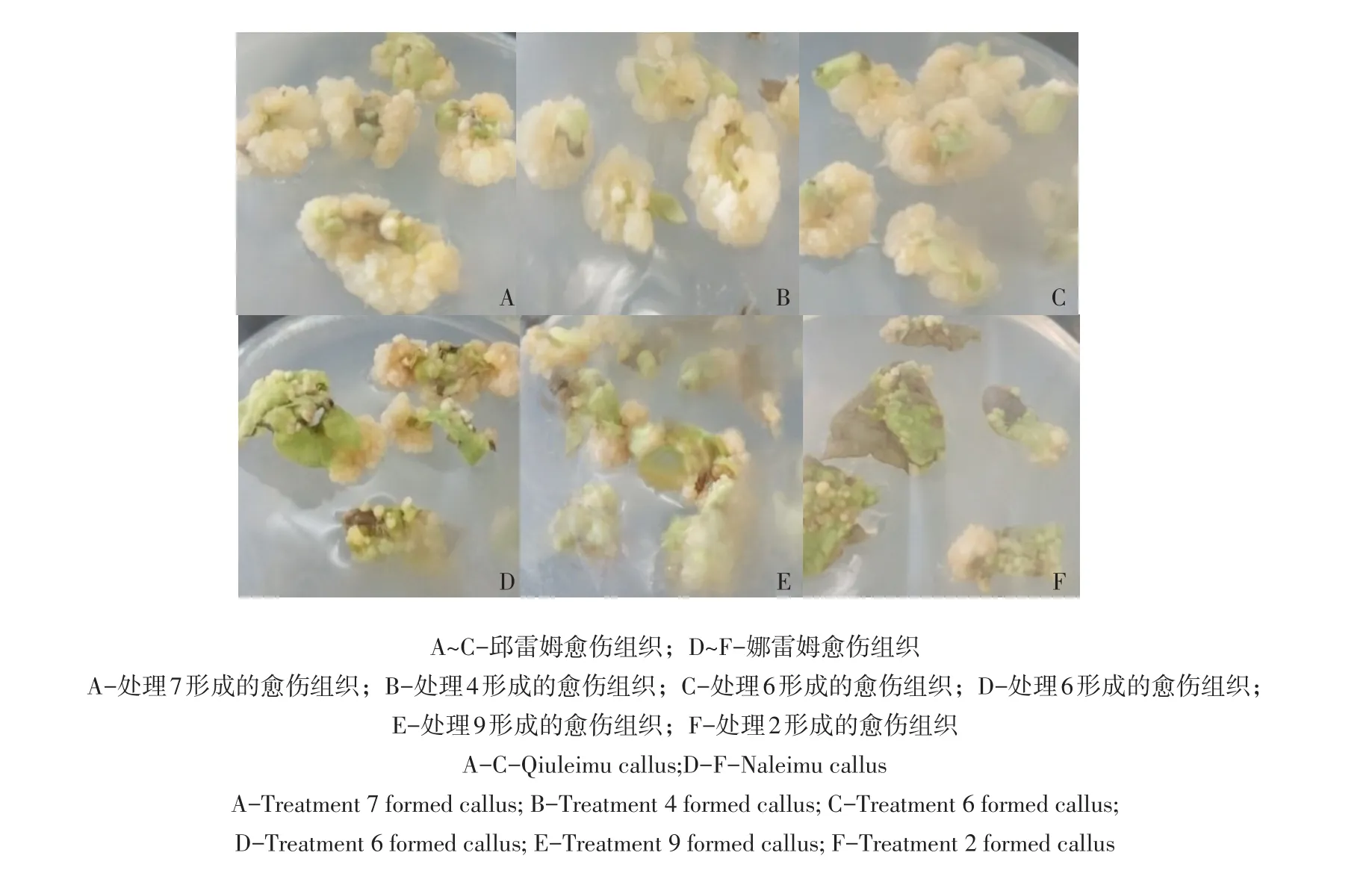
图3 3种生长调节剂组合诱导的愈伤组织Fig.3 Leaf callus induced by a combination of three growth regulators
2.4 3种不同添加方式对蓝果忍冬叶片愈伤组织诱导比较
通过图1~3愈伤组织形态对比及表2、5、7数据对比,不同方法愈伤组织诱导效果不同。添加单一生长调节剂,2,4-D是诱导蓝果忍冬叶片产生愈伤组织最有效物质,浓度范围0.5~2.0 mg·L-1均有效,6-BA、TDZ、ZT、CPPU效果较差。
添加两种调节剂处理优于单一调节剂处理,2,4-D处理各浓度下出愈率均为100%,但愈伤组织质地多为淡黄色或绿色水渍状,较软,而2,4-D和6-BA配合处理下愈伤组织颜色多为绿色颗粒状,质地紧实致密,有利于后期培养和不定芽诱导,且愈伤量高于2,4-D单独处理。
6-BA、IBA、KT3种调节剂组合诱导率低于2,4-D和6-BA组合处理,且愈伤启动时间长,愈伤组织生长缓慢,该方案两个品种诱导效果差异较大,娜雷姆诱导率低,最低为处理4(59%),结果见表7。愈伤量很少且褐化率高(见图3F),邱雷姆愈伤量较多(见图3A~C),与单独添加2,4-D及添加6-BA和2,4-D组合处理诱导的愈伤量相当,但质地更为紧实,相反6-BA和2,4-D组合处理则更加松脆(见图2~3)。
3 讨论
早熟禾种子单独添加2,4-D即可诱导产生愈伤组织,1.0~2.0 mg·L-1诱导效果较好[18],0.1或0.2 mg·L-12,4-D与3 mg·L-16-BA组合诱导效果明显优于2,4-D单独处理。本试验结果表明,邱雷姆和娜雷姆分别在2,4-D浓度1.0和2.0 mg·L-1时诱导效果最佳,且6-BA与2,4-D组合处理优于2,4-D单独处理。与丁路明等研究结果类似。
一般高浓度2,4-D不利于愈伤组织诱导分化[19],黑果枸杞愈伤组织诱导培养基为MS+2,4-D 2.0 mg·L-1+6-BA 0.5 mg·L-1,愈伤组织分化培养基为MS+2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1,即低浓度2,4-D利于分化[20],本研究结果表明,娜雷姆在2,4-D浓度0.5 mg·L-1时,愈伤组织更为致密,有利于愈伤组织进一步分化。单独使用6-BA无法诱导杜仲叶片产生愈伤组织,6-BA与生长素NAA配合使用可诱导产生较好愈伤组织[21]。本研究结果表明,单独添加6-BA时叶片愈伤组织诱导率为0,但与生长素2,4-D结合效果较好,表明细胞分裂素类和生长素类配合使用愈伤组织诱导效果更好。
单独添加细胞分裂素6-BA、TDZ、CPPU均可诱导毛桃叶片产生愈伤组织[22]。1.0 mg·L-1ZT可诱导矮丛蓝莓茎段直接器官再生,5.0 mg·L-1ZT可诱导外植体通过愈伤组织途径再生[14]。本研究结果表明,CPPU、TDZ、ZT虽然活性较高,但对蓝果忍冬叶片愈伤组织诱导效果不佳,可能与物种不同有关。本研究表明该组合效果较差,不适于蓝果忍冬离体诱导及再生。
曹磊等研究表明,在6-BA与生长素NAA组合基础上添加KT,金铁锁带芽茎段出愈率和芽丛分化率均高达100%[23]。本研究采用6-BA、2,4-D、KT组合处理时两品种诱导率均达60%以上,且邱雷姆在大部分处理下诱导率为100%,说明KT对蓝果忍冬愈伤组织诱导效果显著。
利用叶片作愈伤组织诱导具有取材广,效率高等特点,提高苗木快繁效率,是离体再生体系建立基础。本试验探讨不同生长调节剂对叶片愈伤组织的诱导,由愈伤组织到可实际应有的完整植株,还需经愈伤组织分化不定芽及生根培养、炼苗移栽等多个环节。
