一株高产纤维素酶绿色木霉菌株诱变选育与发酵研究
2018-07-10黄晓梅赵红晓范金霞陈秀玲
黄晓梅,赵红晓,范金霞,陈秀玲
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.东北农业大学工程学院,哈尔滨 150030;3.东北农业大学园艺园林学院,哈尔滨 150030)
天然纤维素酶活性、产率低且成本高[1]。筛选高产纤维素酶生产菌株具有重要意义[2]。选育产纤维素酶菌株可弥补野生菌株不足,但存在酶活力不高,菌种退化现象[3],未形成规模化生产,需不断诱变选育高效产酶菌株并改善其发酵工艺使其达最佳产酶效果。
研究采用单因子及复合因子诱变方法,改造菌株同时优化产酶培养基及发酵条件,并采用培养条件易于控制、生产效率高且不易染菌的液态发酵方法培养菌株。绿色木霉具有实用价值,除具有较强分解天然纤维素能力,还有抑菌、促生、抗重金属和产抗生素等作用。因此,本研究分别利用UV、DES和NaNO2诱变及UV和DES、UV和NaNO2复合诱变方法处理绿色木霉菌株,选育纤维素酶高产突变株。优化高产纤维素酶突变株发酵工艺,确定最适发酵条件,为高产纤维素酶菌株开发和应用提供依据。
1 材料与方法
1.1 材料
1.1.1菌种
绿色木霉(T.viride)AS3.3711菌株购自中国科学院微生物菌种保藏中心。
1.1.2培养基
斜面和平板培养基:马铃薯培养基(PDA)[4]。
筛选培养基:CMC-Na 7.5~10 g·L-1,(NH4)2SO41.4 g·L-1,脲 0.3 g·L-1,KH2PO42.0 g·L-1,CaCl20.3 g·L-1,MgSO4·7H2O 0.3 g·L-1,蛋白胨 0.5~1.0 g·L-1,吐温 80 1.0~2.0 g·L-1,FeSO4·7H2O 5.0 mg·L-1,ZnSO4·7H2O 1.4 mg·L-1,MnSO4·H2O 1.6 mg·L-1,CoCl22.0 mg·L-1,pH 5~6[5],刚果红 0.2 g·L-1,琼脂 20 g·L-1。
种子液培养基:马铃薯液体培养基(PD)。
发酵产酶培养基:蛋白胨3 g·L-1,硫氨2 g·L-1,酵母膏 0.5 g·L-1,KH2PO44 g·L-1,CaCl2·2H2O 0.3 g·L-1,MgSO4·7H2O 0.3 g·L-1,吐温 80 0.2 g·L-1,碳源23.5 g·L-1[6],根据试验需要,调整培养基成分。
1.2 诱变和筛选
1.2.1孢子悬液制备
取活化培养4 d绿色木霉平板,无菌水冲洗下孢子,经3层无菌擦镜纸过滤至盛有玻璃珠无菌三角瓶中,振荡15 min,使孢子分散,稀释成浓度为1×106个·mL-1孢子悬液。
1.2.2单因子及复合因子诱变
紫外线(UV)诱变:在暗室无菌工作台上用30 W紫外灯,在距离30 cm涂布孢子的筛选培养基平板上分别照射60、180、300、420、540和660 s,以未处理组作对照,3次重复,置于28℃培养箱黑暗培养5 d,计算致死率,选取每个处理中水解圈最大菌株液体发酵测定酶活。
硫酸二乙酯(DES)诱变:在制备好的孢子悬液中分别加入2%DES混匀,于28℃条件下黑暗振荡处理10、20、30、40、50和60 min后加入Na2S2O3溶液终止反应。稀释后取50 μL孢子悬液均匀涂布于筛选培养基平板上,以未处理组作对照,3次重复,置于28℃培养箱黑暗培养5 d,计算致死率,选取每个处理中水解圈最大菌株液体发酵测定酶活。
亚硝酸钠(NaNO2)诱变:用无菌水将孢子悬液梯度稀释至1×10-5个·mL-1,取2.0 mL悬液和0.1 mol·L-1NaNO21.0 mL混匀,28℃下分别保温5、10、15、20、25和30 min,然后加入0.2 mol·L-1pH为4.4醋酸缓冲液1.0 mL,28℃保温10 min,加入2.0 mL pH为8.6 Na2HPO4中和以终止反应,各取0.1 mL均匀涂布于筛选培养基平板,3次重复,以未处理组作对照,置于28℃培养箱黑暗培养5 d,计算致死率,选取每个处理中水解圈最大菌株液体发酵测定酶活。
UV和DES复合诱变处理:根据UV和DES对菌株处理结果,确定复合诱变中UV照射时间和DES诱变时间,将诱变后孢子悬液适当稀释均匀涂布于筛选培养基平板上,以未处理组作对照,3次重复,置于28℃培养箱黑暗培养5 d,计算致死率,每个处理选取多个水解圈较大菌株液体发酵测定酶活。
UV和NaNO2复合诱变处理:根据UV和NaNO2对菌株处理结果,确定复合诱变中UV照射时间和NaNO2诱变时间,将诱变后孢子悬液适当稀释均匀涂布于筛选培养基平板上,以未处理组作对照,3次重复,置于28℃培养箱黑暗培养5 d,计算致死率,每个处理选取多个水解圈较大菌株液体发酵测定酶活。
致死率(%)=(处理菌株数-对照菌株数)/对照菌株数×100%。
1.2.3复筛
初筛获得菌株传代10代,接入发酵产酶培养基中复筛。以PD培养基1%接种孢子悬液,30℃,150 r·min-1条件下振荡培养48 h,制备种子液。按产酶培养基10%接种种子液振荡培养,定时取样测定发酵液纤维素酶活,每个处理均重复3次。
1.3 葡萄糖标准曲线绘制
葡萄糖标准曲线绘制:测定方法参照文献[7],略有改进。
1.4 纤维素酶活力测定
纤维素粗酶液制备:发酵液经5 000 r·min-1离心10 min,上清液即为粗酶液。
纤维素酶活测定:测定方法参照文献[8],略有改进。测定时间为3 d。
酶活单位:使用国际单位(U),每小时产生1 mg葡萄糖为1个酶活单位[9]。
1.5 发酵条件优化
1.5.1单因子试验
初始培养组分设定为:发酵产酶培养基,pH 6.0,培养温度30℃,接种量10%(V/V),在此基础上分别改变碳源种类、混合碳源种类、氮源种类、碳氮比例、培养时间、培养温度、pH、接种量和金属盐,分别测定酶活力。
1.5.1.1碳源种类对菌株产纤维素酶影响
发酵产酶培养基中碳源分别按2.35%含量加入葡萄糖、蔗糖、玉米秸秆、MCC、CMC、麸皮和水稻秸秆,接种种子液,每个处理均重复3次,培养24 h后测定酶活力,下同。
1.5.1.2混合碳源对菌株产纤维素酶影响
选择10种碳源,组成21种组合,两种碳源以1∶1比例混合,按2.35%含量加入发酵产酶培养基中,确定最佳碳源组合。
1.5.1.3氮源种类对菌株产纤维素酶影响
发酵产酶培养基中使用已得最佳碳源组合,选择10种氮源,按0.2%含量加入其中,得到最佳无机氮源和有机氮源。
1.5.1.4碳氮比例对菌株产纤维素酶影响
碳含量不变情况下,碳氮比例为9∶1、8∶1、7∶1、6∶1、5∶1、4∶1、3∶1和2∶1加入发酵产酶培养基中,优化最佳碳氮比例。
1.5.1.5培养时间对菌株产纤维素酶影响
将种子液加入发酵产酶培养基中,培养12、24、36、48和60 h后测定酶活力。
1.5.1.6培养温度对菌株产纤维素酶影响
将种子液加入发酵产酶培养基,培养温度分别设定为26、28、30、32、34和36℃,测定酶活力。
1.5.1.7初始pH对菌株产纤维素酶影响
用0.05 mol·L-1柠檬酸-柠檬酸钠缓冲液配制不同 pH(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0 和7.5)发酵产酶培养基,作为起始培养pH。
1.5.1.8接种量对菌株产纤维素酶影响
取对数生长期种子液接种至100 mL发酵产酶培养基中,接种量分别设定为6%、8%、10%、12%和14%(V/V)。
1.5.1.9金属盐对菌株产纤维素酶影响
配制发酵产酶培养基时,金属盐分别加入2 g·L-1ZnSO4·7H2O、MnSO4·H2O、Fe(2SO4)3·7H2O、CoCl2·6H2O、FeCl3和CaCl2·6H2O,以不加金属盐为对照。
1.5.2正交试验法
根据单因子优化结果,采用L1(837)正交试验优化结果。
2 结果与分析
2.1 葡萄糖标准曲线绘制
纵坐标为吸光值OD550,横坐标为葡萄糖含量,绘制标准曲线。葡萄糖标准曲线方程为y=0.6249x-0.0995,相关系数为R2=0.996>0.99,说明此标准曲线葡萄糖浓度和吸光值线性关系良好,通过测定样品吸光值来计算葡萄糖浓度。
2.2 突变株筛选
2.2.1初筛
2.2.1.1UV诱变剂量确定
UV对菌株致死效应和酶活力效应分别见图1和图2。

图1 UV诱变条件下菌株致死率Fig.1 Fatality rate by UV induced mutagenesis
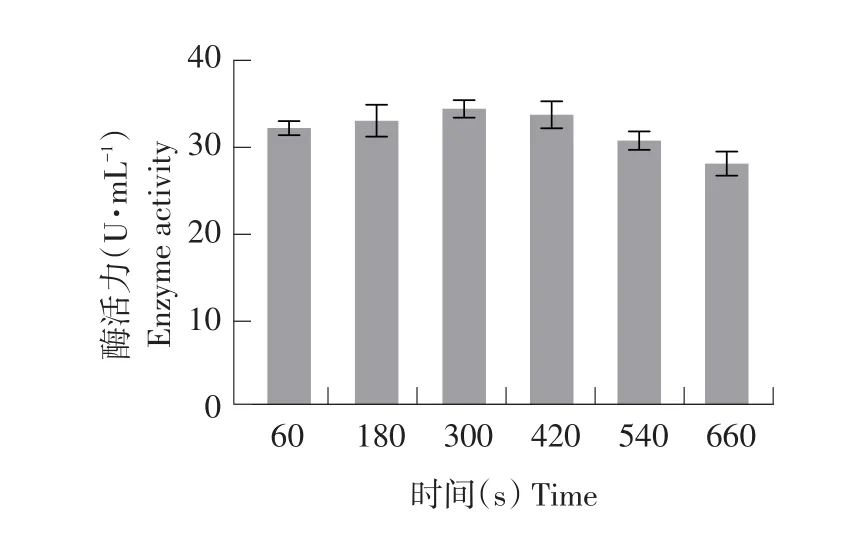
图2 UV诱变条件下突变菌株酶活力Fig.2 Enzyme activity of the mutant strain by UV induced mutagenesis
选取每个处理中水解圈最大单菌落突变株测定酶活。由图1可知,随UV对菌株处理时间延长,致死率增大。当致死率处于70%~90%时,正突变率较高。当UV处理300 s时,菌株致死率为81.80%,此时酶活力最高为34.19 U·mL-1(见图2),所有处理组中效果最佳,在UV诱变条件下,300 s为最佳诱变时间。
2.2.1.2DES诱变剂量确定
DES对菌株致死效应和酶活力效应分别见图3和图4。
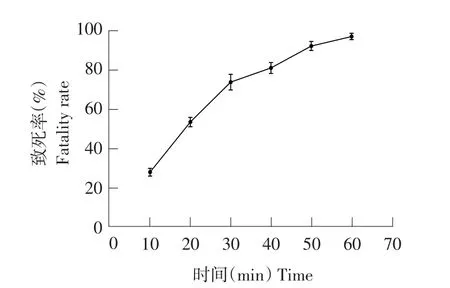
图3 DES诱变条件下菌株致死率Fig.3 Fatality rate by DES induced mutagenesis
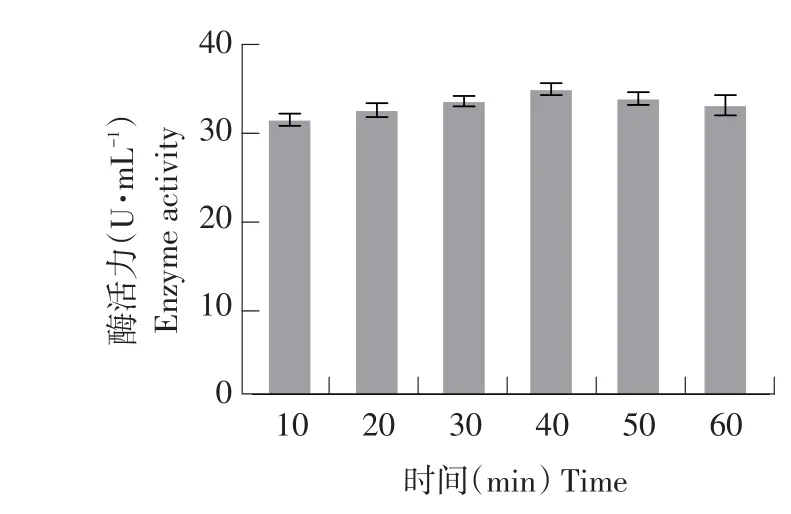
图4 DES诱变条件下突变菌株酶活力Fig.4 Enzyme activity of the mutant strain by DES induced mutagenesis
选取每个处理中水解圈最大单菌落突变株测定酶活。由图3可知,随DES对菌株处理时间延长,致死率增大。当DES处理40 min时,菌株致死率为81.32%,此时酶活力最高为35.60 U·mL-1(见图4),为所有处理组中效果最佳,在DES诱变条件下,40 min为最佳诱变时间。
2.2.1.3NaNO2诱变剂量确定
NaNO2对菌株致死效应和酶活力效应分别见图5和图6。
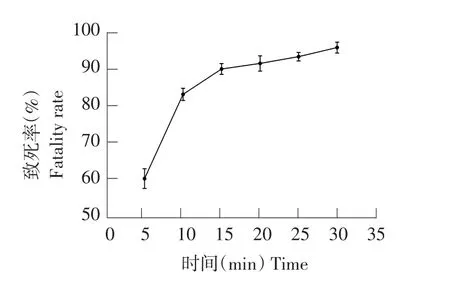
图5 NaNO2诱变条件下菌株致死率Fig.5 Fatality rate by NaNO2induced mutagenesis
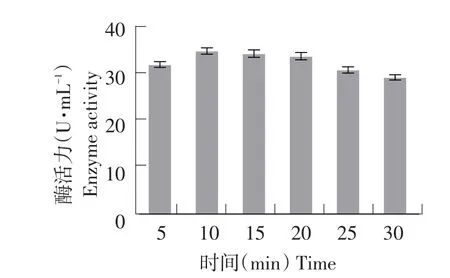
图6 NaNO2诱变条件下突变菌株酶活力Fig.6 Enzyme activity of the mutant strain by NaNO2induced mutagenesis
选取每个处理中水解圈最大单菌落突变株测定酶活。由图5可知,随NaNO2对菌株处理时间延长,致死率增大。当NaNO2处理10 min时,菌株致死率为83.07%,此时酶活力最高为35.22 U·mL-1(见图6),为所有处理组中效果最佳,故在NaNO2诱变条件下,10 min为最佳诱变时间。
2.2.1.4UV与DES复合诱变剂量确定
UV与DES复合诱变对菌株致死效应和酶活力效应分别见图7和8。选取每个处理中水解圈最大单菌落突变株测定酶活。由图7可知,随DES对菌株处理时间延长,菌株致死率增大。当DES处理40 min时,菌株致死率为80.30%,此时酶活力最高为37.37U·mL-(1见图8),为所有处理组中效果最佳。
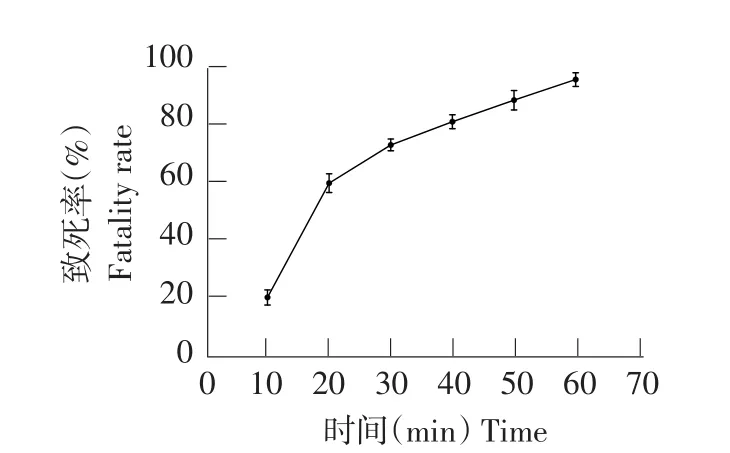
图7 UV与DES复合条件诱变下菌株致死率Fig.7 Fatality rate by UV and DES induced mutagenesis
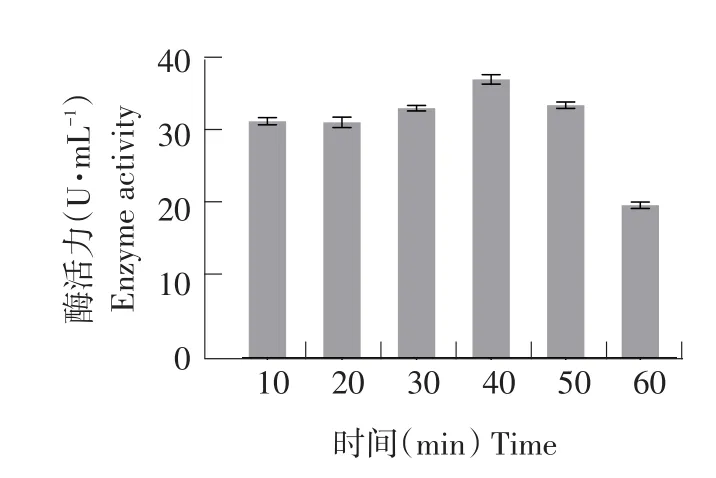
图8 UV与DES复合条件诱变下突变菌株酶活力Fig.8 Enzyme activity of the mutant strain by UV and DES induced mutagenesis
2.2.1.5UV与NaNO2复合诱变剂量确定
UV与NaNO2复合诱变对菌株致死效应和酶活力效应分别见图9和图10。
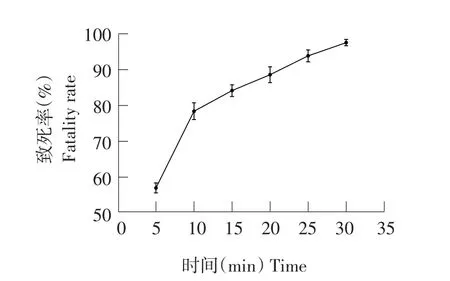
图9 UV与NaNO2复合条件诱变下菌株致死率Fig.9 Fatality rate by UV and NaNO2induced mutagenesis
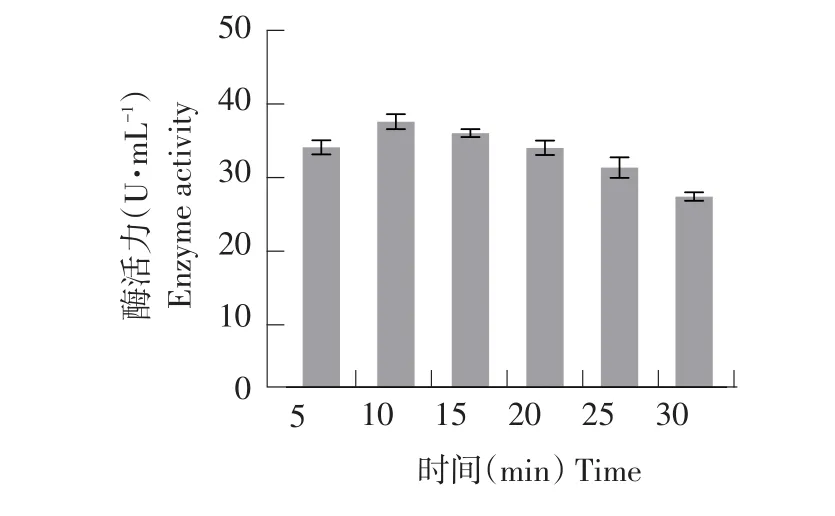
图10 UV与NaNO2复合条件诱变下突变菌株酶活力Fig.10 Enzyme activity of the mutant strain by UV and NaNO2induced mutagenesis
选取每个处理中水解圈最大单菌落突变株测定酶活。由图9可知,随NaNO2对菌株处理时间延长,致死率增大。当NaNO2处理10 min时,菌株致死率为78.56%,此时酶活力最高为38.20 U·mL-1(见图10),为所有处理组中效果最佳。
由此可见,复合诱变效果要优于单一UV、DES和NaNO2诱变效果。UV与NaNO2复合诱变下菌株酶活力大于UV与DES复合诱变下菌株酶活力,选取UV与NaNO2复合诱变后菌株开展后续试验。
2.2.2复筛
经10代继代培养筛选出4株诱变菌株液体发酵培养。结果见表1,不同菌株之间存在较大差异。方差分析(F=16.782,df=4,P<0.01)显示存在极显著差异。M213菌株与出发菌株相比,纤维素酶活提高率最高为32.24%,选取M213菌株作产酶发酵条件优化试验。
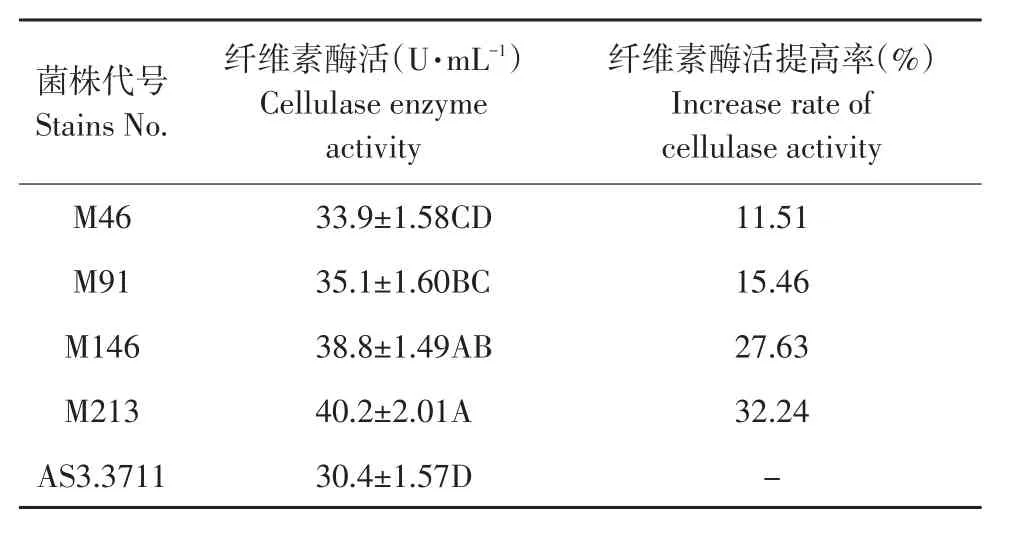
表1 复筛菌株与出发菌株纤维素酶活力比较Table 1 Comparison of cellulase enzyme activity between the rescreening strains and original strain
2.3 单因子对菌株产纤维素酶影响
2.3.1碳源种类对菌株产纤维素酶影响
碳源是纤维素降解真菌生长必不可少的营养物质,并影响其产酶能力。纤维素酶是诱导酶,不同碳源对纤维素酶产生不同诱导作用。如图11所示,以葡萄糖、蔗糖、CMC、MCC、麸皮、水稻秸秆和玉米秸秆为底物,可见最佳碳源为麸皮,此时酶活力为38.01 U·mL-1,原因是麸皮含有足量木质纤维素、淀粉和蛋白质等物质可在培养前期提供能源,使菌体生物量获得一定积累后再利用木质纤维素,获得更多生物量。
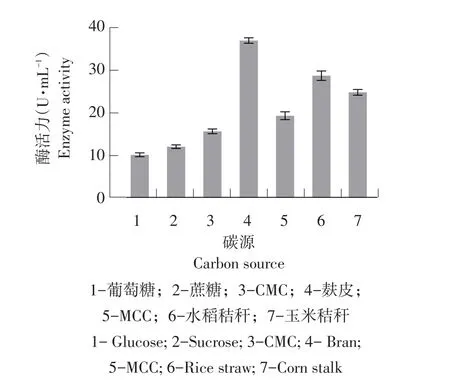
图11 碳源对菌株产纤维素酶影响Fig.11 Effects of carbon source on cellulase production
2.3.2混合碳源对菌株产纤维素酶影响
碳源满足菌体生长和产酶需要可产生较多纤维素酶[10]。在21种碳源组合中(见表2),纤维素酶活有较大差异。纤维性碳源组合,如水稻秸秆、玉米秸秆和麸皮,产纤维素酶效果优于可溶性碳源组合,如葡萄糖、蔗糖。其中麸皮/玉米秸秆酶活最高,其次是麸皮/水稻秸秆、玉米秸秆/水稻秸秆,其他组合酶活较低。原因一是纤维性碳源组合含有更复杂成分,如蛋白质和维生素等对菌株产酶有利的生长因子;二是纤维性碳源组合刺激菌体中纤维素酶系代谢加快。确定最佳碳源组合为麸皮和玉米秸秆,此时酶活力为39.15 U·mL-1。
2.3.3氮源种类对菌株产纤维素酶影响
不同氮源类型也是影响酶活力和产量重要因素,不同氮源会影响酶蛋白前体形成,从而调控酶合成[11]。本试验采用10种无机氮和有机氮,其对菌株产酶影响见图12,(NH4)2SO4为最适无机氮源,酶活最高,为39.03 U·mL-1。蛋白胨为最适有机氮源,酶活为17.29 U·mL-1。不同氮源对酶活影响较大,无机氮比有机氮更利于产酶,无机氮中氨态氮比硝态氮更利于产酶,由于不同基团氮代谢类型不同,NH4+可直接进入菌体内被迅速利用,而NO3-进入细胞后,需要被还原成NH4+后才可被菌体利用。有机氮中蛋白胨酶活较高,试验中选择相对廉价的豆饼粉[12]。因此,选择(NH4)2SO4作为无机氮源代表,豆饼粉作为有机氮源代表。
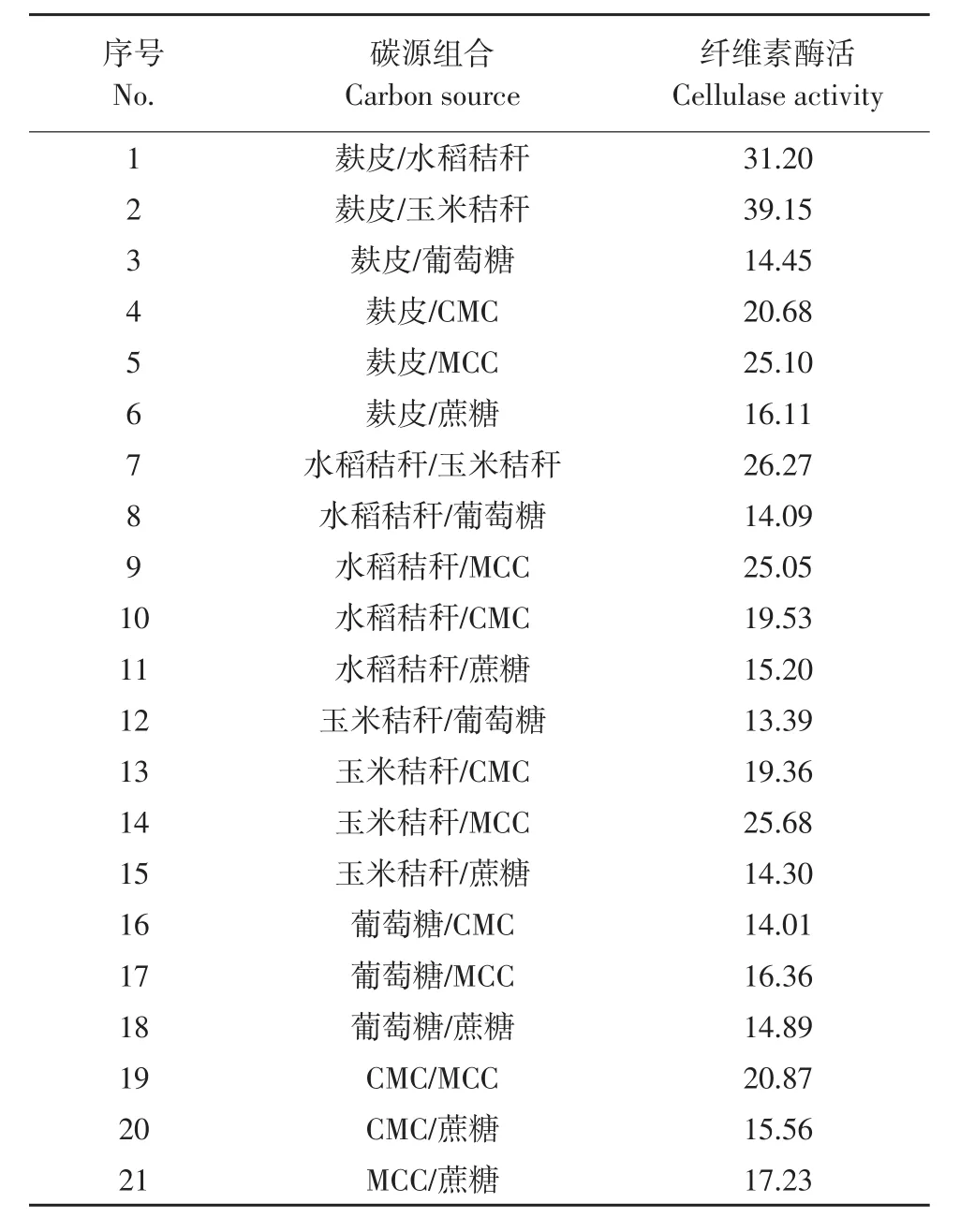
表2 碳源组合对绿色木霉产纤维素酶影响Table 2 Effects of carbon source combinations on cellulase production of T.viride (U·mL-1)
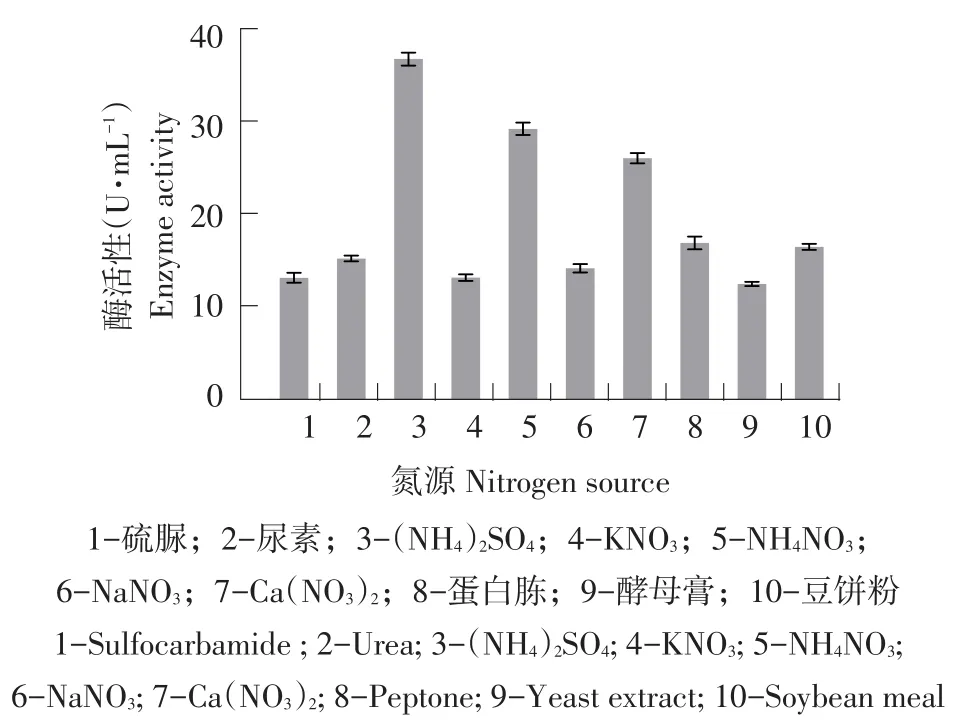
图12 氮源对菌株产纤维素酶影响Fig.12 Effects of nitrogen source on cellulase production
2.3.4碳氮比对菌株产纤维素酶影响
碳源和氮源比例是影响菌株生长和酶合成重要因素之一,碳源浓度相对较高有利于菌株生长,酶产量稳定增加[13];但碳源比重过高时,培养基内无法正常换气,含氧量不足,导致菌株生长受到严重影响,产酶量低。氮源比重过高,菌株生长过快,无法有效积累代谢产物;相反如果氮源浓度不足,菌体无法快速生长,影响酶产量。如图13所示,当碳氮比从9∶1减至7∶1时纤维素酶活力增加,随比例下降酶活力降低,碳氮比7∶1时酶活最高,为39.34 U·mL-1。综合考虑碳氮比为7∶1利于提高菌株酶活力。
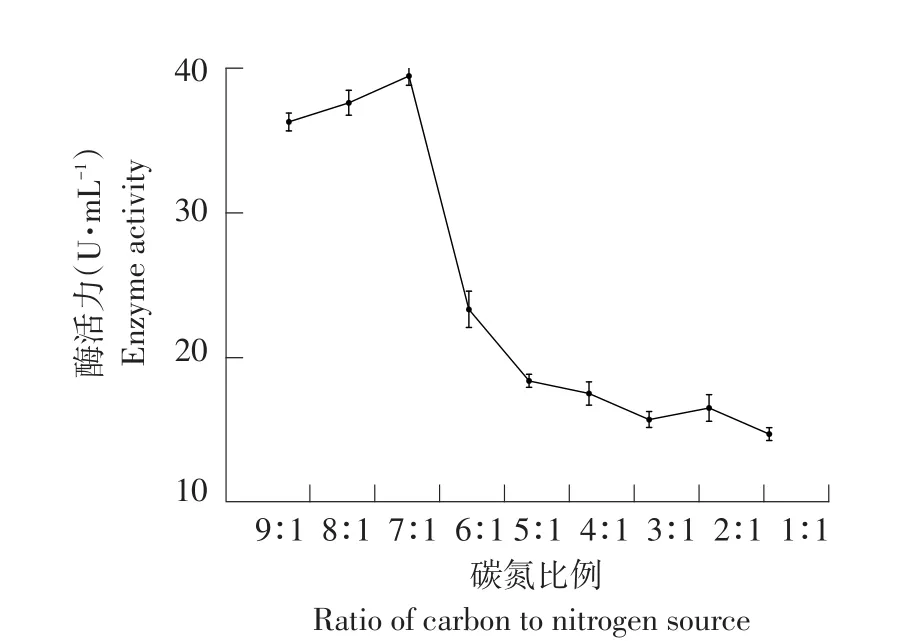
图13 碳氮比对菌株产纤维素酶影响Fig.13 Effects of carbon and nitrogen ratio on cellulase production
2.3.5培养时间对菌株产纤维素酶影响
将种子液接种于发酵产酶培养基后,生长初期产酶量低,随发酵时间变长,产酶量越高,由图14可知,培养24 h时酶活达最高值38.81 U·mL-1,但在培养24 h后随发酵时间延长产酶量下降。最佳收获酶时间为24 h。
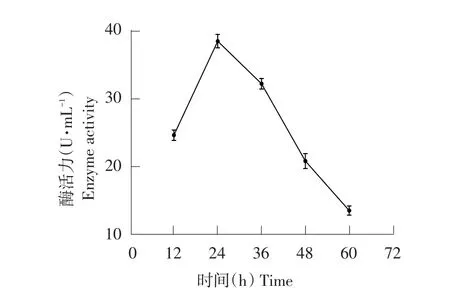
图14 培养时间对菌株产纤维素酶影响Fig.14 Effects of culture time on cellulase production
2.3.6培养温度对菌株产纤维素酶影响
培养温度影响菌体生长速度及产酶量。温度较高和较低对菌株产酶均不利,温度低时菌体生长受抑制,产酶活力较低;温度长时间过高时,导致菌体死亡并影响产酶[14]。
由图15可知,培养温度30℃时,酶活力达峰值,为39.35 U·mL-1。温度高于30℃后,酶活力降低。最适培养温度为30℃。
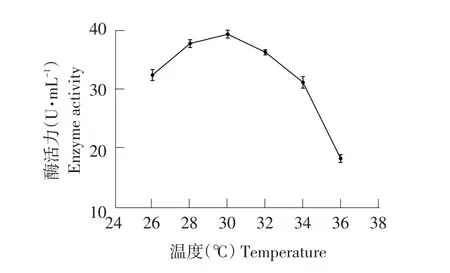
图15 培养温度对菌株产纤维素酶影响Fig.15 Effects of culture temperature on cellulase production
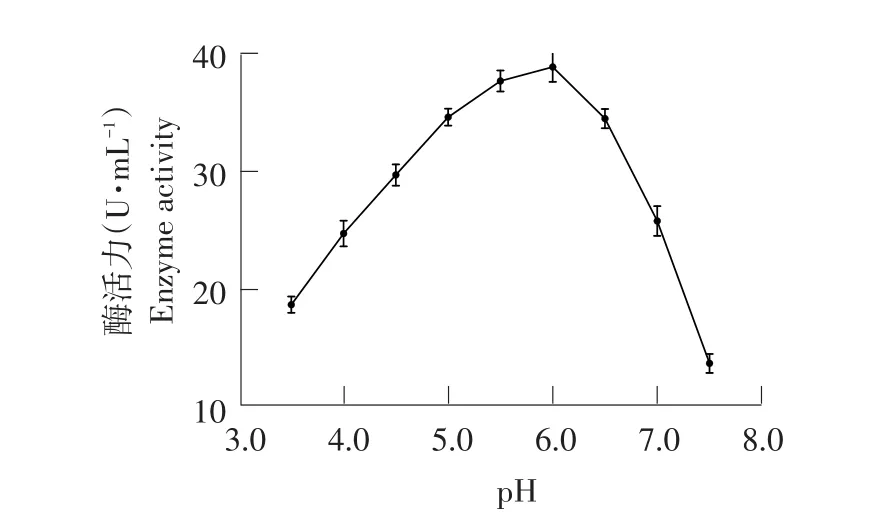
2.3.7初始pH对菌株产纤维素酶影响
pH通过影响细胞膜上电荷量产生,从而影响细胞对营养物质吸收。可控制培养基中有机化合物离子化程度,间接控制有效分子进入细胞数量,促进或抑制微生物生长[8]。pH影响酶稳定性和活性。
由图16可知,pH 3.5~6.0时,菌体生长较好,酶活逐渐升高;pH>6时,菌体生长缓慢,酶活下降趋势明显。即当pH=6时,最适产酶,酶活力为39.01 U·mL-1。因此该菌株适合在偏酸环境中生长。
2.3.8接种量对菌株产纤维素酶影响
接种量影响菌株发酵产量[15]。由图17可知,培养初期,接种量从6%~10%(V/V)时,酶活均呈上升趋势;接种量>10%(V/V)后,活性降低较快,由于菌体生长速度过快,培养基内含氧量降低,后期营养不足引起产酶量下降[16-17]。当接种量为10%(V/V)时,培养基内菌体量适宜,营养物质利用率最大,酶活为39.53 U·mL-1。
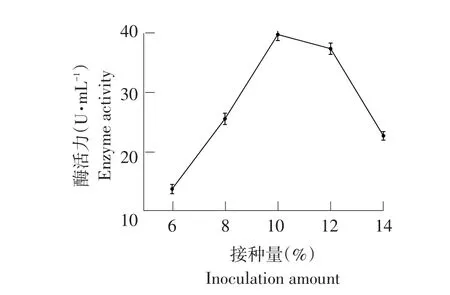
图17 接种量对菌株产纤维素酶影响Fig.17 Effects of inoculation amount on cellulase production
2.3.9金属盐对菌株产纤维素酶影响
由图18可知,最佳金属盐为Fe2(SO4)3·7H2O,酶活力为38.62 U·mL-1。FeCl3和MnSO4·H2O对酶活有促进作用,该因素与以上优化条件相比对产酶促进作用较差,因此在实际生产中应酌情添加。
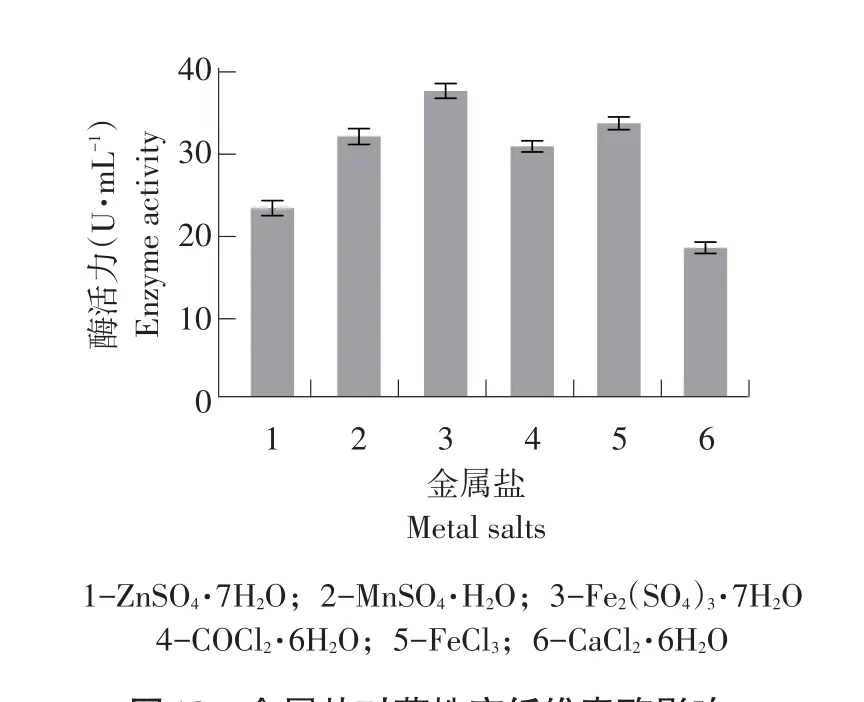
图18 金属盐对菌株产纤维素酶影响Fig.18 Effects of metal salts on cellulase production
2.4 发酵条件优化结果
结合单因子试验结果,优化多因素,见表3和4。
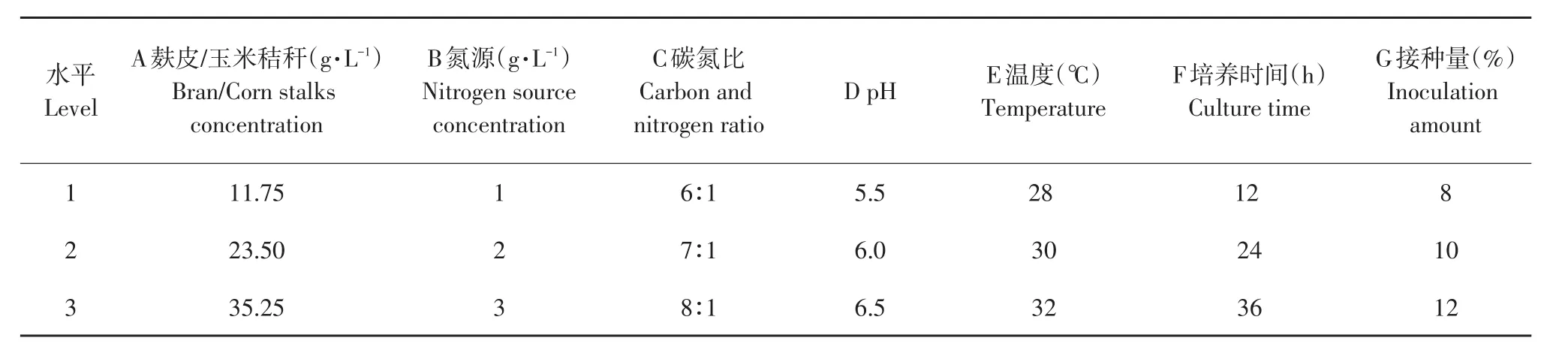
表3 正交因素水平Table 3 Factor and levels of orthogonal test method
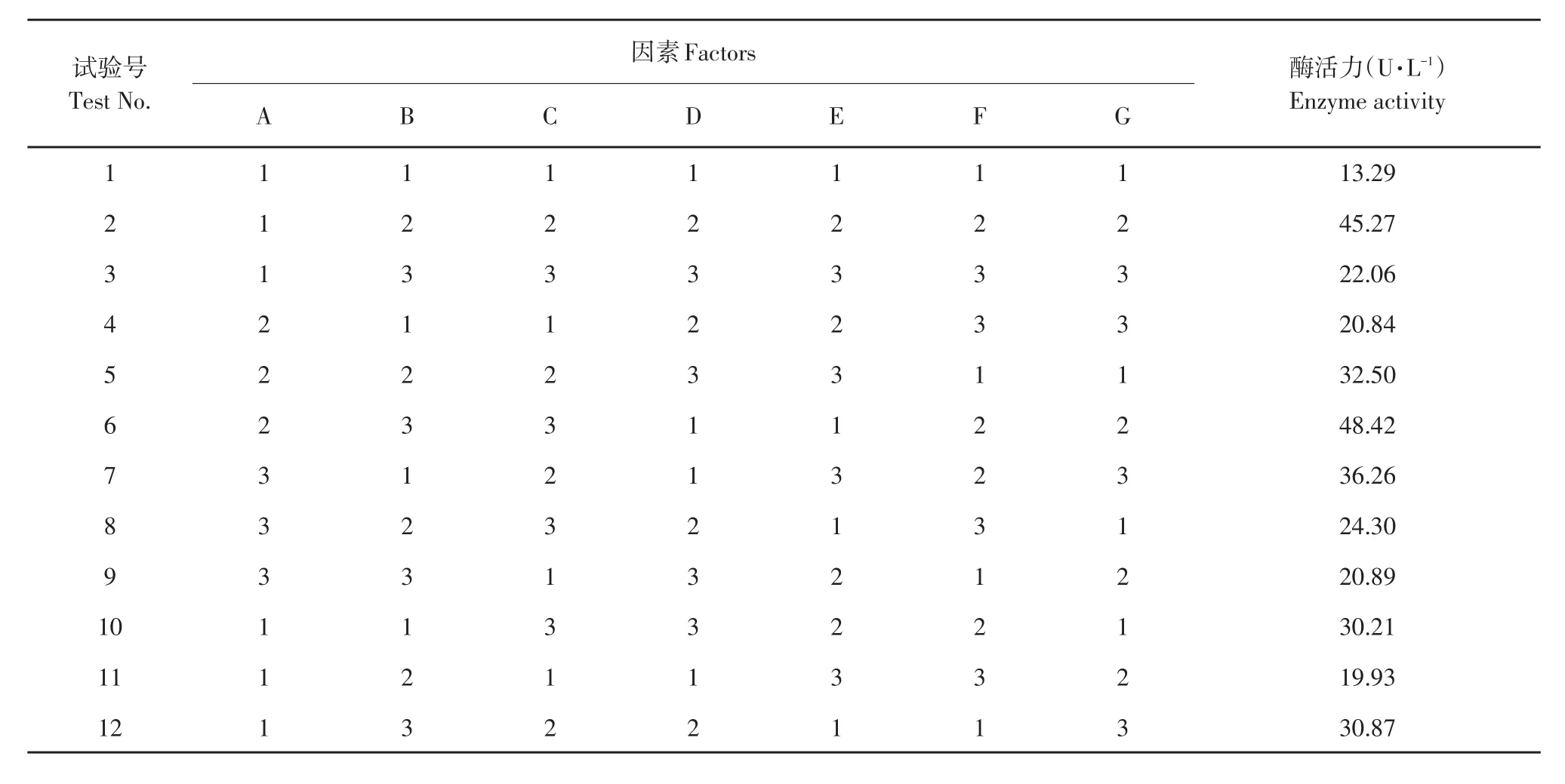
表4 正交试验结果Table 4 Results of orthogonal test
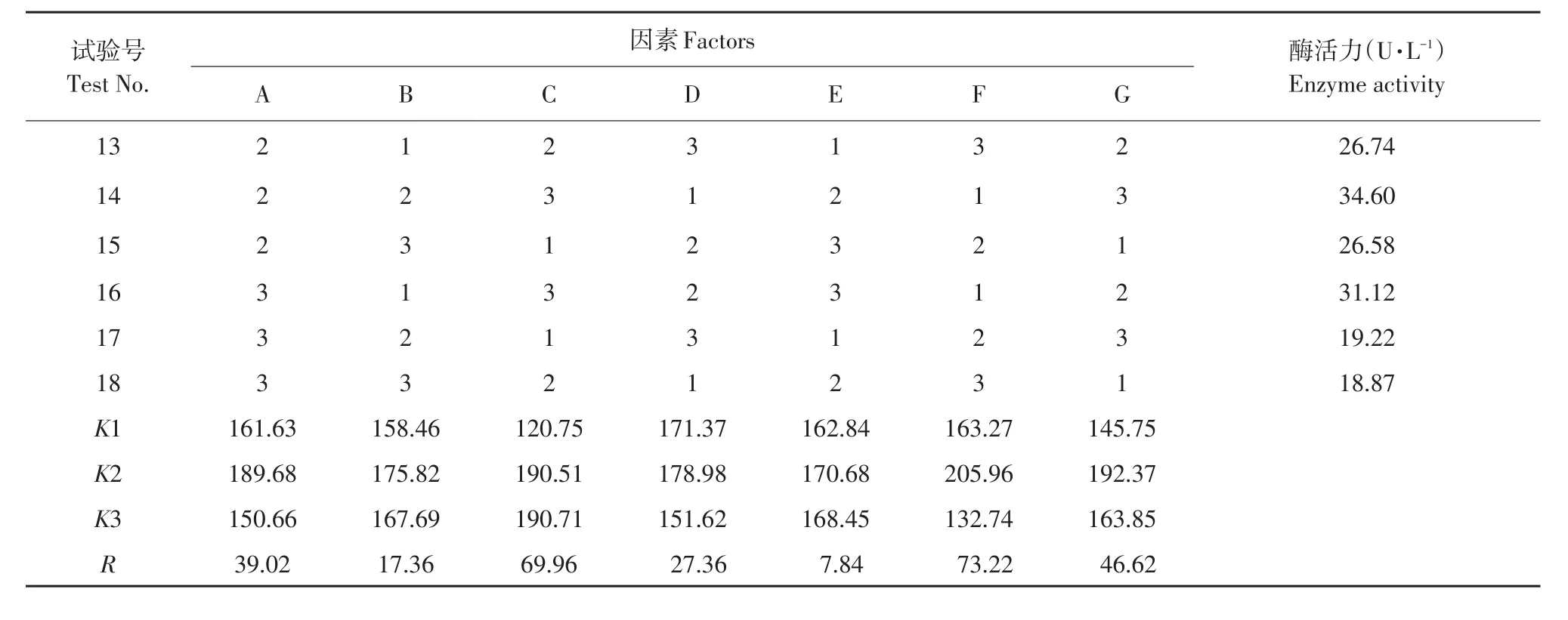
续表4
由表4可知,培养因素差异对纤维素酶活有显著影响,RF>RC>RG>RA>RD>RB>RE,说明影响菌株产酶主要因素为培养时间和碳氮比例,对菌株产酶影响最弱因素为温度。菌株在中性或偏酸性条件下长势较好。从而得出产酶发酵最优条件为A2B3C3D1E1F2G2,即:23.5 g·L-1麸皮和玉米秸秆,3 g·L-1(NH4)2SO4和豆饼粉,碳氮比8∶1,pH 5.5,培养温度28℃,培养时间24 h,接种量10%(V/V),酶活力48.42 U·mL-1。
3 讨论与结论
多数研究侧重测定绿色木霉适宜培养条件范围,本文探讨其最适发酵条件。胡立明等研究木霉和黑曲霉等产纤维素酶最适条件,最优条件为初始pH 4.5~7.0,培养温度28~32℃,发酵周期4~6 d[18-19]。本试验结果表明,绿色木霉M213最适温度30℃,最适pH 6.0,发酵周期3 d,与前人研究一致。绿色木霉M213具有更短发酵周期,在实际应用中可减少生产成本,快速投入生产。
野生菌种酶活力较低,无法满足工业生产要求,诱变育种是提高菌株酶活性和获得工业生产菌株有效途径[20-21]。本研究采用单因子及复合因子诱变方法,以绿色木霉AS3.3711为出发菌株,开展UV、DES和NaNO2单因子诱变及UV和DES、UV和NaNO2复合诱变。本研究中,单一UV诱变下菌株酶活力为34.19 U·mL-1,单一NaNO2诱变下菌株酶活力为35.22 U·mL-1,单一DES诱变下菌株酶活力为35.60 U·mL-1,而UV和NaNO2复合诱变下菌株酶活力为38.20 U·mL-1,比单一UV诱变下菌株酶活力提高11.73%,比单一NaNO2诱变下菌株酶活力提高8.46%。结果表明,利用UV和NaNO2复合诱变可发挥两种诱变剂协同作用,优于单一诱变剂诱变效果,有效提高菌株产纤维素酶能力。梁亮等证明复合诱变效果优于单因子诱变[22]。原因是单一诱变剂仅对菌株DNA某一个或几个位点突变,诱变得到高产菌株易恢复突变,长期使用诱变剂还会产生诱变剂“疲劳效应”、菌种生长周期延长、孢子量减少、代谢减慢等现象[10]。复合诱变具有协同效应,正突变菌株遗传比较稳定,诱变效果明显,通过影响DNA正常复制和转录,使子代DNA形成缺口,碱基错误插入该缺口,造成新链碱基序列与母链不同而使诱变提高菌株产酶活性[23]。在复合诱变中,UV和NaNO2复合诱变效果比UV和DES复合诱变效果好,表明UV和NaNO2复合诱变更有利于获得高效产酶菌株。即不同组合复合诱变结果不同,各单因子相互作用影响诱变结果,部分诱变剂对所选菌株产生相同诱变效应,菌株本身对不同诱变剂抵抗能力不同。
通过优化培养基条件提升菌株产酶效果,本研究中最适生长时间和发酵时间相同,最适接种量和发酵接种量相同。不仅可降低菌体生长和发酵产酶同步最优化技术难度,还可简化实际生产操作流程。当碳源为麸皮和玉米秸秆时酶活力比碳源为单一麸皮或玉米秸秆高,使用单一麸皮导致培养环境中无足够空气,加入纤维较粗玉米秸秆后,增强通气性,利于菌丝生长。郑亚平等研究也发现,不同碳源对纤维素酶诱导作用不同,使用多种碳源诱导效果更好[24]。
本研究中M213菌株在最优液体发酵条件下纤维素酶酶活力可达48.42 U·mL-1,是优化前(40.02 U·mL-1)1.21倍,是野生菌株(30.40 U·mL-1)1.59倍,产酶活力较兰时乐等分离绿色木霉突变株酶活力高[25]。因此,利用复合诱变方法选育绿色木霉具有可行性。绿色木霉M213菌株培养与发酵周期短、产纤维素酶活性高,具有重要开发价值。
