麦冬皂苷体外溶血作用研究
2018-07-10徐腾达邓燕君彭晓凤徐玉玲
刘 涛,徐腾达,梁 悦,张 倩,邓燕君,彭晓凤,徐玉玲
(成都大学 药学与生物工程学院,四川 成都 610106)
0 引 言
麦冬为百合科沿阶草属植物麦冬的肉质块茎,具有养阴润肺、益胃生津、清心除烦等功效.临床常用于治疗冠心病、心绞痛等症[1-2].目前,麦冬药材常用于中药注射剂中,如麦冬注射液、参麦注射液、红参麦冬复方注射液等[3-5].相关研究与报道显示,麦冬的主要成分之一为甾体皂苷,而皂苷类成分一般具有溶血作用,因此,该类中药注射液的主要不良反应为产生溶血现象[6-8].对此,本研究通过制备不同纯度的麦冬皂苷样品,在一定质量浓度梯度下进行体外溶血实验,探讨麦冬皂苷的溶血作用,拟为保证相关药物的临床应用安全提供依据.
1 材料与仪器
1.1 材 料
1.1.1材料.
实验所用材料包括:麦冬(产地四川,批号,20170621),购自成都荷花池药材批发市场,经检验为百合科沿阶草属植物麦冬的肉质块茎;新西兰大白兔,雄性,体质量2 Kg,普通级,购自成都达硕试验动物有限公司(合格证号,SCXK(川)2013-17).实验中对动物的处理遵循相关动物使用的伦理学原则.
1.1.2试剂.
实验所用试剂包括:鲁斯可皂苷元对照品(批号,151220,纯度≥98%),购自四川维克奇生物科技有限公司;生理盐水(0.9%氯化钠注射液,批号,B15042001),购自四川科伦药业公司;正丁醇(批号,20160121)、高氯酸(批号,20151021)、95%乙醇(批号,20151002),均购自成都科龙化工试剂厂;试剂均为分析纯,水为怡宝纯净水.
1.2 仪 器
实验所用仪器包括:TU-1810型紫外分光光度仪(北京普析通用仪器有限责任公司),FA-2004型电子天平(上海良平仪器仪表有限公司),TD-5型离心机(长沙英泰仪器有限公司),DH-3600A型电热恒温培养箱(西安禾普生物科技有限公司),RE-501型旋转蒸发仪(成都康宇科技有限公司),DZF-6050型真空干燥箱(北京中兴伟业仪器有限公司).
2 方法与结果
2.1 不同纯度麦冬供试品溶液的制备
2.1.1麦冬皂苷A溶液的制备.
取500 g麦冬,加4 000 mL 60 %乙醇,提取3次,每次1.5 h.过滤提取液,80 ℃减压浓缩,醇沉(醇沉浓度为80%),静置24 h,过滤,于80 ℃下,减压浓缩与减压干燥,得麦冬皂苷浸膏A.取适量浸膏A加生理盐水,超声1 min,配制成麦冬皂苷A储备溶液,其皂苷纯度为4.0%.取适量该储备液,加生理盐水分别稀释成质量浓度为0.03、0.06、0.12、0.18、0.24、0.30 mg/mL的溶液作为麦冬皂苷A溶液的供试品溶液.
2.1.2麦冬皂苷B溶液的制备.
取“2.1.1”项下麦冬皂苷浸膏A适量,加纯净水溶解,过AB-8型大孔树脂纯化.然后,用纯净水和70%乙醇分别洗脱,分别接收洗脱液,并于80 ℃下,分别减压浓缩与减压干燥,得麦冬皂苷浸膏B和分离物浸膏.取适量浸膏B加生理盐水,超声1 min,配制成麦冬皂苷B储备液,其皂苷纯度为17.2%.取适量该储备液加生理盐水分别稀释成质量浓度为0.03,0.06,0.12,0.18,0.24,0.30 mg/mL的溶液作为麦冬皂苷B溶液的供试品溶液.同时,分离物浸膏按照与浸膏B纯化时的比例进行稀释配制,作为分离物供试品溶液.
2.1.3麦冬皂苷C溶液的配制.
取“2.1.2”项下麦冬皂苷浸膏B适量,加纯净水超声1 min溶解,加等量水饱和正丁醇萃取4次,收集萃取液和萃余液,于80 ℃下,减压浓缩与减压干燥,得麦冬皂苷浸膏C和萃余液浸膏.取适量浸膏C加生理盐水,超声1 min,配制成麦冬皂苷C储备液,其皂苷纯度为73.8%.取适量该储备液加生理盐水分别稀释成质量浓度为0.03,0.06,0.12,0.18,0.24,0.30 mg/mL的溶液作为麦冬皂苷C溶液的供试品溶液.同时,萃余液浸膏按照与浸膏C萃取时的比例进行稀释配制,作为萃余液供试品溶液.
2.2 2%红细胞混悬液的配制[9]
从家兔耳缘静脉取新鲜血液10 mL,置烧杯中,用缠有少量脱脂棉的玻璃棒轻轻搅拌约10 min,取出血液中的纤维蛋白,制成脱纤血液,加入约10倍量生理盐水,摇匀,3 000 r/min离心10 min,弃去上清液.按此方法重复4~5次,洗至上清液呈无色透明.将所得红细胞用生理盐水配制成压积为2%的红细胞混悬液,置4 ℃冰箱中保存,备用.
2.3 溶血率测定条件选择
2.3.1吸收波长选择.
《中国药典》2015版第四部中规定的溶血率测定方法中仅能定性鉴别药物的溶血性,而不能定量测定药物溶血率的大小.对此,本研究通过筛选,选定利用紫外分光光度法测定体外红细胞的溶血率[10],其最大吸收波长为关键参数,确定步骤为:以生理盐水2 mL中加入兔红细胞混悬液2 mL为阴性对照组,以纯净水2 mL中加入兔红细胞混悬液2 mL为阳性对照组;取“2.1”项下麦冬皂苷A供试品溶液4 mL为样品组.取各组溶液,摇匀,置于(37±0.5)℃保温培养箱中保温3 h,取出于3 000 r/min离心10 min,取上清液至比色皿中.以阴性组为空白,对阳性对照组和样品组于波长200~700 nm进行光谱扫描.结果显示,其最大吸收波长为540 nm,且样品组在该波长下无干扰吸收.故选择540 nm波长为溶血率的测定波长.
2.3.2保温时间选择.
按“2.3.1”项下方法制备阴性和阳性对照组,将“2.1”项下麦冬皂苷A供试品溶液2 mL中加入兔红细胞混悬液2 mL为样品组.取各组溶液轻轻振摇,混合均匀,置于(37±0.5)℃保温培养箱中保温0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h,取出于3 000 r/min离心10 min,取上清液至比色皿中,在540 nm波长下测定吸光度.结果表明,在2.5~4.0 h范围内,红细胞溶血趋于稳定.故选择保温时间为3 h.
2.3.3重复性考察.
按“2.3.1”项下方法制备阴性和阳性对照组,将“2.1”项下麦冬皂苷A供试品溶液2 mL中加入兔红细胞混悬液2 mL为样品组.配制6组,将各组溶液轻轻振摇,混合均匀,置于(37±0.5)℃保温培养箱中保温3.0 h,取出于3 000 r/min离心10 min,取上清液至比色皿中,在540 nm波长下测定吸光度,结果见表1.

表1 吸光度重复性测试
2.3.4溶血率测定.
溶血率的测定采用紫外分光光度法,其步骤为:以生理盐水2 mL中加入兔红细胞混悬液2 mL为阴性对照组,以纯净水2 mL中加入兔红细胞混悬液2 mL为阳性对照组,按“2.1”项下方法制备的供试品按相应要求进行加样配制为样品组.取各组溶液轻轻振摇,混合均匀,置于(37±0.5)℃保温培养箱中保温3 h,取出于3 000 r/min离心10 min,取上清液至比色皿中.以阴性组为空白,采用比色法于波长540 nm下分别测定阳性组的吸光度(A阳)和样品组的吸光度(A样),并按,溶血率=A样/A阳×100%,计算溶血率,同时绘制各样品的溶血率—质量浓度曲线.
2.4 溶血浓度考察
按“2.3”项下方法制备阴性和阳性对照组,将“2.1”项下各麦冬皂苷供试品溶液2 mL中加入兔红细胞混悬液2 mL为样品组.取各组溶液轻轻振摇,混合均匀,置于(37±0.5)℃保温培养箱中保温3.0 h,取出于3 000 r/min离心10 min,取上清液至比色皿中.在540 nm波长下测定吸光度.计算溶血率.结果见图1、表2.
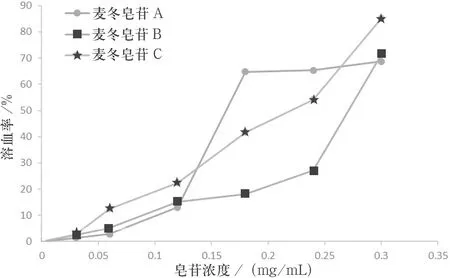
图1麦冬皂苷溶血率—质量浓度曲线
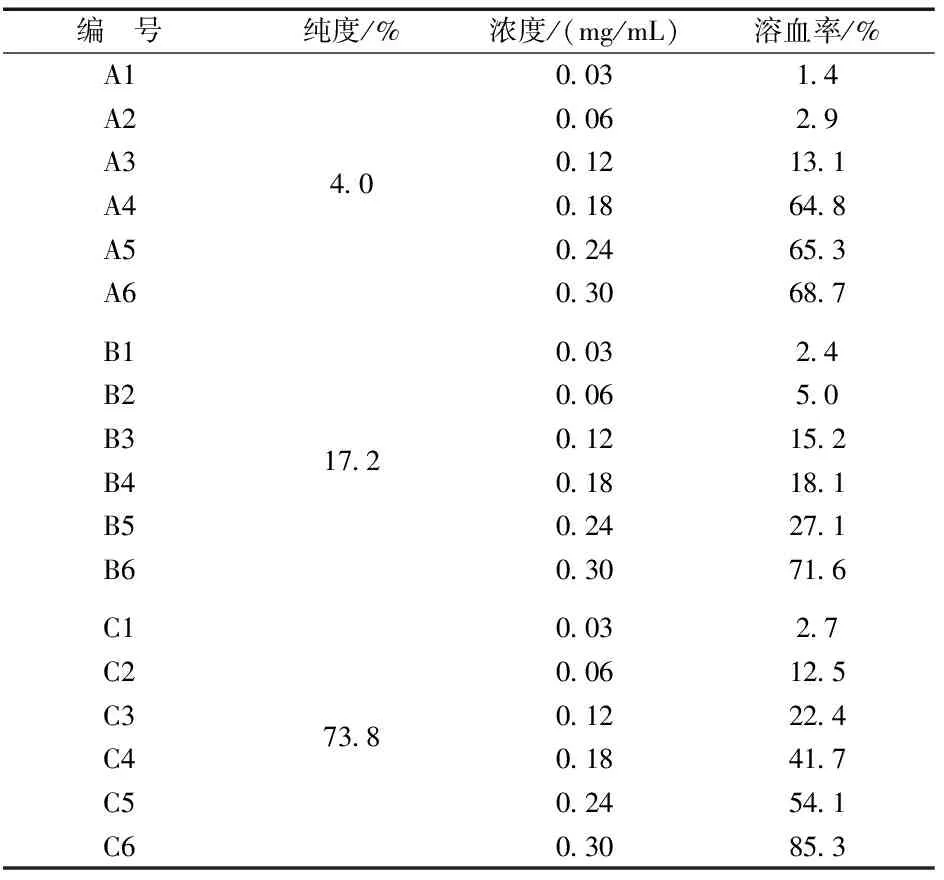
表2 麦冬皂苷溶血浓度
溶血作用的判断方法参考文献[11]中的相关判断依据,即:体外红细胞的溶血率>5%表示有溶血作用;溶血率≤5%表示没有溶血作用.由图1及表1可知:当皂苷纯度为4%时,质量浓度为0.06 mg/mL时,未出现溶血,当质量浓度为0.12 mg/mL时,溶血率上升至13%;当皂苷纯度为17%时,质量浓度为0.06 mg/mL时,未出现溶血,当质量浓度为0.12 mg/mL时,溶血率上升至15%;当麦冬皂苷纯度为73%时,质量浓度为0.03 mg/mL时,未发生溶血,当质量浓度为0.06 mg/mL时,溶血率上升至12.5%.据此可知,麦冬皂苷具有体外溶血作用,且麦冬皂苷纯度越高,其溶血率越大.
2.5 不同纯化方法对皂苷溶血作用的影响
取大孔树脂及萃取纯化后所得到的麦冬皂苷及其相应的“杂质”溶液,按照按表3配制溶液.

表3 溶血还原溶液
将各组溶液轻轻振摇,混合均匀,置于(37±0.5)℃保温培养箱中保温3.0 h,取出于3 000 r/min离心10 min,取上清液至比色皿中.在540 nm波长下测定吸光度,计算溶血率,结果见表4.
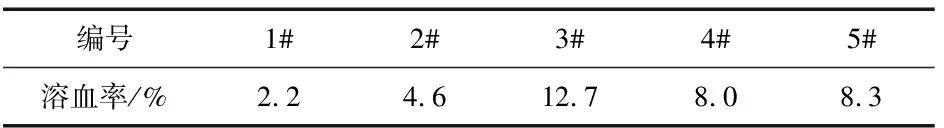
表4 不同纯化方法对皂苷溶血作用的影响
由表4中1#,2#,3#数据得出:大孔树脂纯化后的“杂质”与皂苷B溶液按照纯化前的比例进行混合还原后所得溶液的溶血率比皂苷A和皂苷B溶液的溶血率高,由2#,4#,5#数据得出正丁醇萃取后的萃余液和萃取液混合还原后的溶血率比皂苷B高,但和皂苷C溶液的溶血率大致相同.
3 结果与讨论
3.1 结 果
本研究通过配制不同纯度与不同浓度的麦冬皂苷溶液进行体外溶血研究,采用紫外分光光度法测定溶血率.实验结果表明,麦冬皂苷具有体外溶血作用,其溶血率随皂苷浓度升高而增大,且麦冬皂苷纯度越高,其溶血率越大.对不同纯化方式所得到的“杂质”与皂苷类成分按比例混合“还原”后的溶血实验表明,采用正丁醇萃取的纯化方式还原后,萃取前后的溶血作用基本不变,而采用大孔树脂纯化后的两部分物质混合“还原”后溶血作用高于纯化前的溶血作用.
3.2 讨 论
中药具有成分复杂与作用机理尚不明确的特点,随着中药注射液临床应用越来越多,其安全性研究有待加强.目前,在中药注射液的制法中,科研人员经常将主要药用成分进行分离纯化,以减小药物副作用和达到更好的药用疗效.本研究表明,麦冬皂苷纯度越高,其相同浓度皂苷的溶血率越大.因此,在配制含有皂苷类成分的注射液时皂苷类成分是否越纯越好,纯度越高是否疗效越好,这是在中成药工艺研究过程中设计含皂苷类成分的药材纯化工艺时应重点考虑的问题.此外,据文献报道,大孔树脂的吸附纯化为物理吸附,对药物的化学结构不会造成影响[12-13].而本实验中通过大孔树脂纯化麦冬皂苷,得到的“杂质”与皂苷类成分按比例混合“还原”后,其溶血作用发生了较大的改变,而通过正丁醇萃取纯化麦冬皂苷,得到的“杂质”与皂苷类成分按比例混合“还原”后,其溶血作用未发生明显的变化,其原因有待进一步研究.
