小麦分离蛋白质理化性质及功能特性研究
2018-07-10温青玉张康逸康志敏高玲玲
温青玉,张康逸*,杨 帆,盛 威,康志敏,高玲玲
(1.小麦和玉米深加工国家工程实验室,河南 郑州 450001;2.河南省农业科学院 农副产品加工研究中心,河南 郑州 450002)
小麦蛋白质是新型植物蛋白质资源,其能量和营养价值明显优于大多数植物蛋白质,是优质价廉的天然氮源[1]。我国小麦资源丰富,2016—2017年产量约12 889万t,居世界前列。目前,小麦的加工研究主要集中于面粉的开发利用及面制品品质的改良方面[2-4],对小麦分离蛋白质功能特性的研究还鲜有报道。为此,以中筋小麦为原料,分离蛋白质,对蛋白质的成分、氨基酸组成及功能特性进行分析,研究蛋白质的溶解度、持油性、起泡性及泡沫稳定性、乳化性及乳化稳定性,为小麦分离蛋白质下一步的开发提供基础数据和理论支撑。
1 材料和方法
1.1 试验材料
中筋小麦品种为百农201。大豆色拉油从市场购买,石油醚(30~60 ℃)、浓硫酸、浓盐酸(体积分数36%~38%)、无水乙醇、硼酸、甲基红指示剂、溴甲酚绿指示剂、氢氧化钠、无水亚硫酸钠、氯化钠、磷酸二氢钾、十二烷基硫酸钠等均为分析纯。
试验仪器:DHG-9240A鼓风干燥箱购自上海精宏实验设备有限公司,SOX500脂肪测定仪购自山东海能科学仪器有限公司,TC-4-10陶瓷纤维炉购自北京中兴伟业仪器有限公司,JW1042低速离心机购自安徽嘉文仪器装备有限公司,K110全自动凯氏定氮仪购自山东海能科学仪器有限公司,A300全自动氨基酸分析仪购自德国曼默博尔公司。
1.2 样品脱脂处理
参照Macritchie等[5]的方法,略有改动。青麦仁冷冻干燥后,用多功能粉碎机粉碎成粉末,过孔径0.25 mm筛。
称取一定量小麦粉和氯仿在室温下按照1∶2混合,电子搅拌器搅拌5 min,用布氏漏斗抽滤悬浮液,残余小麦粉重复此程序3次。脱脂小麦粉于室温通风橱中晾干至无氯仿气味。
1.3 小麦分离蛋白质的制备
参考Hettiarachchy等[6]方法,略有改动。取脱脂后的100 g小麦粉与0.5 mol/L 氯化钠溶液按1∶0的比例混合,室温搅拌1 h,待粉末充分润湿后用1 mol/L氢氧化钠溶液调pH值至9,继续搅拌30 min并保持溶液pH值不变。而后在4 000 r/min转速下离心30 min,收集上清液,对残渣进行再次提取后与第一次收集的上清液合并,余下残渣弃去。上清液用1.0 mol/L 盐酸调pH值至蛋白质的等电点,室温搅拌30 min,静置20 min,在4 000 r/min转速下离心30 min,弃去上清液,收集沉淀,冷冻干燥后得到分离蛋白质。
1.4 测定项目及方法
1.4.1小麦基本成分蛋白质含量的测定方法参照GB/T 5009.5—2016;淀粉含量的测定方法参照 GB/T 5009.9—2016;脂肪含量的测定方法参照GB/T 5009.6—2016;膳食纤维含量的测定方法参照GB/T 5009.88—2014;灰分含量的测定方法参照GB/T 5009.4—2016。
1.4.2小麦分离蛋白质的纯度以脱脂后的小麦粉为原料,利用等电点离心沉淀法制备分离蛋白质,通过蛋白质纯度计算公式进行计算。计算公式如下:

(1)
式中:m为得到的蛋白质的质量(g),ω1为得到的蛋白质中蛋白质含量(%),M为提取蛋白质消耗的小麦粉质量(g),ω2为提取蛋白质消耗的小麦粉中蛋白质含量(%)。
1.4.3小麦分离蛋白质的组成成分根据Osborne[7]的分类法,小麦中所含的蛋白质可分为清蛋白、球蛋白、麦醇溶蛋白及麦谷蛋白。
清蛋白含量的测定:称取1 g小麦蛋白质置于烧杯中,加入20 mL蒸馏水搅拌均匀,45 ℃搅拌2 h,在4 000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶中定容,然后用凯氏定氮法分析蛋白质含量。沉淀用蒸馏水洗涤后作为后续试验的原料。
球蛋白含量的测定:向清蛋白提取后的沉淀中加入10 mL 5%亚硫酸钠溶液,45 ℃搅拌1.5 h,在4 000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶中定容,然后用凯氏定氮法分析蛋白质含量。沉淀用蒸馏水洗涤后作为后续试验的原料。
麦醇溶蛋白含量的测定:在球蛋白提取后的沉淀中加入8 mL 70%乙醇溶液,50 ℃搅拌20 min,在4 000 r/min条件下离心20 min,残渣进行再次提取,合并2次离心获得的上清液,于25 mL容量瓶中定容,然后用凯氏定氮法分析蛋白质含量。沉淀用蒸馏水洗涤后作为后续试验的原料。
麦谷蛋白含量的测定:向麦醇溶蛋白提取后的沉淀中加入8 mL 0.04% 氢氧化钠溶液,50 ℃搅拌1.5 h,在4 000 r/min条件下离心20 min,收集上清液,于25 mL容量瓶中定容,然后用凯氏定氮法分析蛋白质含量。
1.4.4小麦分离蛋白质的氨基酸组成及含量准确称取一定质量的样品(100 mg)置安瓿瓶中并加入盐酸(6 mol/L)10 mL,用氮吹仪吹氮5 min左右。用手持式喷灯封口,确认密封后置110 ℃烘箱中水解24 h。冷却至室温后开封,将水解液转移至50 mL烧杯中,用超纯水冲洗水解管3次,氢氧化锂调节滤液至pH值为2.2后转移至50 mL容量瓶中,用超纯水冲洗烧杯3次,合并滤液,用超纯水定容至50 mL。取容量瓶中溶液样品,用超纯水按1∶稀释,用0.22 μm有机滤膜过滤,置于A300全自动氨基酸分析仪自动进样器上进样分析。
1.4.5小麦分离蛋白质等电点参考郭娜等[8]的方法,准确称取青麦仁分离蛋白质9份,用去离子水配制10 g/L蛋白质溶液20 mL,用1.0 mol/L 盐酸和氢氧化钠调溶液pH值分别为4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8,然后磁力搅拌1 h,4 000 r/min转速下离心20 min,称沉淀质量,以pH值为横坐标、沉淀质量为纵坐标,绘出沉淀质量—pH值的关系图。沉淀质量最大的pH值即为蛋白质的等电点。
1.4.6小麦分离蛋白质溶解度参考朴金苗等[9]测定方法,将1~2 g小麦分离蛋白质溶于100 mL蒸馏水中,而后用0.5 mol/L氢氧化钠溶液和0.5 mol/L盐酸分别调节pH值至2、3、4、5、6、7、8、9、10,室温振荡1 h,4 000 r/min离心20 min,取上清液,用凯氏定氮法测定上清液中氮含量。溶解度表示为上清液中氮含量与样品中总氮含量的百分比。
1.4.7小麦分离蛋白质持水性、持油性参考孙媛[10]的测定方法,称取0.25 g小麦分离蛋白质于离心管中,加入25 mL蒸馏水或大豆色拉油,充分振荡、混匀后,置于恒温培养振荡器中,于40 ℃、120 r/min振荡30 min。然后在4 000 r/min条件下离心15 min,倒掉上层未吸附的水或大豆色拉油,称质量,计算蛋白质样品的持水性(持油性) 。用大豆蛋白质做对照试验。

(2)
式中:W0为蛋白质样品的质量(g),W1为离心管加样品的总质量(g),W2为离心后离心管加沉淀的总质量(g)。
1.4.8小麦分离蛋白质起泡性与泡沫稳定性参考李涛[11]的方法,用小麦分离蛋白质配制一定质量浓度的蛋白质溶液100 mL,用迷你辅食料理机搅打1 min后马上倒入250 mL量筒中,读取泡沫体积V0后计算起泡性,静置60 min后读取体积V60后计算泡沫稳定性。

(3)

(4)
蛋白质溶液浓度对蛋白质起泡性及泡沫稳定性的影响:用pH值为7的磷酸盐缓冲液配制质量浓度分别为2、4、6、8、10、12、14 g/L的蛋白质溶液,测定蛋白质起泡性及泡沫稳定性。pH值对蛋白质起泡性及泡沫稳定性的影响:将质量浓度为2 g/L的蛋白质溶液分别调节pH值至2、4、6、8、10、12,测定蛋白质起泡性及泡沫稳定性。
1.4.9小麦分离蛋白质乳化性与乳化稳定性参考Pearce等[12]的方法,用青麦仁分离蛋白质配制一定质量浓度的蛋白质溶液20 mL,与25 mL食用油在迷你辅食料理机中乳化1 min。制备好的乳化液迅速倒入小烧杯中,立即从烧杯底部取100 μL乳化液于试管中,加入 4.9 mL 1 g/L SDS稀释,混匀后测量500 nm 处的吸光值(A0)。静置 10 min重新取样测定吸光值(A10)。
乳化性=A0
(5)

(6)
蛋白质溶液质量浓度对蛋白质乳化性及乳化稳定性的影响:用pH值为7的磷酸盐缓冲液配制质量浓度分别为2、4、6、8、10、12 g/L的蛋白质溶液,测定蛋白质乳化性及乳化稳定性。pH值对蛋白质乳化性及乳化稳定性的影响:将质量浓度为2 g/L的蛋白质溶液分别调节pH值至2、4、6、8、10、12,然后测定蛋白质乳化性及乳化稳定性。
1.5 数据处理
所得试验数据均为3次重复的平均值,试验数据采用Origin 8.0进行处理绘图。
2 结果与分析
2.1 小麦及分离蛋白质的组成分析
对小麦的基本成分进行分析发现,小麦总蛋白质含量为11.70%,淀粉含量为59.25%,脂肪含量为1.43%,膳食纤维含量为11.24%,灰分含量为1.48%,其他(水、微量物质、矿物质等)含量为14.90%。
经分析发现,小麦分离蛋白质纯度为83.24%,其中,清蛋白含量为60.27%,球蛋白含量为3.68%,麦醇溶蛋白含量为2.91%,麦谷蛋白含量为3.05%,其他蛋白质占30.09%。
2.2 小麦分离蛋白质的氨基酸组成及含量分析
由表1可知,小麦分离蛋白质中氨基酸含量丰富,种类齐全,其中,谷氨酸含量最高,占总氨基酸的39.82%。谷氨酸不仅属于鲜味氨基酸,在医学上谷氨酸还用于治疗肝性昏迷,改善儿童智力发育。小麦分离蛋白质中亮氨酸含量也较高,其是支链氨基酸,与异亮氨酸和缬氨酸一起合作修复肌肉,控制血糖,并给身体组织提供能量。小麦分离蛋白质中必需氨基酸占总氨基酸的比例为29.06%。
根据FAO(联合国粮食组织)/WHO(世界卫生组织)计分模式[13],小麦分离蛋白质氨基酸评分详见表2。由氨基酸评分可知,小麦分离蛋白质中第一限制性氨基酸为蛋氨酸和半胱氨酸,第二限制性氨基酸为赖氨酸,苯丙氨酸、酪氨酸和亮氨酸含量较高。将鸡蛋蛋白质中各种氨基酸含量作为评分依据,小麦分离蛋白质氨基酸化学评分详见表2。由化学评分可知,小麦分离蛋白质中第一限制性氨基酸仍为蛋氨酸和半胱氨酸,第二限制性氨基酸仍为赖氨酸。

表1 小麦分离蛋白质的氨基酸组成和含量

表2 小麦分离蛋白质中必需氨基酸含量及评分
2.3 小麦分离蛋白质等电点分析
由图1可知,小麦分离蛋白质在pH值为5.0时的沉淀质量最大,可以判定小麦分离蛋白质的等电点为5.0。蛋白质是两性物质,在等电点时,蛋白质分子静电荷为0,消除了分子间的静电斥力,此时蛋白质间静电排斥作用最低,蛋白质聚集、沉淀。因此,常选取等电点pH值来进行蛋白质沉淀纯化[14]。
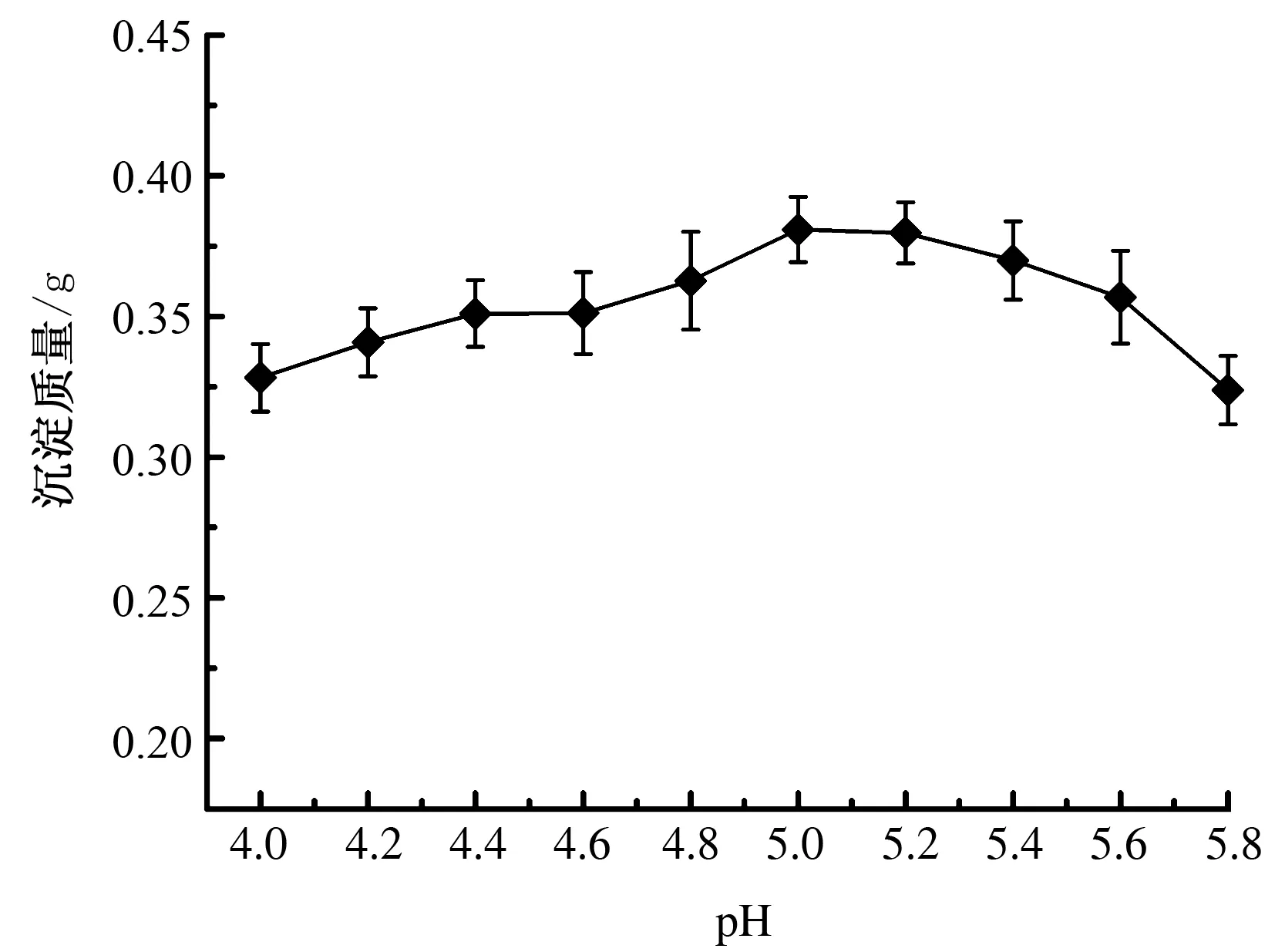
图1 小麦分离蛋白质的等电点
2.4 小麦分离蛋白质的溶解度分析
由图2可知,小麦分离蛋白质溶解度随着pH值的增加先降低后增加,在pH值为6时最低。这是因为在等电点附近,蛋白质所带的正电荷与负电荷平衡,这样就降低了蛋白质分子间的静电排斥力,从而使蛋白质发生凝聚而沉淀;在非等电点的区域内,蛋白质之间的静电斥力较大,促进了蛋白质的解离,从而使蛋白质的溶解性升高,当pH值小于2或者大于9时,大部分蛋白质处于溶解状态。
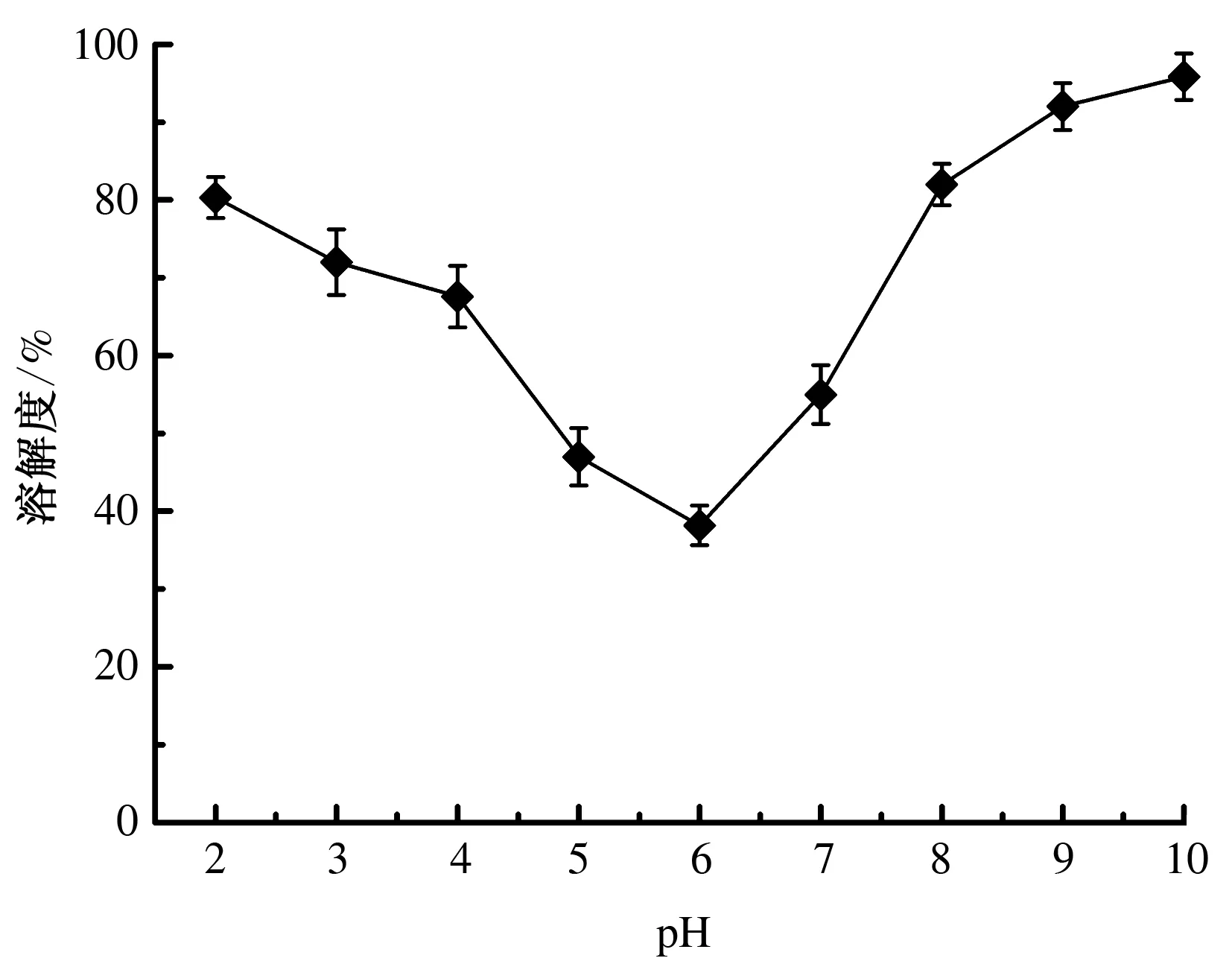
图2 小麦分离蛋白质在不同pH值下的溶解度
2.5 小麦分离蛋白质的功能特性
2.5.1小麦分离蛋白质的持水性和持油性蛋白质的持水性是指蛋白质与水分子的结合能力,在蛋白质食品的加工过程中起着非常重要的作用。持油性是指蛋白质结合游离脂肪酸的能力,蛋白质持油性高,能够提高食品对脂肪的吸收和保留能力,减少脂肪在加工过程中的损失,进而改善食品风味。由表3可知,小麦和大豆分离蛋白质的持水性分别为4.26 g/g和5.95 g/g,持油性分别为5.98 g/g和2.11 g/g;与大豆分离蛋白质相比,小麦蛋白质持油性较好,持水性稍差,可将其应用到肉制品、烘焙制品、油炸食品等的生产中。

表3 小麦分离蛋白质的持水性和持油性 g/g
2.5.2小麦分离蛋白质的起泡性与泡沫稳定性
2.5.2.1起泡性起泡性是蛋糕、面包、冰淇淋等食品加工过程中非常重要的质量控制指标。由图3可知,小麦分离蛋白质的起泡性随蛋白质质量浓度的增大而增加,当小麦分离蛋白质质量浓度达到8 g/L时,蛋白质的起泡性较大;之后随蛋白质质量浓度的增大变化较小。这是由于蛋白质质量浓度增大,溶解的蛋白质增多,蛋白质发泡力呈现增加的趋势,起泡性也就随之增强。不同pH值对蛋白质起泡性的影响如图4表示,随pH值增大,小麦分离蛋白质的起泡性先减小后增大,pH值为6时起泡性最小。这是因为蛋白质的起泡性与其溶解度有关,蛋白质溶解度在pH值为6时最小,可溶性蛋白质最少,所以起泡性最小。
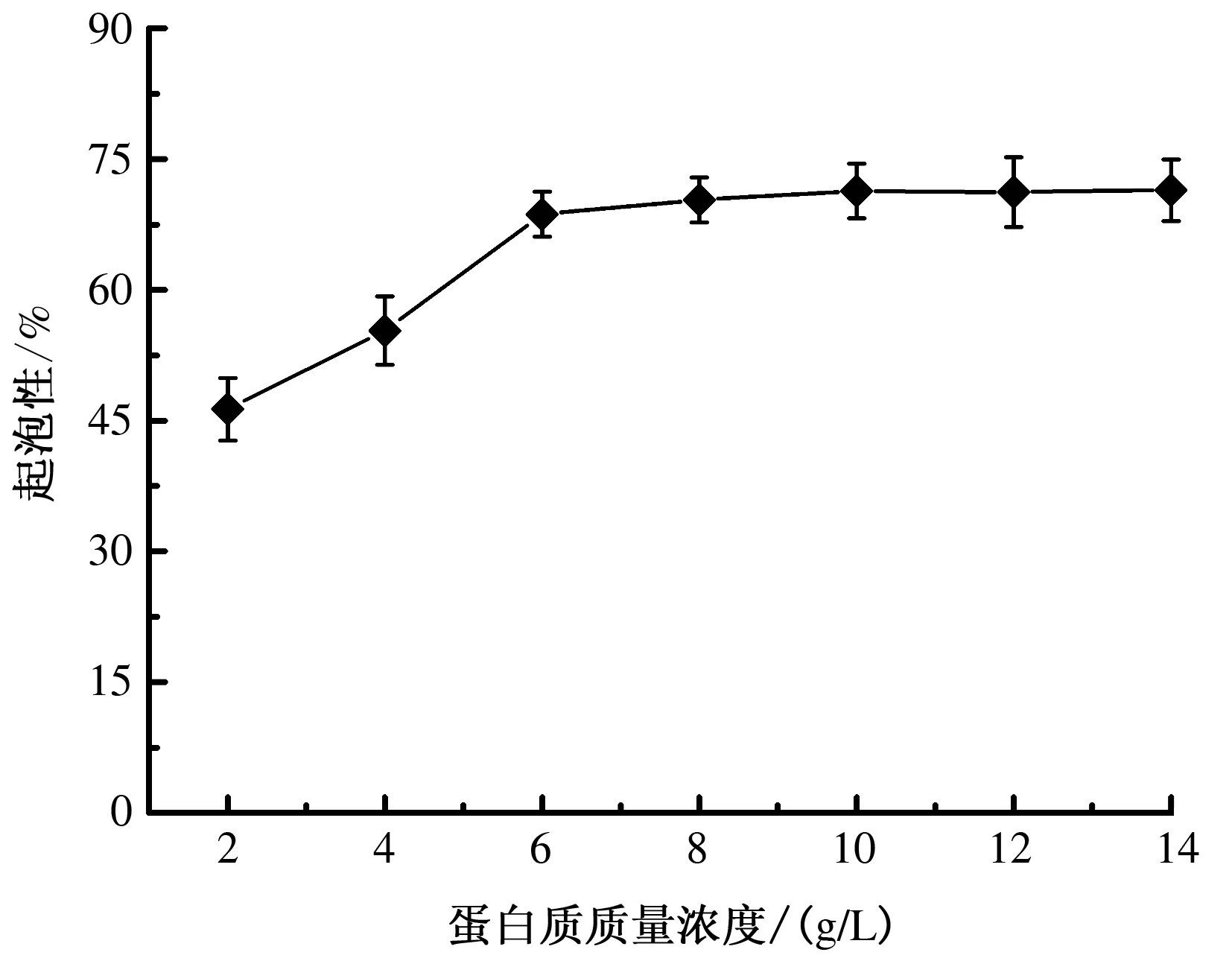
图3 不同质量浓度蛋白质溶液对蛋白质起泡性的影响

图4 不同pH值对蛋白质起泡性的影响
2.5.2.2泡沫稳定性泡沫稳定性是蛋白质产生的泡沫在一定时间内维持稳定的能力。由图5可知,随蛋白质质量浓度增加,泡沫稳定性增强,当小麦分离蛋白质质量浓度达到8 g/L时,泡沫稳定性较强;之后随蛋白质质量浓度的增大变化较小。不同pH值下蛋白质的泡沫稳定性如图6所示,随pH值增大,蛋白质的泡沫稳定性先降低后增大,在pH值大于6时,蛋白质的泡沫稳定性比较高;之后随蛋白质质量浓度的增大变化较小。这与pH值为6时蛋白质溶解度最小有关,不溶性蛋白质越多,蛋白质维持泡沫稳定的能力越小。

图5 不同质量浓度蛋白质溶液对蛋白质泡沫稳定性的影响

图6 不同pH值对蛋白质泡沫稳定性的影响
2.5.3小麦分离蛋白质的乳化性与乳化稳定性
2.5.3.1乳化性蛋白质的乳化性是指蛋白质能使油与水形成稳定的乳化液的能力。由图7可知,小麦分离蛋白质的乳化性随蛋白质质量浓度增加而增加,当小麦分离蛋白质质量浓度达到10 g/L时,蛋白质的乳化性较强;之后随蛋白质质量浓度的增大变化较小。这是因为蛋白质质量浓度增大会使油水乳化体系界面膜的厚度增大,膜的强度也因此提高,乳化性也就越来越大。pH值对蛋白质乳化性的影响如图8所示,小麦分离蛋白质的乳化性在pH值为6时最差,在pH值12时最大,说明碱性条件下蛋白质的乳化性较好。这与蛋白质的溶解性有密切关系,许多蛋白质均有“等电点附近乳化性差,偏离等电点乳化性增强”的规律,不溶性的蛋白质对乳化作用的贡献很小。

图7 不同质量浓度蛋白质溶液对蛋白质乳化性的影响

图8 不同pH值对蛋白质乳化性的影响
2.5.3.2乳化稳定性乳化稳定性是指乳化液保持明显稳定状态并且不产生两相分层不稳定现象的特性。由图9可知,随着蛋白质质量浓度增大,小麦分离蛋白质的乳化稳定性增强,当小麦分离蛋白质质量浓度达到8 g/L时,蛋白质的乳化稳定性较强;之后随蛋白质质量浓度的增大变化较小。这说明在一定范围内,蛋白质质量浓度越大,蛋白质的乳化稳定性就越大。pH值对蛋白质乳化稳定性的影响如图10所示,小麦分离蛋白质的乳化稳定性在pH值为6时最差,pH值低于6时,蛋白质的乳化稳定性随pH值的增加而减少;pH值高于6时,蛋白质的乳化稳定性随pH值的增加而增加。这是因为pH值首先影响了蛋白质的溶解性,而溶解的蛋白质的乳化性质又依赖于乳化液中的亲油-亲水基的动态平衡[15-16]。
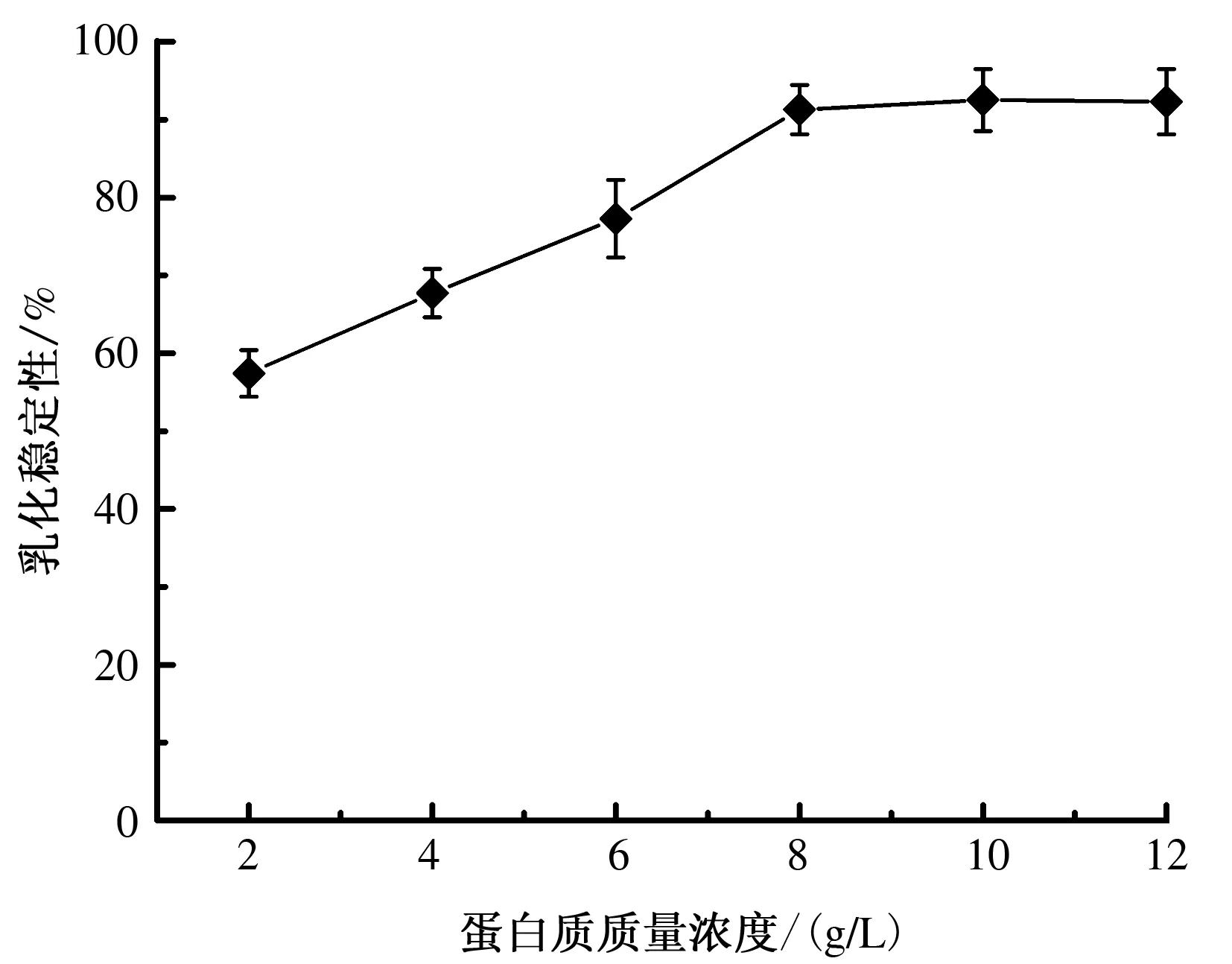
图9 不同质量浓度蛋白质溶液对蛋白质乳化稳定性的影响

图10 不同pH值对蛋白质乳化稳定性的影响
3 结论
小麦分离蛋白质富含赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸、色氨酸等8种必需氨基酸,其中谷氨酸含量最高,高达39.82%,可以作为营养强化剂加以应用。小麦分离蛋白质与大豆分离蛋白质相比,持油性较好,持水性稍差,持水性和持油性分别为4.26 g/g和 5.98 g/g。在蛋白质质量浓度为8 g/L及以上时,分离蛋白质拥有良好的起泡性和泡沫稳定性,可以将其起泡性应用在蛋糕、蛋奶酥、啤酒泡沫、面包等食品加工中,改善产品的品质。小麦分离蛋白质在质量浓度为8 g/L及以上时,拥有很好的乳化性及乳化稳定性,可以改善面制品的品质及面筋网络质构。综合分析,小麦分离蛋白质是一种优良的植物蛋白质资源,和其他谷物混合食用可以起到互补作用,提高营养价值,具有广阔的应用前景。
