马铃薯M病毒微滴数字PCR检测方法的建立
2018-07-10黄洁芳燕照玲张永江
刘 晗,黄洁芳,向 均,燕照玲,张永江*
(1.中国检验检疫科学研究院,北京 100176; 2.吴江出入境检验检疫局,江苏 吴江 215200;3.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002)
马铃薯M病毒(Potato virus M, PVM)是乙型线形病毒科(Betaflexviridae)香石竹潜隐病毒属(Carlavirus)的成员,为正单链RNA病毒[1]。PVM主要侵染茄科植物,是马铃薯上最常见的病毒之一,极易通过块茎传递给后代,导致马铃薯出现叶片斑驳、花叶、卷叶以及植株发育迟缓等症状[2],造成10%~18%的产量损失;与其他马铃薯病毒共同侵染时,可导致马铃薯减产20%~30%[3]。快速准确的检测PVM对马铃薯病毒病的防控具有重要的意义[4],目前用于PVM检测的方法主要有生物学测定、血清学测定、显微镜观察、核酸杂交及PCR技术等[5-8]。生物学以及血清学方法的检测灵敏度相对较低,耗时长且工作量大[2,9-10];显微镜观察需要使用电镜,而电镜的成本太高从而阻碍了该技术的应用[11-12];目前使用较多的技术是核酸杂交及PCR技术,提高PCR技术的灵敏度对于马铃薯病毒检测具有重要意义[13-14]。
微滴数字PCR(Droplet digital PCR, ddPCR)是一种新的高精准核酸绝对定量检测技术[15]。其工作原理是在传统PCR扩增体系的基础上,将一个大的扩增体系分割为多个微滴,不同模板分隔在不同油包水的微滴中,且每个微滴都作为一个独立的PCR体系。PCR反应结束后,用微滴分析仪检测每个微滴的荧光信号,出现荧光信号的微滴记录为1,未检测到荧光信号的微滴则记录为0。根据泊松分布的原理以及出现荧光信号的微滴个数与比例,即可得出靶分子的起始浓度,从而实现靶分子的绝对定量。ddPCR目前已应用于转基因、地沟油及病原微生物等的检测[16-20],但在植物病毒检测方面的应用还很少。本研究将该技术用于PVM的检测,建立了PVM的高精准ddPCR检测方法,为我国马铃薯病毒提供更加灵敏的检测技术。
1 材料和方法
1.1 材料
PVM侵染的马铃薯叶片、马铃薯X病毒(Potato virus X,PVX)侵染的烟草叶片、马铃薯Y病毒(Potato virus Y,PVY)侵染的烟草叶片、烟草花叶病毒(Tobacco mosaic virus,TMV)侵染的烟草叶片和黄瓜花叶病毒(Cucumber mosaic virus,CMV)侵染的黄瓜叶片样品均由中国检验检疫科学研究院保存。
所用主要试剂包括:植物总RNA提取试剂盒(离心柱型,DP432,TIANGEN)、逆转录试剂盒PrimeScriptTM(Perfect Real Time,RR037A,Takara)、一步法RT-PCR试剂盒(PrimeScriptTM,RR055A,Takara)、一步法实时荧光RT-PCR试剂盒(Perfect Real Time,RR064A,Takara)和数字PCR Master Mix(Bio-Rad)。
主要试验仪器包括:实时荧光PCR仪(Roche LightCycler 480Ⅱ)、Bio-Rad数字PCR反应系统(Bio-Rad QX200)、PCR仪(ABI Veriti96)。
1.2 引物和探针
根据NCBI上PVM 外壳蛋白(CP)基因序列(登录号:NC_001361.2),设计引物、探针(表1),在NCBI上比对验证后送往Invitrogen公司合成。

表1 PVM检测引物及探针序列
1.3 试验方法
1.3.1样品总RNA提取按照植物总RNA提取试剂盒说明书提取PVM、PVX、PVY、TMV、CMV阳性材料及阴性对照(健康叶片)的总RNA,-80 ℃保存备用。
1.3.2PVM样品的RT-PCR检测以田间采集的感病马铃薯叶片样品提取的总RNA作为模板,用一步法RT-PCR试剂盒进行PVM的检测。设置空白对照(BC),以RNase Free dH2O作为模板。检测体系为:Enzyme mix 2 μL,Buffer 25 μL,PVM-F(10 μmol/L)2 μL,PVM-R(10 μmol/L) 2 μL,模板2 μL,以RNase Free H2O补齐至50 μL。
反应程序为:50 ℃ 30 min;95 ℃ 5 min;95 ℃ 30 s,54 ℃ 45 s,72 ℃ 45 s,35 个循环;72 ℃ 10 min。
RT-PCR扩增结束后,取5 μL扩增产物与1 μL 6×溴酚蓝上样缓冲液混匀,点入1.5%的琼脂糖凝胶样孔内;以5 μL DNA Marker(DL2000)作为分子质量标准;用1×TAE缓冲液在100 V电压下电泳30 min。电泳结束后,将整个凝胶置于凝胶成像系统上拍照记录结果。
1.3.3实时荧光RT-PCR检测使用一步法实时荧光RT-PCR试剂盒进行试验,反应体系为:2×One Step RT-PCR Buffer 10 μL,TaKaRa ExTaqHS 0.4 μL,PrimeScript RT Enzyme Mix 0.4 μL,PVM-dF(10 μmol/L)0.8 μL,PVM-dR(10 μmol/L)0.8 μL,PVM-dP(10 μmol/L)0.4 μL,模板1 μL,加RNase Free dH2O补齐至20 μL。设置阴性对照(NC)和空白对照(BC),分别以健康马铃薯叶片提取的总RNA和RNase Free dH2O作为模板。反应条件为:42 ℃ 5 min; 95 ℃ 5 s;95 ℃ 5 s,58 ℃ 20 s,40个循环。
将加入反应体系的PCR管放置于实时荧光PCR仪中按反应条件进行反应,仪器收集荧光信号;反应结束后由实时荧光PCR仪自带软件对荧光信号进行结果分析并绘制扩增曲线;根据不同引物探针组检测PVM时是否产生扩增曲线来判断扩增效果的优劣。
1.3.4ddPCR检测(1)逆转录:按照逆转录试剂盒操作说明书,用PVM-dR将样品RNA逆转录成cDNA,阴性对照(NC)和空白对照(BC)分别以健康马铃薯叶片提取的总RNA和RNase Free dH2O作为模板。
(2)体系配制:总体积为20 μL,包括:2×SuperMix 10 μL,PVM-dF及PVM-dR(浓度均为10 μmol/L)各0.8 μL,探针PVM-dP(10 μmol/L)0.4 μL,cDNA模板 2 μL,加入超纯水补齐至20 μL。
(3)微滴生成:将配制完的体系转移至微滴生
成卡的体系加样孔中,并在反应用油加样孔中加入70 μL的ddPCR反应用油;加样完成后,将微滴生成卡转移至微滴生成器中,启动仪器生产微滴;微滴生成结束后,将微滴体系转移至96孔板中,封膜。
(4)扩增:将96孔板置于PCR仪中,PCR扩增程序为:50 ℃ 5 min;95 ℃ 5 min;95 ℃ 15 s,58 ℃ 60 s,40个循环。
(5)数据读取:扩增结束后,将96孔板取出,置于微滴读取仪中读取微滴数;通过FAM单通道荧光收集单个微滴荧光信号,荧光采集后,通过分析热点图确定荧光阈值限以判断阴性微滴和阳性微滴;根据是否产生阳性微滴,判断检测特异性与灵敏度。
2 结果与分析
2.1 PVM样品的RT-PCR检测
采集田间的马铃薯叶片样品进行PVM特异性RT-PCR检测,结果如图1所示,可以扩增到416 bp大小的条带,与预期目的条带大小一致。将测序结果在NCBI中进行比对,与已登录PVM序列同源性最高达99%,进一步证实了特异性扩增的结果。经验证的样品用于后续ddPCR方法的建立。

M:DL2000 Marker; 1、2:PVM样品; 3:BC
2.2 引物和探针筛选
以实时荧光RT-PCR对设计的3组引物探针进行筛选,每组引物探针设置2个重复,结果如图2。

1:引物探针组G1; 2:引物探针组G2; 3:引物探针组G3; 4:BC
引物探针组G1的扩增效率最高,扩增曲线出现最早,G2次之,G3基本没有扩增。因此,选用G1组引物探针进行后续试验。
2.3 ddPCR特异性分析
以5种可侵染马铃薯的病毒 (PVM、PVX、PVY、TMV、CMV)的总RNA为模板,对设计的ddPCR探针引物进行特异性验证,结果如图3所示。阳性微滴信号(阈值线以上)与阴性微滴信号(阈值线以下)区分明显;只有PVM能够产生阳性微滴信号,其他4种病毒、阴性及空白对照无阳性微滴信号产生,与预期结果相符。以同一套引物探针对上述5种病毒及2种对照进行实时荧光RT-PCR检测,结果如图4所示,只有PVM出现扩增曲线,其他样品均无扩增曲线产生。ddPCR方法的结果与实时荧光RT-PCR结果一致,表明所建立的ddPCR方法特异性良好。

A09、B09: PVM; C09、D09: PVX; E09、F09: PVY; G09、H09: TMV; A08、B08: CMV; C08:NC; D08: BC
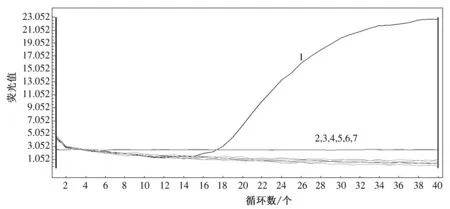
1: PVM; 2: PVX; 3: PVY; 4: TMV; 5: CMV; 6: NC; 7: BC
2.4 ddPCR灵敏度分析
将PVM的总RNA(质量浓度为57 ng/μL)进行10倍梯度稀释后用作模板,进行ddPCR方法灵敏度分析,结果如图5所示。在107倍稀释时,仍可检测到阳性微滴信号,其检测阈值为5.7 fg/μL。而在实时荧光RT-PCR检测中,能获得荧光信号的模板最大稀释倍数为105(图6)。表明前者灵敏度比后者高100倍。

A02、B02:105倍稀释;C02、D02:106倍稀释;E02、F02:107倍稀释;G02、H02:108倍稀释;C03:NC; D03:BC

1—6:分别为102~107倍梯度稀释;7:NC;8:BC
3 结论与讨论
随着马铃薯加工业的不断发展,市场上对马铃薯的需求持续增长,马铃薯的经济重要性日渐突出,但病毒的侵染导致马铃薯产量及质量的下降严重影响了马铃薯产业的发展[21]。目前已经报道的马铃薯病毒种类高达30余种,且通常混合侵染寄主,尤其是PVM,常与其他病毒混合侵染马铃薯,从而导致更大的损失[22]。因此,建立能够有效区分马铃薯上多种病毒的特异性检测方法至关重要。本研究通过设置均能侵染马铃薯的5种病毒、阴性对照及空白对照,对建立的ddPCR方法进行特异性分析,并通过实时荧光RT-PCR方法对分析结果进行验证,两者结果一致,仅在携带PVM的样品中检测到信号,而其他反应体系均未检测到信号。说明建立的ddPCR方法具有良好的特异性。
ddPCR技术将反应体系缩小,通过对每个微滴进行检测,大大提高了检测的灵敏度。在本研究中,对同一PVM样品的分析结果显示,ddPCR比实时荧光RT-PCR检测灵敏度高100倍,与ddPCR能够提高检测灵敏度的相关报道一致[23]。同时,ddPCR检测PVM的试验过程中无需构建标准曲线,从而大大缩短了试验周期。另外,实时荧光RT-PCR只能实现样品的相对定量,而ddPCR能够实现样品的绝对定量[17,24-25]。从这3个方面来看,ddPCR检测PVM比实时荧光RT-PCR具有更大的优势。
我国已在黑龙江、四川、河南、云南以及青海地区的马铃薯上检测到PVM,不同地区PVM的序列存在差异[26]。本研究根据已经报道的PVM外壳蛋白基因保守核苷酸序列设计用于检测的引物、探针,并在NCBI中进行了保守性比对验证,从而大大降低了由于不同PVM分离物序列差异造成的假阴性结果出现的可能性,能够有效提高检测的准确性。为了增加方法的实用性,本研究直接采用田间的马铃薯叶片为样本来建立ddPCR检测方法,试验结果显示,建立的ddPCR方法可特异灵敏地检测田间样品中的PVM,表明建立的方法具有较强的实用性,为马铃薯生产中PVM的防治奠定了基础,同时也为马铃薯及其产品的进出口检疫提供更为灵敏的检测技术。
