姜黄素修饰透明质酸的自组装特性及其对Aβ40聚集的抑制作用:透明质酸相对分子质量的影响
2018-07-09董晓燕林进忠蒋志强
董晓燕,林进忠,蒋志强
(天津大学化工学院,天津 300354)
阿尔兹海默症(Alzheimer’s disease,AD)是一种 常见的神经退行性疾病.其病理特征是大脑萎缩、脑组织内出现淀粉样斑块、脑血管沉淀物和神经元纤维缠结[1-2],而脑组织中细胞外的斑块主要由淀粉样 β蛋白(amyloid β-peptide,Aβ)沉淀形成[3].目前研究认为,Aβ的聚集和沉积是导致 AD 的主要原因[4].因此,开发有效的 Aβ聚集抑制剂,是当前防治 AD的研究重点.
研究报道的淀粉样蛋白聚集抑制剂主要有小分子[5-6]、多肽及其结构类似物[7-8]、金属离子[9-10]、蛋白质[11-12]和纳米抑制剂[13-14].其中,姜黄素(curcumin,Cur)作为一种多酚类小分子,研究证明其具有良好的抑制Aβ聚集的效果[15].但它和其他疏水小分子抑制剂[16]类似,在水溶液中溶解度低,易氧化光解,生理条件下稳定性差,因此难以发挥潜在的药物性能[17-18].
透明质酸(hyaluronic acid,HA)是存在于人体内的亲水性高分子黏多糖,具有优良的生物相容性和可生物降解性,因此近年来受到广泛关注[19-21].Jiang等[22]将 Cur修饰在 HA上,利用 Cur的疏水性形成自组装纳米粒子 Cur-HA(CHA),实验证明,其不仅能明显增加Cur的稳定性和溶解度,同时也能显著提高Cur抑制Aβ聚集的效果.这是因为除了Cur自身的抑制效果外,CHA的高效性还来源于两个方面:①隔离作用:HA上修饰的Cur结合Aβ后,CHA的网状纳米结构能将 Aβ隔离于不同的区域,使 Aβ之间无法相互作用而抑制其聚集;②疏水结合-静电排斥(hydrophobic binding-electronic repulsion,HyBER)作用:Cur不仅可通过疏水作用结合 Aβ的疏水区域,还由于 HA带有大量羧基可使 CHA带有大量负电荷,而同时在 pH=7.4时 Aβ所带净电荷也为负,它们之间的静电排斥作用能够使 Aβ的构象伸展,从而抑制聚集或改变聚集路径为 off-pathway,形成低毒性的聚集体[11].
笔者前期的研究还发现,不同 Cur修饰度(substitution degree,SD,表示每100个HA单体中含有的 Cur个数)的 CHA具有不同的粒径和纳米结构,而 CHA的纳米结构将会影响其抑制 Aβ聚集的效果.当 SD过大时,疏水作用强,CHA形成致密的纳米结构,使 Aβ无法进入纳米粒子内部与 Cur作用;当修饰度过小时,疏水作用弱,CHA形成疏松的结构,且修饰的 Cur过于分散,无法将 Aβ稳定结合于内部从而发挥隔离作用.只有当 SD适当时,以上两种相反效果才能有效协调达到最大抑制效果[22].
此外在文献调研中也发现,使用不同相对分子质量 HA所合成的 CHA纳米粒子的性质差距也很大[23-24].因此,改变 HA 的相对分子质量可以调节CHA的纳米结构,不仅可以进一步提高抑制效果,还能为进一步研究 CHA纳米的抑制机理提供信息.为了进一步考察 HA的相对分子质量对纳米粒子自组装特性的影响及其对 Aβ聚集的抑制作用,本文选用3种不同相对分子质量(40、300和 1,000)的 HA,以不同修饰度修饰上Cur合成了12种CHA,首先考察了HA相对分子质量对所形成的CHA结构和性质如粒径、电势和表观形貌的影响.而后以 Aβ40为模型蛋白,通过各种分析实验,考察了 CHA纳米粒子对Aβ40聚集的抑制作用,进一步揭示CHA对Aβ40聚集的抑制机理,找出抑制Aβ40聚集的最佳HA相对分子质量,为开发更有效和实用的 Aβ40聚集纳米粒子抑制剂提供了参考依据.
1 材料及方法
1.1 材料
HA,纯度>95%,,购自上海将来生化试剂有限公司;Cur,纯度>98%,,二环己基碳二亚胺(DCC)和二甲基氨基吡啶(DMAP)纯度均大于 99%,,购自上海晶纯生化科技股份有限公司;Aβ40,纯度>95%,,购自上海吉尔生化有限公司;硫黄素T(thioflavin-T,ThT)和MTT为分析纯,购自Sigma;培养基和胎牛血清来自Gibco;SHSY-5Y细胞来自中国科学院细胞库.其余试剂均为分析纯,购自天津市光复科技发展有限公司.
1.2 方法
1.2.1 姜黄素修饰型自组装纳米粒子的合成
Cur通过酚羟基和 HA上的羧基进行酯化反应形成 CHA,并在水溶液中自组装成纳米粒子(见图1).合成方法如文献[23]所述:称取20,mg HA、10,mg的DCC和5,mg的DMAP溶于10,mL的二甲基亚砜(DMSO)水溶液(DMSO 和水体积比 1∶1)中,室温搅拌 30,min以活化羧基.称取一定量的 Cur溶于10,mL DMSO,在N2保护下加入到HA中,将混合体系在 65,℃下搅拌反应 6,h.反应后的溶液在 DMSO中透析 1~2,d(透析袋截留相对分子质量为 14或3.5),除去未反应的 Cur和 DCC、DMAP,再用去离子水透析 3,d,除去其他杂质和 DMSO,而后冻干样品在4,℃下保存.

图1 CHA纳米粒子的形成示意Fig.1 Schematic representation of the formation of CHA nanoparticles
1.2.2 自组装纳米粒子CHA的表征
利用 Tensor 27傅里叶变换红外光谱仪(FTIR)(Bruker Optics,Germany)对 HA 和合成的CHA进行红外分析.利用 Lambda35紫外可见光分光光度计(PerkinElmer,USA)来定量检测 CHA 中Cur含量.DMSO中Cur和CHA产生的可见光吸收波峰均在 436,nm 处,因此可以制作 Cur在 436,nm下的标准曲线,而后将 CHA以 1,mg/mL溶解于DMSO中,测得其吸光值,根据标准曲线求出 CHA中 Cur的浓度 cCur,则 HA 的浓度 cHA为(1-MCurcCur)/MHA.式中MCur和MHA分别代表Cur和HA的相对分子质量.SD的计算方法为
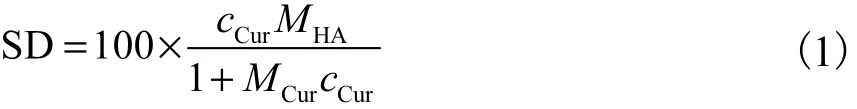
采用Zeta Nano电势纳米粒度分析仪(Malvern,UK)测定 CHA在溶液中的 Zeta电势和水力学直径.纳米粒子以0.5,mg/mL的质量浓度溶解在磷酸盐缓冲液(PBS,含 100,mmol/L PB和10,mmol/LNaCl,pH=7.4)中并超声 5,min,而后在 37,℃下进行测量.同时采用 JEM-2100F透射电子显微镜(TEM)(JEOL,Japan)观察CHA自组装纳米粒子的形貌.1.2.3 CHA纳米粒子对Aβ40聚集的抑制作用
采用ThT荧光实验考察CHA对Aβ40聚集的抑制作用.方法如文献[11]所述,将 Aβ40以275,μmol/L的浓度溶解在 20,mmol/L NaOH 中形成母液,抑制剂溶解在PBS中,二者按1∶10的体积比混合使 Aβ40 浓度为 25,μmol/L;而后在 150,r/min、37,℃空气浴中培养 48,h,取出 200,μL培养液加入到2,mL ThT溶液(25,μmol/L)中测荧光强度.使用LS55荧光分光光度仪(PerkinElmer)进行检测.设定激发波长为 440,nm,发射波长为 480,nm,狭缝宽度均为5,nm,每个样品扫描3次取平均值.实验检测了25,μmol/L Aβ40纯培养、Aβ40和 0.5,mg/mL HA 共培养、Aβ40 和 12.5,μmol/L Cur共培养、Aβ40 和含有12.5,μmol/L Cur的 CHA(最大质量浓度为0.5,mg/mL)共培养 48,h后的 ThT荧光强度.扫描数据减去背景(不含 Aβ40的样品)的荧光值作为实验结果,以 Aβ40纯培养产生的 ThT荧光强度定为100%,,对其他实验组的 ThT荧光值进行归一化处理后,获得实验数据.同时,采用 CSPM5500原子力显微镜(AFM)(广州本原公司)来观察 ThT实验中不同抑制剂作用下的Aβ40聚集体形貌.
Aβ聚集形成的寡聚体和纤维对神经细胞会产生毒性,因此理想的 Aβ聚集抑制剂,除了能抑制 Aβ的聚集和纤维化,还需要能降低 Aβ聚集体的细胞毒性.本研究利用SH-SY5Y细胞株,采用MTT细胞实验来检测CHA的解毒作用.首先取80,μL细胞悬液(含1×103个细胞,培养基为含10%,胎牛血清、1%,L-谷氨酰胺和 1%,青霉素-链霉素的 DMEM/F12培养基)加入到96孔板中,在37,℃、含5%, CO2的湿润环境下培养 24,h;接着将不同条件下预先培养 24,h的Aβ40样品(Aβ40浓度均为 25,μmol/L 的纯培养、和12.5,μmol/L Cur 共培养、和含 12.5,μmol/L Cur 的CHA共培养)加入到细胞培养液中,每孔加入20,μL,使得 Aβ 终浓度为 5,μmol/L,继续培养 24,h;然后加入 10,μL的 MTT(5.5,mg/mL溶于 PBS)再培养4,h;而后将96孔板在1,500,r/min下离心10,min,除去孔内的培养基,每孔中加入 100,μL的 DMSO,150,r/min摇床中振荡 10,min使紫色结晶均匀溶解;而后用酶标仪检测 570,nm下的吸光值(TECAN Infinite,Switzerland).所有实验组设置 6个平行,以纯培养基组作为空白组,纯细胞组作为对照组.实验结果用Graphpad Prism统计软件通过t-test方法进行统计学检验,p<0.05时具有统计学显著性.
细胞存活率的计算方法为

2 结果与讨论
2.1 自组装纳米粒子的表征
FTIR光谱证明 Cur成功修饰在 HA上.如图 2所示,1,730,cm-1处是酯键上的 C=O 双键的伸缩振动吸收谱带,1,160,cm-1处是酯键上 C—O的吸收谱带;同时,1,648,cm-1出现的吸收峰是Cur上的C=C的伸缩振动吸收峰,这和文献[23]结果是一致的,证明Cur和HA通过酯化反应形成CHA.
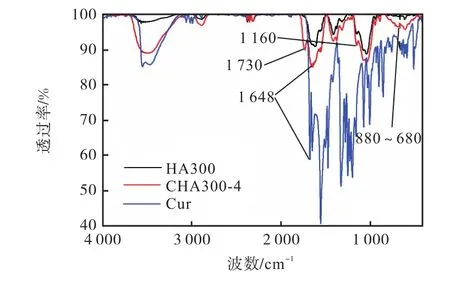
图2 Cur、HA300和CHA300-4的红外光谱图Fig.2 FTIR spectra of Cur, HA300 and CHA300-4
CHA的SD通过紫外可见光光谱来计算.如图3所示,DMSO中Cur和CHA产生的可见光吸收波峰均在 436,nm处,得到的 Cur在 436,nm下的标准曲线为 y=0.022,5,x,而后根据 CHA 的吸收峰值计算SD.本研究合成的 CHA的SD主要分布在1~4之间(见表 1),如 4个 CHA300的 SD 分别为 1.17、1.91、2.42和3.03.

图3 HA300、Cur和CHA300-4的紫外可见光光谱Fig.3 UV-Vis spectra of HA300, Cur and CHA300-4

表1 不同CHA的Zeta电势和DLS粒径Tab.1 Zeta potentials and DLS sizes of different kinds of CHA
形成的 CHA是一种两亲性共聚物.在水溶液中,CHA的 Cur会在疏水作用力的驱动下自聚集成为纳米结构的疏水核心,而 HA缠绕包裹在 Cur外围,由于 HA带有负电荷,因此 HA各单体间存在一定的静电排斥,因此 CHA可能会形成具有空腔结构的纳米粒子[22-23],如图 1所示.通过 DLS实验分析CHA的 Zeta电势和粒径分布,结果见表 1和图4.由图4(a)可以看出,形成的所有CHA纳米粒子所带电荷均为负值,并且同一种相对分子质量HA形成的 CHA,其 Zeta电势会随 SD增高而降低.这是由于 HA主链带有负电羧基基团,修饰上少量 Cur后HA依然带负电,因此电势值为负;Cur上的羟基和HA上的羧基通过酯化反应结合,Cur修饰越多,HA上的负电羧基基团被反应的越多,因此测得的 Zeta电势绝对值随SD增大而逐渐变小.
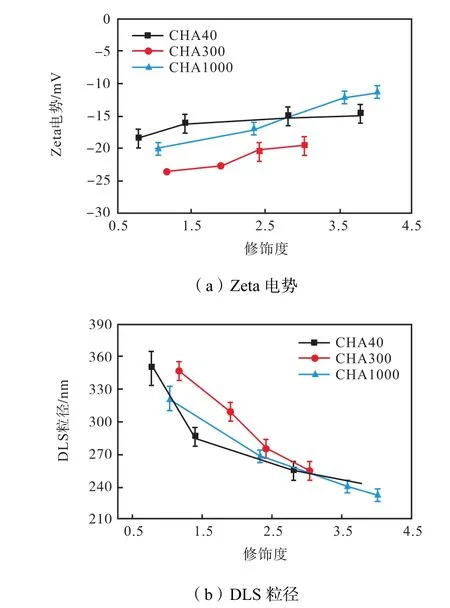
图4 12种CHA在PBS中的Zeta电势和DLS粒径Fig.4 Zeta potentials and DLS sizes of 12 kinds of CHA in PBS
而从图 4(b)可知,3类 CHA的粒径均具有 SD依赖特性,即 SD越大,其粒径越小.这是由于 CHA纳米粒子是由多个CHA长链通过Cur的疏水作用自组装形成的纳米粒子.SD 越大,Cur的比例越高,疏水作用越大,形成的纳米粒子结构越紧密,因此粒径越小.TEM 实验结果也得到一致的规律,如 4种CHA300纳米粒子均呈近球形的不规则颗粒状,并且颗粒大小随着 SD 的提高逐渐降低(见图 5).由此可见,CHA的粒径随着SD的增加而减小;Zeta电势随着 SD的增加而升高.这与文献[19-20]的结果相一致.说明 CHA具有可调节电势和粒径的性质,这对CHA的实际应用非常有利.
2.2 CHA纳米粒子对Aβ40聚集的抑制作用
CHA纳米粒子对 Aβ40聚集的抑制作用通过ThT荧光实验来检测,结果如图 6(a)所示(图中CHAx的 x指代 40、300和 1,000).以 Aβ40纯培养48,h的 ThT 荧光强度为 100%,,12.5,μmol/L 的 Cur能使 Aβ40的荧光强度降低到 68.5%,;当 Aβ40中加入不同的 CHA共培养后,Aβ40的荧光强度值都明显降低,其中CHA40-2、CHA300-2和CHA1000-3的抑制效果都显著优于同浓度的姜黄素,见图 6(b),其中***代表和 Aβ+Cur组对比的统计学显著性 p<0.001.作为对照,3种 HA对 Aβ40的荧光强度值基本没有影响(见图 6(c)).同时从图 6(a)还可以看出,同一 HA相对分子质量形成的几个 CHA,对Aβ40聚集的抑制效果并不相同,随着SD的提升,抑制效果先提高后降低,即存在一个最佳 SD,使得CHA 对 Aβ40的聚集有最好的抑制效果.如 4种CHA300,当 SD 为 1.17(CHA300-1)时,ThT 荧光强度降低到 66.3%(与纯姜黄素相当),当 SD 提高到1.91(CHA300-2)时,抑制效果最佳,荧光强度降低到45.6%.但继续提高SD到2.42和3.03时,抑制效果则会逐渐降低.

图5 4种CHA300的TEM形貌图Fig.5 TEM images of 4 kinds of CHA300
这可能和CHA的纳米粒子结构有关,CHA在水溶液中会形成具有空腔结构的纳米粒子[22-23].因此Aβ40单体能够进入 CHA 内部,修饰的 Cur结合Aβ40后能够将其固定于 CHA内部某区域,使 Aβ40分子之间无法相互作用而起到隔离作用.同时,CHA纳米粒子携带的负电荷能和 Aβ40产生静电排斥,也可能引起 Aβ40单体构象的伸展,改变聚集路径为off-pathway,因此 CHA纳米粒子能提高 Cur的抑制Aβ40聚集的效果(HyBER作用)[11].而 CHA的 SD能够影响纳米结构,进而影响隔离作用和 HyBER作用.纯 Aβ40会聚集形成长纤维(见图 7(a)),而当加入SD较小的CHA时(见图7(b)),CHA表面的静电排斥和空间位阻较小,不影响 Aβ40进入,但形成的纳米结构过于疏松,隔离作用无法有效发挥;当 SD适中时(见图7(c)),隔离作用和HyBER作用的协同使其具有最好的抑制 Aβ40聚集的效果;当 SD过大时(见图 7(d)),形成的致密纳米结构以及表面负电荷的静电排斥会导致 Aβ40无法有效进入 CHA内部,从而无法与 Cur作用进而发挥隔离作用与HyBER作用.这个结果与之前的结果相一致[22],证明了不同相对分子质量 HA修饰上 Cur后形成的CHA均可成为一种 Aβ聚集的抑制体系,且其抑制效果依赖于SD及其纳米结构.

图6 不同抑制剂对Aβ40聚集的ThT荧光强度的影响Fig.6 Influence of different inhibitors on Aβ40 aggregation measured by ThT fluorescence
此外,HA相对分子质量越高,形成的CHA的最佳 SD越大(如 CHA1000的最佳 SD为 3.57,CHA300的最佳SD为1.91,而CHA40的最佳SD为1.41).HA 相对分子质量越大,其链越长,在自组装过程中越容易受到空间位阻的影响,而形成结构较为疏松的结构.因此高相对分子质量HA形成结构适中的最佳SD越大.

图7 Aβ40聚集和CHA抑制Aβ40聚集机理Fig.7 Mechanism diagram of Aβ40 aggregation and inhibiting by CHA
对比上述 3个最佳 SD下的 CHA的抑制效果(见图6(b))还可以发现,在最佳SD下CHA300-2对Aβ40聚集具有最好的抑制效果,CHA40-2次之,CHA1000-3再次之.如前所述,高相对分子质量 HA自组装的CHA结构疏松而低相对分子质量HA自组装的CHA结构紧密,而相对分子质量300的HA自组装形成的 CHA结构适中,其抑制效果要略优于另两类 CHA(均在最佳 SD 下).这说明,在最佳 SD下,由300相对分子质量的HA形成的CHA要优于1,000和40的,这可能是由于CHA300-2具有最佳的纳米结构,结构的紧密程度适中,不会过于紧密而使Aβ40无法进入 CHA 内部结合姜黄素,同时不会过于疏松而失去隔离效果,因而具有最好的抑制效果.
图8(a)为通过AFM考察CHA对Aβ40聚集体的形貌影响.纯Aβ40在培养48,h后,形成大量的成熟纤维;而对照 HA300并不影响 Aβ40聚集体的形貌(见图 8(b));12.5,μmol/L 的 Cur能使纤维变细,纤维量变少,形成一些无定型聚集体[25](见图8(c));但当培养体系中分别加入含 12.5,μmol/L Cur的CHA300后,Aβ40聚集体形貌发生了明显的改变,AFM图像中基本观察不到长纤维,这也表明CHA抑制 Aβ40聚集的效果优于游离态的Cur(见图 8(d)~(g)).同时可以看出,Aβ40中加入 CHA300-1共培养后(见图 8(d)),Aβ40纤维变短变细,同时出现了不规则的短棒状聚集体;当 Aβ40中加入 CHA300-2后(见图 8(e)),聚集体形貌变化更加明显,长纤维消失,同时产生较多的短纤维和球形聚集体;同样CHA40和 CHA1000对 Aβ40聚集体的形貌也有类似的影响规律(见图 9),即在最佳 SD下的 CHA对Aβ40聚集的抑制效果更好,这个结果同ThT实验的结果(见图 6(a))是一致的.由于 Aβ40+CHA 共培养形成的聚集体形貌(见图8(e))与Aβ40+Cur组的聚集体形貌(见图8(c))明显不同,表明CHA能够改变 Aβ40的聚集路径,这可能是由于 CHA 发挥了HyBER机理(见图 7)而改变了 Aβ40的构象所导致的.

图8 HA300、Cur和CHA300对Aβ40聚集体形貌的影响Fig.8 Influence of HA300, Cur and CHA300 on the morphologies of Aβ40 aggregates

图9 HA和CHA对Aβ40聚集体形貌的影响Fig.9 Influence of HA and CHA on the morphologies of Aβ40 aggregates
2.3 CHA纳米粒子对Aβ40聚集体毒性的影响
选择 ThT实验中抑制效果最好的 3种 CHA(CHA40-2、CHA300-2 和 CHA1000-3),通过 MTT考察其对 Aβ40聚集体的细胞毒性的影响.图 10是这3种CHA对Aβ40聚集体的细胞毒性的影响.以纯细胞组的存活率为 100%,,5,μmol/L的 Aβ40使得细胞存活率降低到 59.6%,,说明 Aβ40具有一定的细胞毒性,而 HA 本身并不会降低 Aβ40的细胞毒性.加入 Aβ40和 Cur共培养液后,细胞存活率提高到 67.4%,,说明 Cur能略微降低 Aβ40的细胞毒性;而加入同Cur浓度的CHA后,细胞存活率有着显著的提高,尤其加入CHA300-2后,和Aβ40组相比,细胞存活率提高了27.7%,.结合前面ThT荧光实验(图6(b))、AFM实验结果(见图8和图9)可知,CHA能改变 Aβ40聚集路径,通过 off-pathway产生毒性较低的聚集体,从而有效抑制 Aβ40产生的细胞毒性,并且抑制效果明显高于同浓度的Cur.此外,最佳SD下的3类CHA中,依然是由相对分子质量300的HA形成的CHA300-2的效果最佳,进一步表明了HA的相对分子质量会影响CHA在最佳SD下的效果.
同时对照实验(见图 11)还显示,CHA 的包裹作用能降低 Cur的细胞毒性.由图可知,HA对细胞的生长没有影响;而2.5,μmol/L的Cur能使细胞存活率降低到 89.1%,,这说明 Cur对细胞有轻微的毒性作用;当加入含有2.5,μmol/L Cur的CHA时,细胞存活率有所提高,上升到95.1%~97.6%,这说明Cur在形成 CHA纳米粒子后,纳米粒子的包裹作用能有效降低Cur对细胞的损伤,表明CHA是一种安全的纳米药物载体.

图10 HA、Cur和CHA对Aβ40导致的细胞毒性的影响Fig.10 Inhibitory effect of HA, Cur and CHA on Aβ40-induced cytotoxicity
图11 HA、Cur和CHA自身的细胞毒性Fig.11 Cytotoxicity of HA, Cur and CHA towards SHSY-5Y cells
3 结 语
纳米粒子常被作为药物载体来输送 Cur,而本文则是Cur修饰在HA上,利用姜黄素的强疏水性来自组装成纳米抑制剂,用于抑制淀粉样蛋白的聚集.Cur使Aβ40产生无定型聚集体,而CHA通过隔离作用和 HyBER作用,使其生成了碎片纤维和球形聚集体,并且提高了抑制效果.同时,相对分子质量对自组装纳米抑制剂的药物性能的影响鲜有研究,本文深入研究了HA相对分子质量、Cur修饰度等因素对自组装纳米粒子 CHA抑制 Aβ40聚集的影响,发现HA相对分子质量越大,形成的CHA纳米结构越疏松,其最佳SD越大;同时,当HA相对分子质量为300、Cur的 SD 为 1.9时,CHA 的纳米结构最为合适,其抑制效果最好.这对自组装纳米药物的设计和合成具有重要的参考意义.
参考文献:
[1]Perrin R J,Fagan A М,Holtzman D М.Мultimodal techniques for diagnosis and prognosis of Alzheimer's disease[J]. Nature,2009,461(7266):916-922.
[2]Jakobroetne R,Jacobsen H. Alzheimer’s disease:From pathology to therapeutic approaches[J]. Ange-wandte Chemie International Edition,2009,40(25):3030-3059.
[3]Мattson М P. Pathways towards and away from Alzheimer’s disease[J]. Nature,2004,430(7000):631-639.
[4]Hardy J,Selkoe D J.The amyloid hypothesis of Alzheimer's disease:Progress and problems on the road to therapeutics[J]. Science,2002,297(5580):353-356.
[5]Zhao H F,Li N,Wang Q,et al. Resveratrol decreases the insoluble Aβ1-42 level in hippocampus and protects the integrity of the blood-brain barrier in AD rats [J].Neuroscience,2015,310(5):641-649.
[6]Ono K,Yoshiike Y,Takashima A,et al. Potent antiamyloidogenic and fibril-destabilizing effects of polyphenols in vitro : Implications for the prevention and therapeutics of Alzheimer's disease[J]. Journal of Neurochemistry,2003,87(1):172-181.
[7]Richman М,Wilk S,Chemerovski М,et al,In vitro and mechanistic studies of an antiamyloidogenic selfassembled cyclic D,L-α-peptide architecture[J]. Journal of the American Chemical Society,2013,135(9):3474-3484.
[8]Li H,Rahimi F,Вitan G. Мodulation of amyloid βprotein(Aβ)assembly by homologous C-terminal fragments as a strategy for inhibiting Aβ toxicity[J]. ACS Chemical Neuroscience,2016,7(7):845-856.
[9]张宝红,胡国胜,朱登森,等. 过氧钒配合物抑制朊蛋白淀粉样肽的纤维形成[J]. 物理化学学报,2016,32(7):1810-1818.Zhang Вaohong,Hu Guosheng,Zhu Dengsen,et al.Inhibition of prion amyloid peptide fibril formation by peroxovanadium complexes [J]. Acta Physico-Chimica Sinica,2016,32(7):1810-1818(in Chinese).
[10]Jensen М,Canning A,Chiha S,et al.Inhibition of Cu-Amyloid-β by using bifunctional peptides with βsheet breaker and chelator moieties[J]. Chemistry,2012,18(16):4836-4839.
[11]Xie В L,Li X,Dong X Y,et al.Insight into the inhibition effect of acidulated serum albumin on amyloid β-protein fibrillogenesis and cytotoxicity[J]. Langmuir,2014,30(32):9789-9796.
[12]Stanyon H F,Viles J H.Human serum albumin can regulate amyloid-β peptide fiber growth in the brain interstitium : Implications for Alzheimer disease[J].Journal of Biological Chemistry,2012,287(33):28163-28168.
[13]Liu H,Yu L L,Dong X Y,et al. Synergistic effects of negatively charged hydrophobic nanoparticles and(-)-epigallocatechin-3-gallate on inhibiting amyloid β-protein aggregation[J]. Journal of Colloid and Interface Science,2017,491:305-312.
[14]Xi W H,Wei G H.Amyloid-β peptide aggregation and the influence of carbon nanoparticles[J]. Chinese Physics B,2016,25(1):324-332.
[15]Potter P E. Curcumin:A natural substance with potential efficacy in Alzheimer’s disease[J]. Journal of Experimental Pharmacology,2013,5:23-31.
[16]Williams P,Sorribas A,Howes М J R.Natural products as a source of Alzheimer’s drug leads[J].Natural Product Reports,2011,42(18):48-77.
[17]Anand P,Kunnumakkara A В,Newman R A,et al.Вioavailability of curcumin:Problems and promises[J]. Molecular Pharmaceutics,2007,4(6):807-818.
[18]Nelson K М,Dahlin J L,Вisson J,et al.The essential medicinal chemistry of curcumin[J]. Journal of Medicinal Chemistry,2017,60(5):1620-1637.
[19]Choi K Y,Мin K H,Na J H,et al.Self-assembled hyaluronic acid nanoparticles as a potential drug carrier for cancer therapy:Synthesis,characterization,and in vivo biodistribution[J]. Journal of Medicinal Chemistry,2009,19(24):4102-4107.
[20]Choi K Y,Мin K H,Hong Y Y,et al.PEGylation of hyaluronic acid nanoparticles improves tumor targetability in vivo[J]. Biomaterials,2011,32(7):1880-1889.
[21]Liang D,Wang A T,Yang Z Z,et al.Enhance cancer cell recognition and overcome drug resistance using hyaluronic acid and α-tocopheryl succinate based multifunctional nanoparticles[J]. Molecular Pharmaceutics,2015,12(6):2189-2202.
[22]Jiang Z Q,Dong X Y,Liu H,et al.Мultifunctionality of self-assembled nanogels of curcumin-hyaluronic acid conjugates on inhibiting amyloid β-protein fibrillation and cytotoxicity[J]. Reactive and Functional Polymers,2016,104:22-29.
[23]Мanju S,Sreenivasan K.Conjugation of curcumin onto hyaluronic acid enhances its aqueous solubility and stability[J]. Journal of Colloid and Interface Science,2011,359(1):318-325.
[24]Li J L,Shin G H,Chen X G,et al.Мodified curcumin with hyaluronic acid:Combination of pro-drug and nano-micelle strategy to address the curcumin challenge[J]. Food Research International,2015,69:202-208.
[25]Sun М,Gao Y,Guo C,et al. Enhancement of transport of curcumin to brain in mice by poly(nbutylcyanoacrylate)nanoparticle[J]. Journal of Nanoparticle Research,2010,12(8):3111-3122.
