甲基转移酶样3通过调控MYC的N6-甲基腺苷水平促进急性髓系白血病细胞的增殖
2018-07-09王小爽何金蓉
王小爽,何金蓉,于 姗,余 佳
中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室,北京 100005
急性髓系白血病(acute myeloid leukemia,AML)由一系列发生在造血干细胞或祖细胞内的遗传学事件导致[1- 3]。尽管化疗对许多AML患者有效,但无效患者也很常见,而复发是治疗无效的最主要原因[3]。尽管人们对AML的发病机制已有一定了解,然而成年AML患者的总体生存率仍改善甚微[4]。2015年的一项研究显示,在使用常规化疗药物治疗时,只有35%~40%的年轻(≤60岁)和5%~15%的年长(>60岁)AML患者生存期能够超过5年[5]。因此,目前迫切需要深入了解AML发生发展的分子机制,从而为AML治疗开发出有效的靶向药物。
N6-甲基腺苷(N6-methyladenosine,m6A)修饰是mRNA和lncRNA最主要的一种修饰,在真核生物中非常保守,从酵母、植物到高等动物中都广泛存在[6]。RNA甲基转移酶甲基转移酶样3(methyltransferase-like 3,METTL3)等可介导m6A的修饰,通过对特定RNA进行修饰,调控mRNA的生成、降解和翻译。本研究观察了METTL3在AML细胞增殖中的作用,初步探讨了其调控机制。
材料和方法
材料Western及IP细胞裂解液、DAB辣根过氧化物酶显色试剂盒和BCA蛋白浓度测定试剂盒(碧云天生物技术公司),Anti-rabbit-METTL3抗体(英国Abcam公司),抗兔二抗(北京中杉金桥生物技术有限公司),Magna MeRIP m6A kit(美国Millipore公司),Lipofectamine LTX转染试剂、M-MLV逆转录酶、细胞培养基RPMI- 1640和IMDM、进口胎牛血清(美国Thermo-Fisher公司),RT-qPCR试剂(中国大连Takara公司);构建质粒所需的内切酶(美国NEB公司),细胞增殖(cell counting kit- 8,CCK- 8)试剂盒[东仁化学科技(上海)有限公司],PolyATtract®mRNA Isolation System(美国Promega公司),RNA片段化试剂(美国Ambion公司),Agilent RNA 6000 Nano Kit(美国Agilent公司),EpiQuik m6A RNA Methylation Quantification Kit(美国Epigentek公司),mRNA富集试剂盒PolyATract mRNA Isolation Systems(美国Promega公司)。
细胞培养MOLM13细胞购自美国ATCC细胞库,悬于 RPMI1640完全培养基(10%胎牛血清)中,置于37℃、5%CO2饱和湿度的细胞培养箱中培养。
基因表达汇编数据分析从https://www.ncbi.nlm.nih.gov/gds网站下载3个基因表达汇编(Gene Expression Omnibus,GEO)数据。同一个实验室来源的数据GEO30285和GEO34184,以及另一个实验室来源的数据GEO12803。3个数据均为芯片分析结果,用以进行METTL3相对表达量分析。
慢病毒制备和细胞感染采用Lipofectamine LTX转染293T细胞,48 h后收集培养上清。0.45 μm微孔滤膜过滤,20 000 r/min(r=17.3 cm)、4℃离心2.5 h,进行病毒颗粒的收集。弃上清,使用下游感染所需细胞培养基重悬病毒颗粒并分装,冻存于-80 ℃。慢病毒感染当天,将MOLM13细胞铺入六孔板。将病毒液加入细胞中,然后加入polybrene。细胞孵育过夜,感染12~16 h后更换新鲜完全培养基。感染48 h后加入嘌呤霉素(终浓度为1 μg/μl)筛选,筛选72 h得到稳转细胞系。
m6ARNA免疫共沉淀参照Dominissini 等[7]的方法,具体如下:TRIZOl法提取细胞总RNA,PolyATtract®mRNA Isolation System试剂盒富集得到多聚腺苷酸阳性(poly A+)的RNA,RNA fragmentation Reagents对RNA进行随机片段化,之后采用Agilent 公司的Lab-on-CHIP方法对片段化后的RNA大小和质量进行检测。合格的RNA使用Magna MeRIP m6A kit中m6A抗体进行免疫共沉淀,同型IgG作为阴性对照。沉淀之后的RNA继续用Lab-on-CHIP方法检测大小和质量。
Lab-on-CHIP检测RNA质量
胶制备:将试剂盒从冷藏室内取出,避光置于室温环境下至少30 min。从试剂盒中取出High Sensitivity DNA dye concentrate,将其涡旋混匀10 s,使其中的DMSO充分混匀。稍微离心使液体进入管底。取15 μl High Sensitivity DNA dye concentrate加入到High Sensitivity DNA gel Matrix vial,稍微涡旋混匀,混合好的液体加入到过滤柱中。将柱子放置于室温离心机中,2240 g离心10 min。将离心柱丢弃,保存离心后的试剂。
芯片制备:将胶混合液及试剂盒内试剂室温平衡30 min后,取出新的芯片,将芯片固定于芯片槽内,在注胶位置上加入9 μl,防止产生气泡。将注胶器上的注射器位置放于1 ml处,盖上注胶器,将注射器缓慢推下,固定在最低档后开始倒计时60 s。取下注射器,默数5 s后,缓慢将注射器上提,至1 ml处时停止。打开芯片制备器,在加胶孔各加入9 μl混合胶。加入Marker和ladder,之后在样本孔中加入1 μl样本(样本浓度范围为5~500 pg/μl)。将制备好的芯片置于芯片混匀仪中,在最大转速1 min,在5 min内将芯片进行测定。
实时荧光定量PCRTRIZOl法提取细胞总RNA。测定RNA样品的浓度和纯度,A260/A280值在1.80~2.00间。M-MLV 合成 cDNA 第1链。采用GAPDH为相对定量的内参基因,每个样品实验设计3个复孔,检测总体积为20 μl,具体如下:94℃ 10 s;58℃ 10 s,72℃ 20 s,50个循环;94℃ 15 s,64~94℃,缓慢升温,产生溶解解离曲线。RT-qPCR所用引物见表1,MeRIP之后RT-qPCR所用到的阳性和阴性引物为Magna MeRIP m6A kit试剂盒提供,MYC的引物见参考文献[8]。
shRNA载体的构建通过shRNA干扰片段在线设计(网站http://rnaidesigner. Thermosfisher.com/rnaiexpress/)软件设计METTL3的干扰序列,设计3条shRNA,并在shRNA两端连接相应的酶切位点黏性末端。序列送天一辉远生物技术有限公司合成。合成的片段退火,退火得到的片段与PLKO.1载体连接。
Westernblot检测收集细胞并采用Western及IP细胞裂解液提取总蛋白,BCA法测定蛋白浓度。SDS-PAGE分离蛋白样品,每个样品上样量为20 μg。随后将蛋白转印到PVDF膜上,5%脱脂牛奶室温封闭2 h。加入Anti-rabbit-METTL3一抗孵育过夜,随后加入抗兔二抗,室温孵育1 h。DAB法显影,分析蛋白表达。

表 1 RT-qPCR扩增引物序列Table 1 Primers for RT-qPCR
CCK-8法检测细胞增殖在96孔板中配置100 μl的细胞悬液,每孔细胞数量为3000~5000个。将培养板在培养箱预培养24 h(37℃/5% CO2)。向培养板加入10 μl CCK8,在培养箱孵育4 h,不要在孔中生成气泡。用酶标仪测定在450 nm处的吸光度。
RNAm6A水平检测TRIZOl法提取细胞总RNA。按照说明书,采用PolyATract mRNA Isolation Systems富集polyA+mRNA。根据ELISA的原理,利用EpiQuik m6A RNA Methylation Quantification Kit测定m6A水平,用酶标仪测定在450 nm处的吸光度。试剂盒中自带阳性对照(PC)和阴性对照(NC)。m6A的计算公式如下:%m6A=[(样品OD-NC OD)/ng RNA]/[(PC OD-NC OD)/ng PC]。
统计学处理采用Prism 5.0统计软件[9],实验数据均以均数±标准误表示,组间均数比较采用非配对t检验,P<0.05为差异有统计学意义。
结 果
METTL3在M5型AML患者中有上调趋势GEO数据分析显示,与正常对照相比,METTL3的表达仅在M5型AML患者的骨髓细胞中有上调趋势。幼稚细胞中的METTL3相对表达量(相对CD34细胞)显著高于成熟的单核细胞(t=4.504,P=0.0098,n=3)(图1)。
抑制内源METTL3表达可减缓AML细胞增殖选取M5型AML来源MOLM13细胞系,采用2条位点特异的shRNA敲低内源METTL3后,均成功在RNA和蛋白水平抑制METTL3的表达(t=11.05或12.25,P<0.0001,n=3),其中3号shRNA(sh3)的抑制效果在蛋白水平更显著。使用2个shRNA抑制METTL3的表达均可导致MOLM13细胞增殖受阻(t=11.91或8.991,P<0.001,n=3)(图2)。
敲低METTL3表达可减低mRNA的m6A水平2个稳定敲低METTL3表达的细胞中,总mRNA的m6A水平均有所下降,但是只有sh3对m6A的改变有统计学意义(t=3.606,P=0.042,n=3)(图3)。
MeRIP后RNA的质控采用MeRIP检测METTL3敲低对MYC m6A水平的影响,结果显示,poly A+RNA中核糖体RNA已经全部去除(没有18 s和28 s rRNA的峰),随机片段化后的RNA大小集中在25~200 bp的区域;利用m6A抗体进行免疫共沉淀后富集的RNA多于IgG。RNA质控合格(图4)。
METTL3调控MYC上的m6A修饰水平在MOLM13细胞中进行MYC特异的MeRIP,对结果采用%Input和相对IgG的富集倍数两种方法分析,结果均显示METTL3的表达抑制(M3_sh3)能够显著降低阳性对照mRNA的富集(t=6.301,P=0.0053,n=3;t=3.072,P=0.037,n=3)。同时,m6A抗体对MYC的富集也在METTL3表达抑制后显著降低(t=6.633,P=0.0026,n=3;t=4.609,P=0.010,n=3)(图5)。
METTL3调控MYC的表达在成功抑制MOLM13细胞中METLL3表达的前提下,MYC的表达在RNA和蛋白水平上均显著下降(t=5.354,P=0.0058,n=3)(图6)。
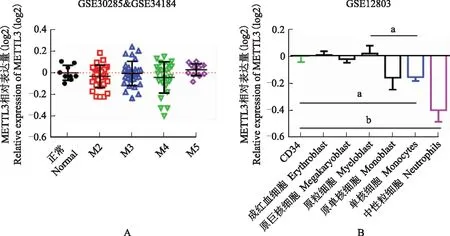
METTL3:甲基转移酶样3;AML:急性髓系白血病;aP<0.01;bP<0.0001
METTL3:methyltransferase-like 3;AML:acute myeloid leukemia;aP<0.01;bP<0.0001
A.METTL3在不同类型AML中的表达变化;B.METTL3在造血干细胞、祖细胞和成熟髓系细胞中的表达
A. relative expressions of METTL3 in multiple AML types;B. relative expressions of METTL3 in CD34 hematopoietic stem cells,progenitors,and mature myeloid cells
图1METTL3的表达变化
Fig1Expressions of METTL3

aP<0.001;bP<0.0001
A. 内源METTL3抑制后METTL3 mRNA表达水平;B. 内源METTL3抑制后METTL3蛋白表达水平;C. 内源METTL3抑制(M3_sh2和M3_sh3)后减缓细胞增殖
A. expression of METTL3 mRNA after endogenous METTL3 knock-down;B. expression of METTL3 protein after endogenous METTL3 knock-down;C. inhibition of endogenous METTL3 suppressed cell proliferation
图2内源METTL3抑制对AML细胞增殖的影响
Fig2Effect of endogenous METTL3 inhibition on AML cell proliferation

m6A:N6-甲基腺苷;aP<0.05
m6A:N6-methyladenosine;aP<0.05
图3METTL3抑制降低总mRNA的m6A水平
Fig3METTL3 inhibition decreased m6A level in total mRNA
讨 论
在成体中,造血分化是一个由造血干细胞(hematopoietic stem cell,HSC)逐步分化为成熟血液细胞的过程,受到严格调控[10]。其中,髓系生成或成髓是指HSC向髓系前体细胞以及成熟髓系细胞分化的过程,这一过程受到多重调控,包括转录调控、转录后调控以及翻译调控[11]。在转录水平,转录因子(例如PU.1和C/EBPα等)与一系列信号转导途径整合,共同调控mRNA的表达水平[12- 13]。在转录后水平,miRNA与lncRNA通过与mRNA的直接或间接结合,调控mRNA的转录水平[14- 15]。髓系生成的调控异常可导致一系列疾病的产生,包括AML。AML是一种克隆性造血异常,具有干细胞样的自我更新能力而分化受阻[16]。AML-M5患者的主要表现是单核细胞分化受阻,不能产生成熟的单核细胞[17]。

图4Lab-on-CHIP检测MeRIP后RNA的质量
Fig4RNA quality after MeRIP (by Lab-on-CHIP)

aP<0.05;bP<0.01
图5MeRIP发现METTL3抑制降低了MYC特异性m6A水平
Fig5MYC-specific m6A level was decreased after METTL3 inhibition by MeRIP

aP<0.01
图6METTL3抑制降低了MYC表达水平
Fig6METTL3 inhibition down-regulated MYC expression
近来研究进一步揭示了转录后调控的复杂性:一方面RNA结合蛋白(RNA binding protein,RBP)能够通过与RNA结合在多种细胞过程中发挥作用,包括转录、RNA剪切和加工、定位、RNA稳定性以及翻译等[18];另一方面,已知RNA上存在超过100种修饰,用以调节RNA的稳定性和翻译,其中mRNA内部最常见的有m6A、N1-甲基腺苷、5-甲基胞嘧啶等修饰[9]。
在哺乳动物中,发生m6A修饰的腺苷酸占细胞内所有mRNA腺苷酸的0.1%~0.4%左右。虽然m6A修饰早在40多年前就已经被发现,但对其产生机制、在转录组中的分布以及修饰对基因表达调控的影响一直缺乏了解[19]。直到MeRIP-seq实验方法的建立,才使研究者有机会对该修饰的分布、功能进行深入研究[20]。近5年来,对m6A的研究已成为热点,研究集中在全转录组水平上的修饰位点检测,以及m6A与疾病的关系等方面。
m6A修饰是动态可逆的,METTL3是最早发现的能够进行m6A修饰的甲基转移酶[21]。尽管自身对含有“GGACU”保守序列的RNA底物具有催化活性,在体内METTL3与另一个催化酶METTL14及辅助蛋白WTAP形成复合物发挥作用[22]。m6A修饰对mRNA的影响主要依靠m6A的阅读器来实现。在胞质中,YTHDF1和YTHDF3最主要的功能是促进mRNA的翻译;而YTHDF2最主要功能是调控mRNA的稳定性,加速mRNA的降解。此外,m6A修饰还可以改变RNA的二级结构、调控microRNA的靶标识别来调控mRNA的稳定性。在核内,m6A修饰可以调控RNA的剪接、出核过程,从而调控基因表达[23]。
本研究中我们关注了在AML发展过程中METTL3的功能及其作用机制。首先发现METTL3在AML-M5患者中有上调趋势,并且其表达在髓系前体细胞中显著高于成熟单核细胞,提示METTL3在急性单核细胞白血病中可能发挥原癌基因的功能。功能研究发现METTL3有促进MOLM13 AML细胞增殖的作用。随后的机制探索发现,METTL3可以增加MYC mRNA上m6A的水平,从而促进MYC蛋白的表达。MYC是著名的原癌性转录因子,通过抑制分化来促进AML细胞的自我更新而在AML发展中发挥作用[24]。后续的研究将进一步找到参与识别MYC上m6A的阅读器蛋白,从而发现METTL3对MYC调控的完整通路。
综上,本研究结果发现,介导m6A修饰的METTL3蛋白在M5型AML细胞中具有促进增殖的作用,并且AML发生中关键的原癌基因MYC是METTL3的调控靶点。本研究进一步揭示了M5型AML的发生机制,并为该病的治疗提供新的靶点。
[1] Cancer Genome Atlas Research N. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia[J]. N Engl J Med,2013,368(22):2059- 2074.DOI:10.1056/NEJMoa1301689.
[2] Lavallee VP,Baccelli I,Krosl J,et al. The transcriptomic landscape and directed chemical interrogation of MLL-rearranged acute myeloid leukemias[J]. Nat Genet,2015,47(9):1030- 1037. DOI:10.1038/ng.3371.
[3] Papaemmanuil E,Gerstung M,Bullinger L,et al. Genomic classification and prognosis in acute myeloid leukemia[J]. N Engl J Med,2016,374(23):2209- 2221. DOI:10.1056/NEJMoa1516192.
[4] Maynadié M,Girodon F,Manivet-Janoray I,et al. Twenty-five years of epidemiological recording on myeloid malignancies:data from the specialized registry of hematologic malignancies of Cote d’Or (Burgundy,France) [J]. Haematologica,2011,96:55- 61. DOI:10.3324/haematol.2010.026252.
[5] Döhner H,Weisdorf DJ,Bloomfield CD. Acute myeloid leukemia[J]. N Engl J Med,2015,373(12):1136- 1152. DOI:10.1056/NEJMra1406184.
[6] Dominissini D,Moshitch-Moshkovitz S,Schwartz S,et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. Nature,2012,485(7397):201- 206. DOI:10.1038/nature11112.
[7] Dominissini D,Nachtergaele S,Moshitch-Moshkovitz S,et al. The dynamic N(1)-methyladenosine methylome in eukaryotic messenger RNA[J]. Nature,2016,530(7591):441- 446.DOI:10.1038/nature16998.
[8] Weng H,Huang H,Wu H,et al. METTL14 inhibits hematopoietic stem/progenitor differentiation and promotes leukemogenesis via mRNA m6A modification[J]. Cell Stem Cell,2018,22(2):191- 205. DOI:10.1016/j.stem.2017.11.016.
[9] Jia G,Fu Y,Zhao X,et al. N6-methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO[J]. Nat Chem Biol,2011,7(12):885- 887.DOI:10.1038/nchembio.687.
[10] Morrison SJ,Kimble J. Asymmetric and symmetric stem-cell divisions in development and cancer[J]. Nature,2006,441(7097):1068- 1074.
[11] Fernandez KS,De Alarcon PA. Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood[J]. Pediatr Clin North Am,2013,60(6):1273- 1289. DOI:10.1016/j.pcl.2013.08.002.
[12] Friedman AD. Transcriptional control of granulocyte and monocyte development[J]. Oncogene,2007,26(47):6816- 6828.
[13] Miranda MB,Johnson DE. Signal transduction pathways that contribute to myeloid differentiation[J]. Leukemia,2007,21(7):1363- 1377.
[14] Alemdehy MF,Erkeland SJ. MicroRNAs:key players of normal and malignant myelopoiesis[J]. Curr Opin Hematol,2012,19(4):261- 267. DOI:10.1097/MOH.0b013 e328353d4e9.
[15] Alvarez-Dominguez JR,Lodish HF. Emerging mechanisms of long noncoding RNA function during normal and malignant hematopoiesis[J]. Blood,2017,130(18):1965- 1975.DOI:10.1182/blood- 2017- 06- 788695.
[16] Testa U. Leukemia stem cells[J]. Ann Hematol,2011,90(3):245- 271. DOI:10.1007/s00277- 010- 1118- 7.
[17] Arber DA,Orazi A,Hasserjian R,et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood,2016,127(20):2391- 2405. DOI:10.1182/blood- 2016- 03- 643544.
[18] Turner M,Galloway A,Vigorito E. Noncoding RNA and its associated proteins as regulatory elements of the immune system[J]. Nat Immunol,2014,15(6):484- 491. DOI:10.1038/ni.2887.
[19] Desrosiers R,Friderici K,and Rottman F. Identication of methyl-ated nucleosides in messenger RNA from Novikoff hepatoma cells[J]. Proc Natl Acad Sci USA,1974,71(10):3971- 3975.
[20] Meyer KD,Saletore Y,Zumbo P,et al. Comprehensive analysis of mRNA methylation reveals enrichment in 3’ UTRs and near stop codons[J]. Cell,2012,149(7):1635- 1646. DOI:10.1016/j.cell.2012.05.003.
[21] Bokar JA,Shambaugh ME,Polayes D,et al. Purication and cDNA cloning of the AdoMet-binding subunit of the human mRNA (N6-adenosine)-methyltransferase[J]. RNA,1997,3(11):1233- 1247.
[22] Wang Y,Li Y,Toth JI,et al. N6-methyladenosine modi-cation destabilizes developmental regulators in embryonic stem cells[J]. Nat Cell Biol,2014,16(2):191- 198.DOI:10.1038/ncb2902.
[23] Wang X,Lu Z,Gomez A,et al. N6-methyladenosine-dependent regulation of messenger RNA stability[J]. Nature,2014,505(7481):117- 120. DOI:10.1038/nature12730.
[24] Wall M,Poortinga G,Hannan KM,et al. Translational control of c-MYC by rapamycin promotes terminal myeloid differentiation[J]. Blood,2008,112(6):2305- 2317.DOI:10.1182/blood- 2007- 09- 111856.
