程序性细胞死亡因子4与5-氟尿嘧啶对胰腺癌细胞凋亡的协同作用
2018-07-07马刚刘宁徐亮刘哲宋从浩王丹璞
马刚,刘宁,徐亮,刘哲,宋从浩,王丹璞
(1. 中国医科大学附属一院普通外科,沈阳 110001; 2. 海南医学院第二附属医院普通外科,海口 570100)
胰腺癌恶性度高,进展快,5年生存率低,仅为5%~10%,中位生存期约为诊断后5~6个月[1]。其在世界范围内占恶性肿瘤死亡原因的第4位[2],在我国为第7位[3-4]。随着医疗技术的进步和外科医生手术技术的提高,部分以前被认为不能手术切除的胰腺癌如今已经可以进行根治性切除。虽然手术切除率不断提高,但患者的生存时间却未得到相应的明显改善。因此对于胰腺癌,除了继续提高手术疗效以外,以化疗为主的多学科综合治疗倍受重视和关注,期望能够找到更多有效的办法改善胰腺癌的预后。
5-氟尿嘧啶 (5-fluorouracil,5-FU) 是应用最早、最广泛的胰腺癌化疗用药,它通过改变细胞周期和诱导细胞凋亡发挥杀死肿瘤细胞的作用。但其总体反应率仅为20%,影响胰腺癌对化疗药物不敏感、产生耐药性的重要原因之一就是各种原因导致的凋亡抑制。本课题组的前期研究[5]结果表明,程序性细胞死亡因子4 (programmed cell death factor 4,PDCD4)作为一种抑癌基因,能够通过诱导细胞凋亡,抑制包括胰腺癌在内的消化系统肿瘤的发生和发展。因此,本研究探讨了PDCD4对5-FU诱导胰腺癌细胞凋亡的影响,发现PDCD4可以增强5-FU诱导胰腺癌细胞凋亡的作用,两者具有协同作用。这一结果为胰腺癌的综合治疗提供了新的思路和方法。
1 材料与方法
1.1 材料
1.1.1 细胞:人胰腺癌细胞系PANC-1,购自上海中科院细胞库。
1.1.2 主要试剂:DMEM培养基、胎牛血清、G418(美国Gibco公司),胰蛋白酶、二甲基亚砜 (DMSO)(美国Sigma公司),四甲基偶氮唑盐 (MTT)、5×SDSPAGE (江苏碧云天公司),Lipafectamine 2000高效转染试剂盒 (美国 Invirtogen公司),PDCD4蛋白抗体、PDCD4表达质粒PEGFP-N1/PDCD4及空载体质粒PEGFP-N2 (日本佐贺大学医学部代谢内分泌研究室松桥幸子教授惠赠),细胞色素C (cytochrome C,CytC) 抗体 (美国Santa Cruz公司) 。
1.1.3 主要仪器:CO2孵育箱、酶标仪、倒置显微镜、高速离心机、普通琼脂糖凝胶电泳仪 (北京六一) 。
1.2 实验方法
1.2.1 细胞培养:人胰腺癌细胞系PANC-1常规培养在含10%胎牛血清的DMEM培养液 (含100 U/mL的青霉素和100 μ g/mL的链霉素) 中,37 ℃、5%CO2、饱和湿度条件下培养。细胞贴壁生长良好,2 d换液1次,3~4 d传代1次。
1.2.2 细胞分组及转染:取对数生长期的PANC-1细胞接种于6孔培养板,当细胞生长达到70%~80%融合时,应用Lipafectamine 2000高效转染试剂盒 (美国Invirtogen公司) 进行瞬时转染。对照组,转染空载体质粒PEGFP-N2 (vector) ;转染组,转染PEGFP-N1/PDCD4。转染过程按照试剂操作说明进行。
1.2.3 5-FU处理:转染组和对照组细胞接种于96孔培养板,培养至对数生长期,依次加入10、50、100、500 μ g/mL的5-FU,每组设3个复孔,继续培养24 h。
1.2.4 MTT比色法测定细胞抑制率:将上述处理的细胞每孔加入20 μ L MTT (5 mg/mL) ,继续孵育4 h,每孔加入150 μ L DMSO溶解,振荡混匀后,以酶标仪测定570 nm处吸光度 (A) 值,计算抑制率。设立阴性对照组:完全培养液加等量无水PBS作为空白对照。计算公式:抑制率 (%) = (A对照组-A转染组) /A对照组×100,绘制生长抑制曲线。
1.2.5 荧光显微镜进行凋亡细胞计数:将经过5-FU处理的细胞,应用5 μ g/mL Hoechst 33342染色5 min,荧光显微镜下观察染色细胞。凋亡细胞判定标准:细胞凋亡过程中细胞核染色质呈浓缩状态或细胞核裂解为碎块。
1.2.6 Western blotting检测PDCD4和CytC的蛋白表达:将经过5-FU处理的细胞,以1∶5比例加入蛋白裂解液,充分裂解,4 ℃、12000 r/min离心1 h,收集上清液并测定蛋白浓度。应用湿转法将分离的蛋白转移至PVDF膜上。加入特异性一抗兔抗人PDCD4抗体(1∶6000) 、兔抗人细胞色素C抗体 (1∶500) 、β-actin抗体 (1∶1000) ,4 ℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育2 h,ECL化学发光、显像。
1.3 统计学分析
2 结果
2.1 5-FU和PDCD4对胰腺癌细胞存活率的协同效应
应用5-FU处理的转染组和对照组细胞生长均受到抑制。随着5-FU浓度的增加,转染组和对照组的细胞生长抑制率均明显升高 (P> 0.05) ;进一步两两比较发现,转染组和对照组内不同浓度5-FU间的差异均有统计学意义 (P> 0.05) 。表明5-FU具有抑制胰腺癌细胞生长的作用,该作用随着浓度的升高而增强。在相同浓度5-FU作用下,转染组比对照组细胞生长抑制作用显著增强 (P> 0.05) 。应用500 μ g/mL的5-FU 处理后,对照组细胞生长抑制率为46.2%,而同时转染了PDCD4的转染组细胞生长抑制率则达到72.1%。说明转染PDCD4能够增强5-FU的抑制胰腺癌细胞生长的作用,两者具有协同效应。见表1。
2.2 5-FU和PDCD4对胰腺癌细胞凋亡的协同效应
应用5-FU处理的转染组和对照组细胞凋亡率均显著增加 (P< 0.05) ;经LSD两两比较发现,除500 μ g/mL与100 μ g/mL 5-FU间未见统计学差异外,转染组和对照组内各浓度5-FU间细胞凋亡率的差异均有统计学意义 (P< 0.05) 。表明5-FU能够诱导胰腺癌细胞凋亡,且至浓度达到100 μ g/mL时,作用随着浓度的增高而显著增强。在相同浓度5-FU作用下,转染组比对照组细胞凋亡率均明显增加,差异有统计学意义 (P< 0.05) 。说明转染PDCD4增强了5-FU诱导胰腺癌细胞凋亡的作用,两者具有协同效应。见表1。
表1 不同浓度5-FU作用下转染组和对照组胰腺癌细胞生长抑制率、凋亡率及CytC蛋白表达(±s,n = 3)Tab.1 Effect of different concentrations of 5-FU on the growth inhibition rate,percentage of apoptotic cells,and expression of CytC protein in PDCD4 transfected and non-transfected pancreatic cancer cells (±s,n = 3)
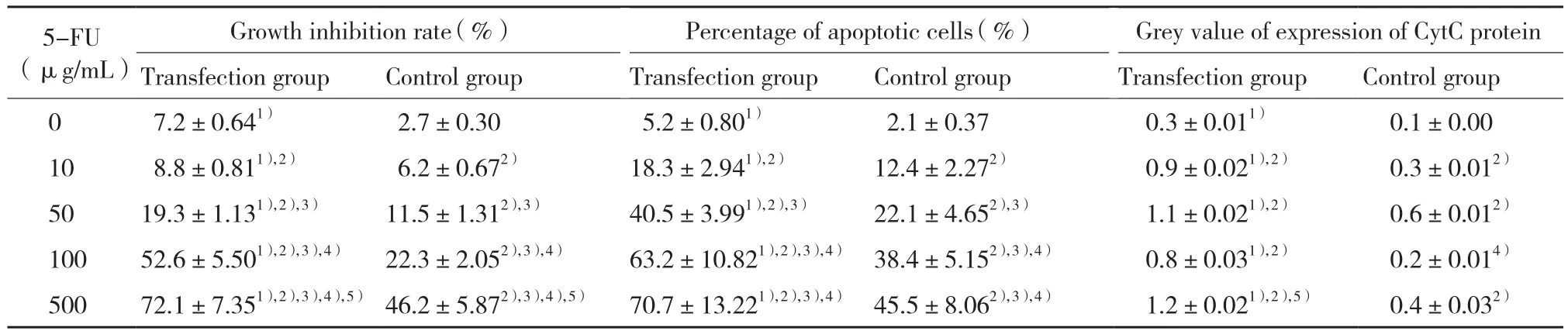
表1 不同浓度5-FU作用下转染组和对照组胰腺癌细胞生长抑制率、凋亡率及CytC蛋白表达(±s,n = 3)Tab.1 Effect of different concentrations of 5-FU on the growth inhibition rate,percentage of apoptotic cells,and expression of CytC protein in PDCD4 transfected and non-transfected pancreatic cancer cells (±s,n = 3)
1) P < 0.05 vs control group;2) P < 0.05 vs 0 μ g/mL 5-FU;3) P < 0.05 vs 10 μ g/mL 5-FU;4) P < 0.05 vs 50 μ g/mL 5-FU;5) P < 0.05 vs 100 μ g/mL 5-FU.
Growth inhibition rate (%) Percentage of apoptotic cells (%) Grey value of expression of CytC protein Transfection group Control group Transfection group Control group Transfection group Control group 0 7.2±0.641) 2.7±0.30 5.2±0.801) 2.1±0.37 0.3±0.011) 0.1±0.0010 8.8±0.811),2) 6.2±0.672) 18.3±2.941),2) 12.4±2.272) 0.9±0.021),2) 0.3±0.012)50 19.3±1.131),2),3) 11.5±1.312),3) 40.5±3.991),2),3) 22.1±4.652),3) 1.1±0.021),2) 0.6±0.012)100 52.6±5.501),2),3),4) 22.3±2.052),3),4) 63.2±10.821),2),3),4) 38.4±5.152),3),4) 0.8±0.031),2) 0.2±0.014)500 72.1±7.351),2),3),4),5) 46.2±5.872),3),4),5) 70.7±13.221),2),3),4) 45.5±8.062),3),4) 1.2±0.021),2),5) 0.4±0.032)5-FU(μg/mL)
2.3 5-FU和PDCD4对胰腺癌细胞CytC的蛋白表达的影响
应用不同浓度5-FU处理的转染组和对照组细胞CytC均有表达。转染组内经5-FU处理后CytC蛋白的表达均显著高于0 μ g/mL (P< 0.05) ,但不同5-FU浓度间未见统计学差异 (P> 0.05) ;对照组内,除100 μ g/mL浓度外,各浓度5-FU均显著高于0 μ g/mL (P<0.05) ,不同浓度5-FU间,仅50 μ g/mL与100 μ g/mL 5-FU间的差异有统计学意义 (P< 0.05) ,其余各浓度间未见统计学差异。表明5-FU能够使CytC蛋白表达增高,但增高程度与5-FU浓度无关。在相同浓度5-FU作用下,转染组比对照组细胞CytC表达明显升高,差异有统计学意义 (P< 0.05) 。说明转染了PDCD4的胰腺癌细胞,可能通过线粒体中CytC的释放,增强了5-FU诱导细胞凋亡的作用。见表1。
3 讨论
随着医学的发展,胰腺外科迎来了精准治疗的时代。2D、3D腹腔镜以及达芬奇机器人手术系统的全面应用,使胰腺癌的手术切除率不断提升,并且达到了微创化、精准化,围手术期死亡率不断下降。但至今患者的5年生存率并未得到相应的改善,目前患者的5年生存率仍维持在7%左右[1]。因此,以化疗为主的多学科综合治疗成为胰腺癌治疗的重要途径,但化疗药物的耐药是目前影响化疗效果的主要原因。
5-FU和吉西他滨是应用于胰腺癌治疗的主要化疗用药,近来研究多数集中在吉西他滨的耐药上,对于应用最早、最广泛的5-FU研究较少。本研究通过转染PDCD4进入胰腺癌PANC-1细胞,明确其对5-FU对胰腺癌效应的影响。研究结果证明,5-FU能够使细胞生长受到明显抑制,增加凋亡细胞。通过比较PDCD4转染组与空转染组,结果发现,在相同浓度5-FU的作用下,转染组细胞生长受到更明显的抑制,凋亡细胞增加程度更为显著;且随着5-FU浓度的升高,对转染组细胞的抑制作用和促进凋亡作用增强程度更为突出。说明PDCD4能够增强5-FU的诱导胰腺癌细胞凋亡的作用,两者具有协同效应。在相同浓度5-FU处理的细胞中,转染组比对照组CytC表达明显升高。可以推测,PDCD4可能通过线粒体途径,促进原来存在于线粒体膜间隙中的CytC释放入细胞质中,导致细胞质中CytC表达增高。释放的CytC与Apaf-1和caspase 9的复合物形成凋亡体,进而引发caspase级联反应,导致细胞凋亡。
本研究表明,PDCD4在胰腺癌细胞中表达下降,转染了PDCD4表达质粒的胰腺癌细胞,可能通过线粒体途径启动细胞凋亡,并且能够增强5-FU的诱导胰腺癌细胞凋亡的的作用。
microRNA (miRNA) 是一组长度为17~25个核苷酸的非编码小RNA,具有调控特定基因表达的作用,从而影响细胞增殖、分化和凋亡,发挥类似原癌基因或抑癌基因的效应[6]。有研究[7-9]表明,miRNA可抑制PDCD4表达,从而降低了胃癌、食道癌、骨肉瘤等肿瘤细胞的凋亡。microRNA-21可以通过下调PDCD4表达,抑制胰腺癌细胞的凋亡,并促进其对5-FU的耐药[10]。而应用反义microRNA-21,则可上调PDCD4表达,抑制胰腺癌细胞的增殖、迁移和浸润,联合应用吉西他滨可以诱导更多细胞凋亡,两者可起到抗肿瘤的协同作用[11]。
这些研究结果均表明,PDCD4作为一个抑癌基因,一旦在胰腺癌细胞中重获表达,再联合应用5-FU等化疗药物,将发挥其对癌细胞的生长抑制作用,直接促进癌细胞凋亡,这将对胰腺癌的临床治疗提供新的方法。本研究找到了一个胰腺癌基因治疗的切入点,提供了一个抑制胰腺癌细胞生长的新思路。
随着研究的不断开展,胰腺癌的治疗也在不断的改进。最近有学者提出,结合肿瘤标志物CA199、CA125、CEA等检测,并结合术前新辅助化疗对肿瘤标志物的影响,可以有效判断患者的预后。以此进一步筛选患者,明确可从手术中获益的患者和即使做了根治性手术术后也将很快复发、不会改善预后的患者,进而采取针对性治疗方案。PDCD4作为一个抑癌基因,同样可能成为一个预后因子,结合这些指标,进行综合评价,有助于更准确地判断患者预后,指导临床决策,使更多患者受益,应该作为今后研究的焦点。
[1]BARON TH,KOZAREK RA. Preoperative biliary stents in pancreatic cancer--proceed with caution [J]. N Engl J Med,2010,362 (2) :170-172. DOI:10.1056/NEJMe0908773.
[2]SIEGEL R,NAISHADHAM D,JEMAL A. Cancer statistics,2013 [J]. CA Cancer J Clin,2013,63 (1) :11-30. DOI:10.3322/caac.21166.2013.
[3]JEMAL A,SIEGEL R,XU J,et al. Cancer statistics,2010[J]. CA Cancer J Clin,2010,60 (5) :277-300. DOI:10.3322/caac.20073.2010.
[4]CHEN W,ZHENG R,ZHANG S,et al. Report of incidence and mortality in China cancer registries,2009 [J]. Chin J Cancer Res,2013,25 (1) :10-21. DOI:10.3978/j.issn.1000-9604.2012.12.04.2013.
[5]MA G,ZHANG H,DONG M,et al. Downregulation of programmed cell death 4 (PDCD4) in tumorigenesis and progression of human digestive tract cancers [J]. Tumour Biol,2013,34 (6) :3879-3885.DOI:10.1007/s13277-013-0975-9.
[6]TIE J,FAN D. Big roles of microRNAs in tumorigenesis and tumor development [J]. Histol Histopathol,2011,26 (10) :1353-1361. DOI:10.14670/HH-26.1353.
[7]YIN K,LIU M,ZHANG M,et al. miR-208a-3p suppresses cell apoptosis by targeting PDCD4 in gastric cancer [J]. Oncotarget,2016,7(41) :67321-67332. DOI:10.18632/oncotarget.12006.
[8]YANG M,LIU R,LI X,et al. miRNA-183 suppresses apoptosis and promotes proliferation in esophageal cancer by targeting PDCD4[J]. Mol Cells,2014,37 (12) :873-880. DOI:10.14348/molcells.2014.0147.
[9]SUN Y,WANG F,WANG L,et al. MicroRNA-433 regulates apoptosis by targeting PDCD4 in human osteosarcoma cells [J]. Oncol Lett,2017,14 (2) :2353-2358. DOI:10.3892/ol.2017.6441.
[10]WEI X,WANG W,WANG L,et al. MicroRNA-21 induces 5-fluorouracil resistance in human pancreatic cancer cells by regulating PTEN and PDCD4 [J]. Cancer Med,2016,5 (4) :693-702. DOI:10.1002/cam4.626.
[11]LI Y,CHEN Y,LI J,et al. Co-delivery of microRNA-21 antisense oligonucleotides and gemcitabine using nanomedicine for pancreatic cancer therapy [J]. Cancer Sci,2017,108 (7) :1493-1503. DOI:10.1111/cas.13267.
