超高效液相色谱-串联质谱法快速检测蔬菜中23种植物生长调节剂
2018-07-06邱世婷郭灵安雷绍荣
邱世婷,韩 梅,侯 雪,郭灵安,雷绍荣,陈 巧
(1.四川省农业科学院 分析测试中心,四川 成都 610066;2.农业部农产品质量安全风险评估实验室(成都),四川 成都 610066;3.西华师范大学 化学化工学院,四川 南充 637002)
植物生长调节剂(Plant growth regulators,PGRs)是一类人工合成,具有与天然激素相似生理和生物学效应的物质[1]。PGRs能够缩短蔬菜的成熟期,增强作物抗逆性,提高产量和改良品质[2]。但 PGRs 本身也属于农药,具有明显的慢性毒性,如致畸致癌,具生殖毒性,影响心肌功能等毒副作用[3]。近年来,植物生长调节剂在农产品生产中的大量使用导致农产品的品质发生变化,农产品质量安全问题也引起广大消费者重视。随着“顶花带刺黄瓜激素超标”、“无根豆芽激素泡大”、“催熟番茄”等事件的爆发,消费者对植物生长调节剂的关注越来越高。目前欧盟、美国、日本等国均对植物生长调节剂的限量值进行了规定,我国实施的《GB 2763-2016 食品安全国家标准食品中农药最大残留量》将作为PGRs使用的农药范围扩大到14种,使用范围涉及10余种产品[4]。因此对农产品中植物生长调节剂进行快速高效的检测十分必要。
目前关于植物生长调节剂的检测方法主要有液相色谱法(HPLC)[5]、气相色谱-质谱法(GC-MS)[6-7]和液相色谱-串联质谱法(HPLC-MS/MS)[8-10]。前处理技术有SPE法[11-12]、固相微萃取法[13]、QuEChERS法[4,6,8,14-15]等,QuEChERS法由于方便简单,已成为植物生长调节剂前处理的常用方法,但目前研究集中在吸附剂方面,而未对脱水剂等的选择进行研究。本文通过对脱水剂、盐析剂、缓冲盐进行考察,最终选取6 g硫酸镁和1 g氯化钠作为提取盐,建立了超高效液相色谱-串联质谱(UHPLC-MS/MS)快速检测蔬菜中23种植物生长调节剂的分析方法。该方法操作方便,高效经济,准确度和灵敏度能够满足国内外限量标准的要求,适合于大批量蔬菜中植物生长调节剂的快速筛查。
1 实验方法
1.1 仪器与试剂
LC-MS/MS-8060超高效液相色谱-三重四极杆串联质谱仪(日本岛津公司);WH-3微型涡旋混合仪(上海沪西分析仪器厂);TGL-16LM 高速离心机(湖南星科科学仪器有限公司)。23种植物生长调节剂,纯度均大于97%,购于Dr.Ehrenstorfer公司和Sigma-Aldrich 公司。乙腈、甲醇、甲酸、乙酸(色谱纯,美国Fisher Scientific公司);实验用水为纯净水(由Milli-Q超纯水仪制备)。
1.2 标准溶液的配制
称取适量标准品,分别用甲醇配制成1 000 mg/L的储备液并储存于-20 ℃冰箱。准确量取一定体积的储备液,以甲醇定容,得23种植物生长调节剂的混合标准溶液,于-4 ℃冰箱保存。根据实验需要用1%乙酸乙腈稀释标准储备液,配成适当浓度的标准工作溶液。
1.3 样品处理
称取经匀浆化处理的蔬菜样品10.0 g,置于50 mL离心管中,加入含1%乙酸的乙腈20.0 mL,在振荡器上振摇30 min后,加入6 g无水硫酸镁和1 g氯化钠,涡旋1 min,以8 000 r/min离心5 min,取上层有机相,过0.22 μm滤膜,滤液待测。
1.4 分析条件
色谱条件:Shim-pack XR-ODSⅢ PKA-C18色谱柱(150 mm ×2.0 mm,2.2 μm);正负离子模式;流动相:A为0.1%甲酸水溶液,B为乙腈;流速0.3 mL/min;进样量1 μL;柱温40 ℃。梯度洗脱程序:0~2 min,10%~50%B;2~6 min,50%~95%B;6~11 min,95%B;11~11.01 min,95%~10%B;11.01~14 min,10%B。
质谱条件:ESI源;接口电压4 000 V;正离子和负离子方式同时扫描;MRM模式;雾化气流量3 L/min,干燥气流量10 L/min,气体均为氮气;加热气流量10 L/min,气体为空气;接口温度300 ℃;脱溶剂管温度250 ℃;加热模块温度400 ℃;碰撞气压力 270 kPa,气体为氩气。23种植物生长调节剂的质谱分析参数见表1。

表1 23种植物生长调节剂的质谱分析参数Table 1 MS/MS parameters of 23 plant growth regulators
(续表1)
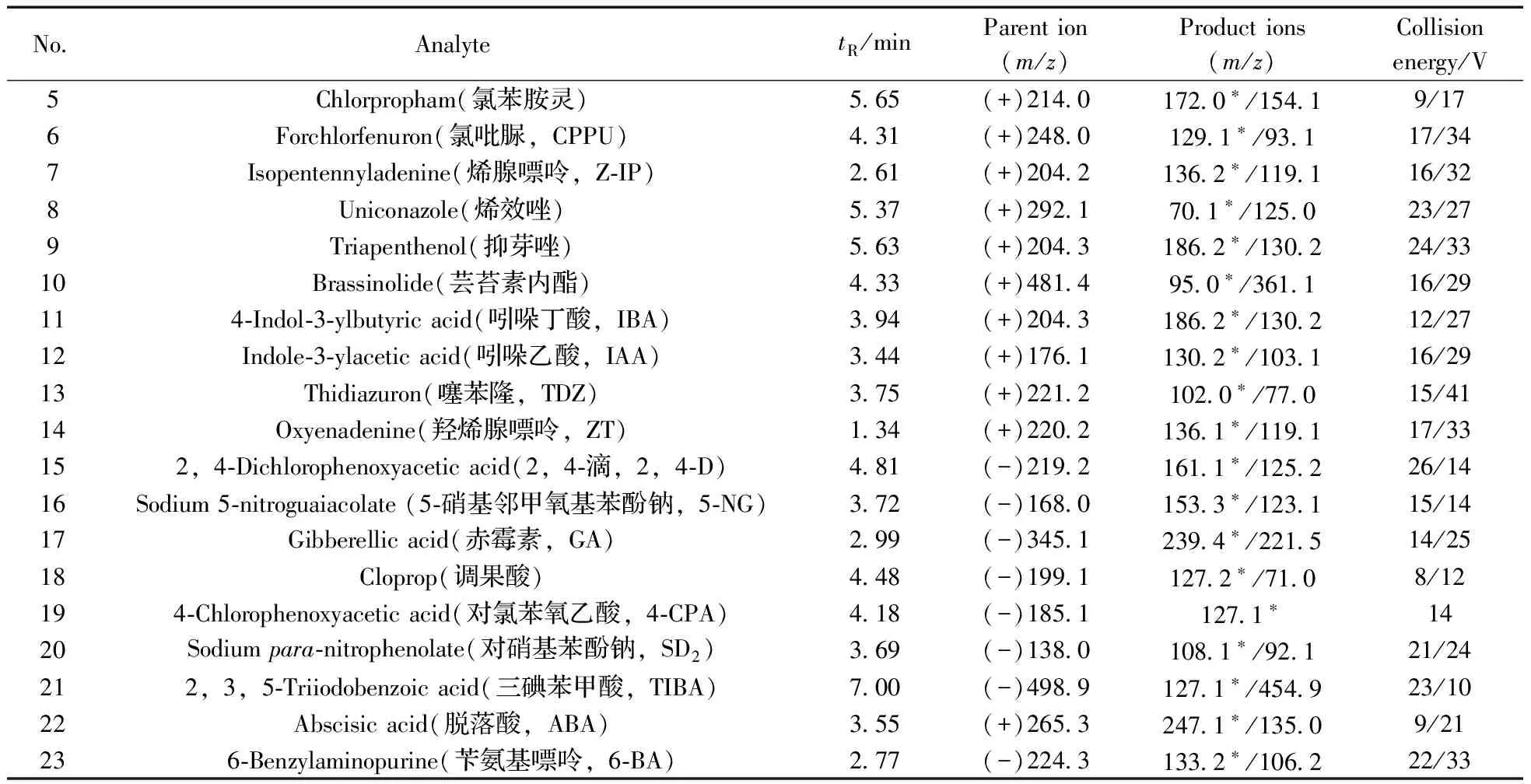
No AnalytetR/minParention(m/z)Productions(m/z)Collisionenergy/V5Chlorpropham(氯苯胺灵)5 65(+)214 0172 0∗/154 19/176Forchlorfenuron(氯吡脲,CPPU)4 31(+)248 0129 1∗/93 117/347Isopentennyladenine(烯腺嘌呤,Z⁃IP)2 61(+)204 2136 2∗/119 116/328Uniconazole(烯效唑)5 37(+)292 170 1∗/125 023/279Triapenthenol(抑芽唑)5 63(+)204 3186 2∗/130 224/3310Brassinolide(芸苔素内酯)4 33(+)481 495 0∗/361 116/29114⁃Indol⁃3⁃ylbutyricacid(吲哚丁酸,IBA)3 94(+)204 3186 2∗/130 212/2712Indole⁃3⁃ylaceticacid(吲哚乙酸,IAA)3 44(+)176 1130 2∗/103 116/2913Thidiazuron(噻苯隆,TDZ)3 75(+)221 2102 0∗/77 015/4114Oxyenadenine(羟烯腺嘌呤,ZT)1 34(+)220 2136 1∗/119 117/33152,4⁃Dichlorophenoxyaceticacid(2,4⁃滴,2,4⁃D)4 81(-)219 2161 1∗/125 226/1416Sodium5⁃nitroguaiacolate(5⁃硝基邻甲氧基苯酚钠,5⁃NG)3 72(-)168 0153 3∗/123 115/1417Gibberellicacid(赤霉素,GA)2 99(-)345 1239 4∗/221 514/2518Cloprop(调果酸)4 48(-)199 1127 2∗/71 08/12194⁃Chlorophenoxyaceticacid(对氯苯氧乙酸,4⁃CPA)4 18(-)185 1127 1∗1420Sodiumpara⁃nitrophenolate(对硝基苯酚钠,SD2)3 69(-)138 0108 1∗/92 121/24212,3,5⁃Triiodobenzoicacid(三碘苯甲酸,TIBA)7 00(-)498 9127 1∗/454 923/1022Abscisicacid(脱落酸,ABA)3 55(+)265 3247 1∗/135 09/21236⁃Benzylaminopurine(苄氨基嘌呤,6⁃BA)2 77(-)224 3133 2∗/106 222/33
tR:retention time;*quantitative ion
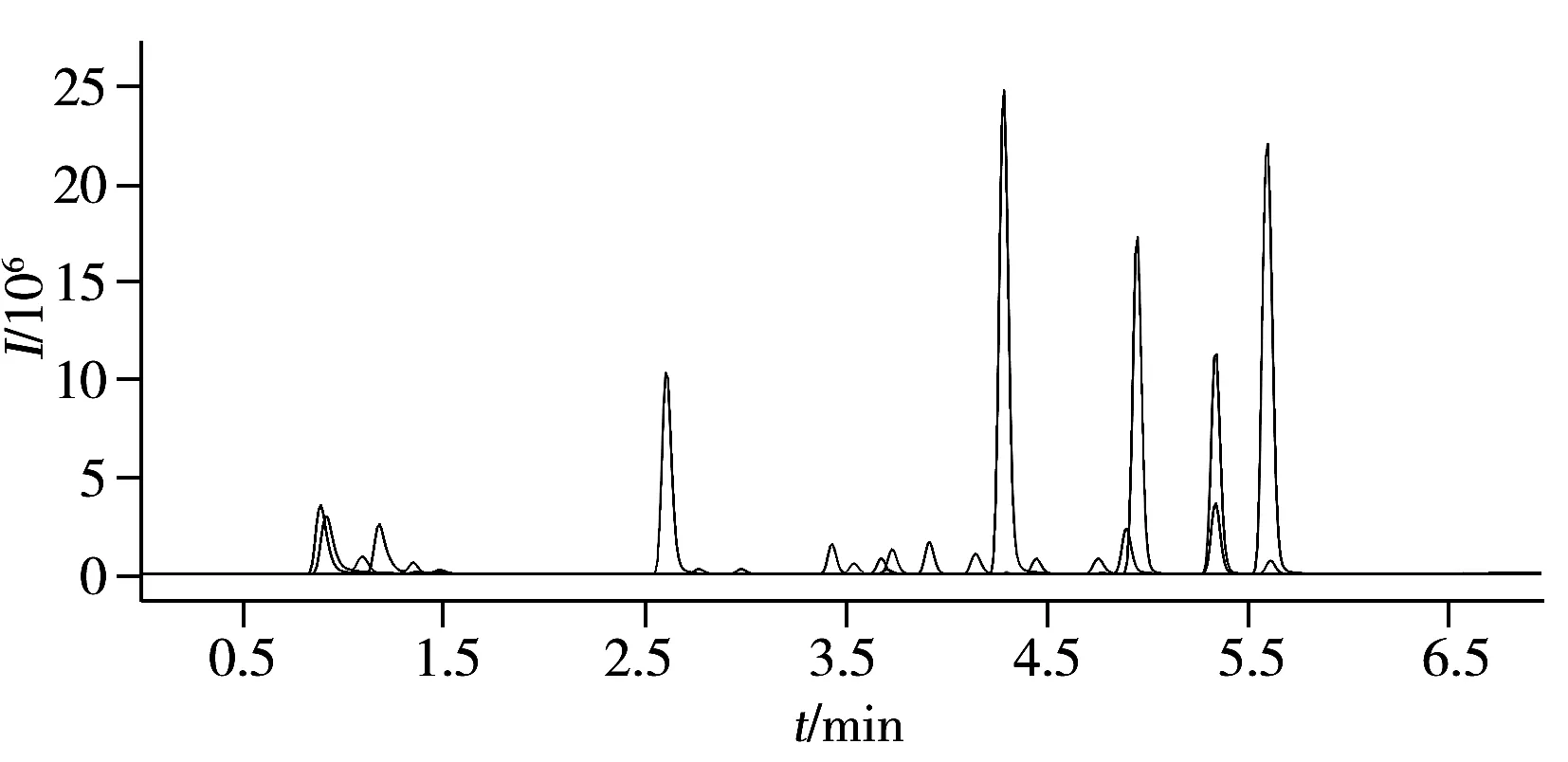
图1 MRM模式下23种植物生长调节剂混合标准溶液(0.05 mg/L)的总离子流色谱图Fig.1 Total ion chromatogram of the 23 plant growth regulators mixed standard(0.05 mg/L) in MRM mode
2 结果与讨论
2.1 质谱条件的优化
同时建立正负离子两种扫描模式,分别对1 mg/L的各待测物单标准溶液进行一级全扫描,得到丰度较高且稳定的母离子。利用仪器自动优化功能,筛选二级碎片离子信息,获得碎片离子和碰撞能量(CE),并将母离子和2个信号较强的子离子组成监测离子对,23种PGRs的最佳MRM检测参数见表1,MRM色谱图见图1。
2.2 色谱条件的优化
对比了甲醇、乙腈作为有机相与0.1%甲酸溶液和5 mmol/L乙酸铵溶液作为水相时,不同流动相组成对待测化合物峰形及离子化效率的影响。结果表明,以乙腈作为有机相时,各待测化合物的响应好,灵敏度高。0.1%甲酸溶液作为水相时可以促进目标化合物的保留、分离,并能改善峰形,加入5 mmol/L乙酸铵后芸苔素内酯出峰不理想,羟烯腺嘌呤的峰拖尾严重。因此,本研究采用0.1%甲酸-乙腈作为流动相。
2.3 提取溶剂的选择
考察了甲醇、乙腈、含1%乙酸的乙腈、含1%乙酸的甲醇、含2%乙酸的乙腈、含1%氢氧化钠(1 mol/L)的乙腈溶液作为溶剂的提取效果。结果表明,当提取溶剂为含1%乙酸的乙腈时提取效果优于其他5种提取溶剂:矮壮素、DPC的回收率为60%左右,其余21种植物生长调节剂的回收率均大于70%。故最终选择含1%乙酸的乙腈作为提取溶剂。
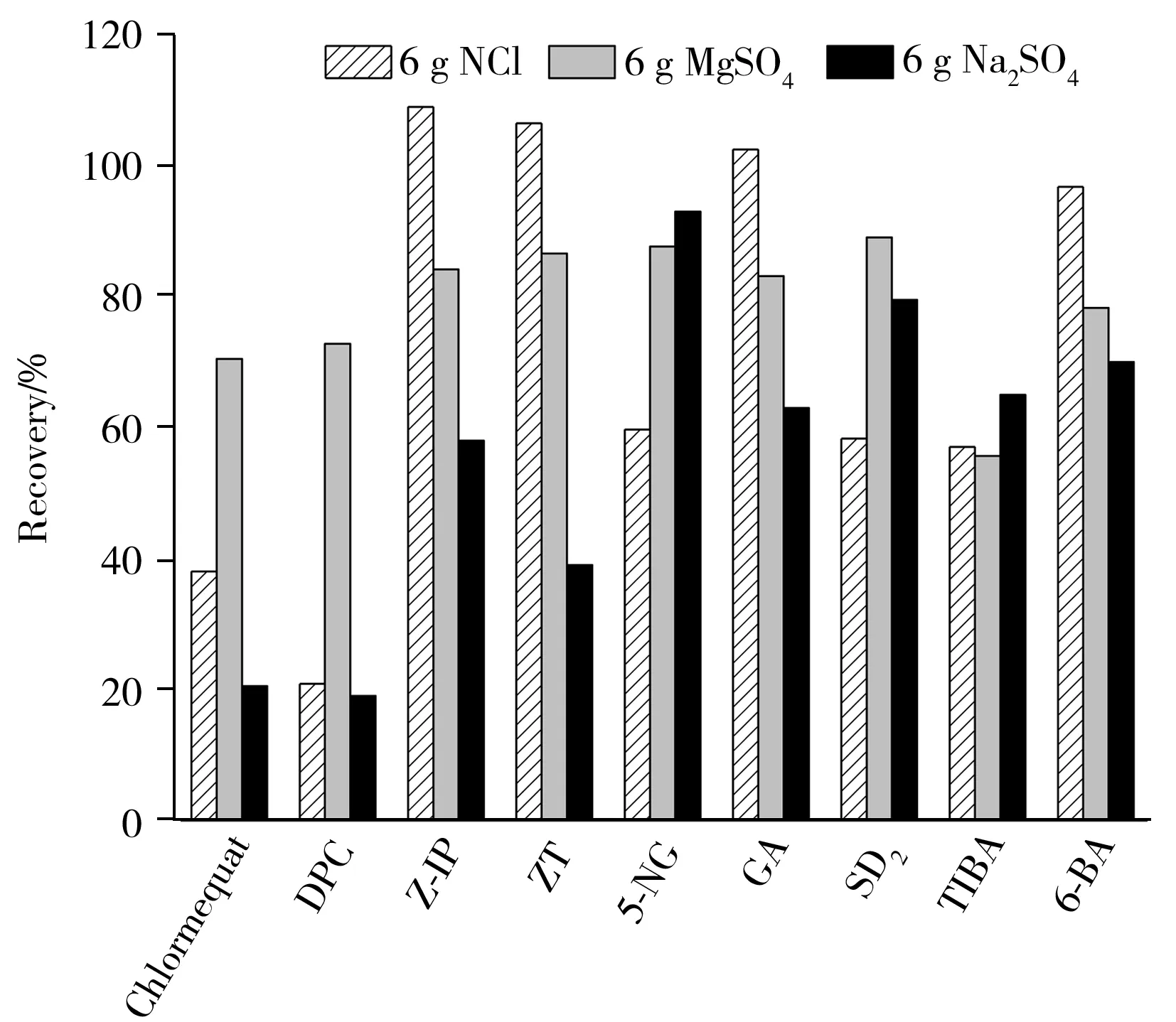
图2 9种植物生长调节剂在3种提取盐中回收率的比较(添加0.1 mg/kg)Fig.2 Comparision of recoveries of three agents on 9 plant growth regulators spiked with 0.1 mg/kg
2.4 提取盐的选择
由于蔬菜含水量较大,需加入一定量的盐用于盐析和除水,常用的脱水剂为无水硫酸镁和无水硫酸钠,盐析剂为氯化钠。分别使用6 g氯化钠、无水硫酸镁、无水硫酸钠作为提取盐进行对比,选取对提取盐敏感的9种PGRs做图,结果见图2。提取盐为硫酸钠时,带季铵盐结构的强极性化合物矮壮素、DPC的回收率均低于25%,嘌呤结构的化合物(Z-IP、ZT、6-BA)回收率为50%左右;提取盐为氯化钠时,矮壮素、DPC的回收率均低于35%,5-NG、SD2、TIBA为60%左右,而其余18种PGRs的回收率均大于90%;提取盐为硫酸镁时,平均回收率为83.3%,TIBA的回收率为55%,其余22种化合物的回收率为70.5%~93.9%。可见在提取盐不同的情况下,不同化学结构植物生长调节剂的回收率有显著差异。为获得最佳提取效果,本文选取无水硫酸镁和氯化钠作为提取盐,并对其用量进行了优化。
首先考察了硫酸镁用量(4~8 g)对回收率的影响,结果表明当硫酸镁用量≥6 g时,各PGRs的回收率无明显增加,大于7 g时,各PGRs的回收率反而下降,可能是过多盐的吸附作用所致,故确定硫酸镁的用量为6 g。在6 g硫酸镁的基础上,考察了氯化钠用量对回收率的影响,结果显示,随着氯化钠用量(0~4 g)的增加,矮壮素、DPC的回收率明显降低,当氯化钠用量为1 g时,其他21种化合物的回收率增高,其中TIBA回收率增高明显,由55%上升到80%。随着氯化钠用量的增加,ZT和TIBA的回收率下降。综合考虑,选取6 g无水硫酸镁和1 g氯化钠作为提取盐,此时矮壮素、缩节胺的回收率为60%左右,其余21种PGRs的回收率均大于70%,平均回收率为91.3%。
2.5 缓冲盐的选择
在提取净化分析过程中,不同蔬菜基质的pH值均不相同,而某些化合物对酸碱度非常敏感,采用乙酸盐缓冲液提取可使样品提取液pH值大约为4.0~5.0,采用柠檬酸缓冲盐体系可使pH值为5.0~5.5,优化缓冲盐体系的pH值可提高并稳定对酸碱敏感化合物的回收率[16]。因此本文比较了无缓冲盐和两种缓冲盐体系下PGRs的回收率情况。方法1采用6 g硫酸镁+1 g氯化钠提取,方法2采用6 g硫酸镁+1 g氯化钠+1.5 g乙酸钠组成的乙酸-乙酸钠缓冲液体系提取,方法3采用6 g硫酸镁+1 g氯化钠+1 g柠檬酸钠+0.5 g柠檬酸二钠组成的乙酸-柠檬酸钠缓冲液体系提取。对比3种方法的提取回收率发现,含羧酸结构的化合物(如IBA、IAA、2,4-D等)在乙酸钠缓冲体系中的回收率明显下降,大部分PGRs在无缓冲盐体系和柠檬酸钠缓冲体系中稳定。比较23种化合物的平均回收率,方法1为89.1%,方法2为79.1%,方法3为87.0%,考虑操作简易性,本研究选择不添加缓冲盐。
2.6 基质效应
基质效应(ME)指目标测定物以外的其余组分对测定结果的影响,即基质对分析方法准确性的干扰,通常有基质增强和基质抑制两种表现形式[17],当采用电喷雾离子源时,通常表现为基质抑制效应[18]。本研究考察了不同浓度23种植物生长调节剂在基质和试剂中的响应情况,分别以峰面积对质量浓度绘制标准曲线,比较两条标准曲线的斜率,从而判断基质效应的强弱。计算公式如下:ME=基质标准曲线斜率/溶剂标准曲线斜率[19]。当ME为0.85~1.15时,基质效应较弱;当ME大于1.15 时,存在较强的基质增强效应;当ME小于0.85 时,存在较强的基质抑制效应[18]。实验结果表明,同一植物生长调节剂在不同蔬菜的基质效应不同,如矮壮素在黄瓜中基本无基质效应,但在茄子和豆芽中存在基质抑制效应(见表2)。为消除基质效应的影响,使定量结果更准确,本方法最终采用基质匹配外标校准曲线对样品中的农药残留进行定量,以抵消基质效应的影响。
2.7 方法学考察
2.7.1方法的线性与定量下限用空白样品基质的提取液(按“1.3”制备)准确配制质量浓度为0.5~250 μg/L的23种植物生长调节剂混合标准溶液,按“1.4”方法进行测定,以峰面积(y)为纵坐标,相应的质量浓度(x,μg/L)为横坐标绘制标准曲线,23种植物生长调节剂在4种蔬菜基质中线性关系较好,相关系数(r2)均大于0.98。以10 倍信噪比(S/N=10)计算得本方法的定量下限(LOQ)为1~50 μg/kg(见表2),远低于国内外的现行残留标准。
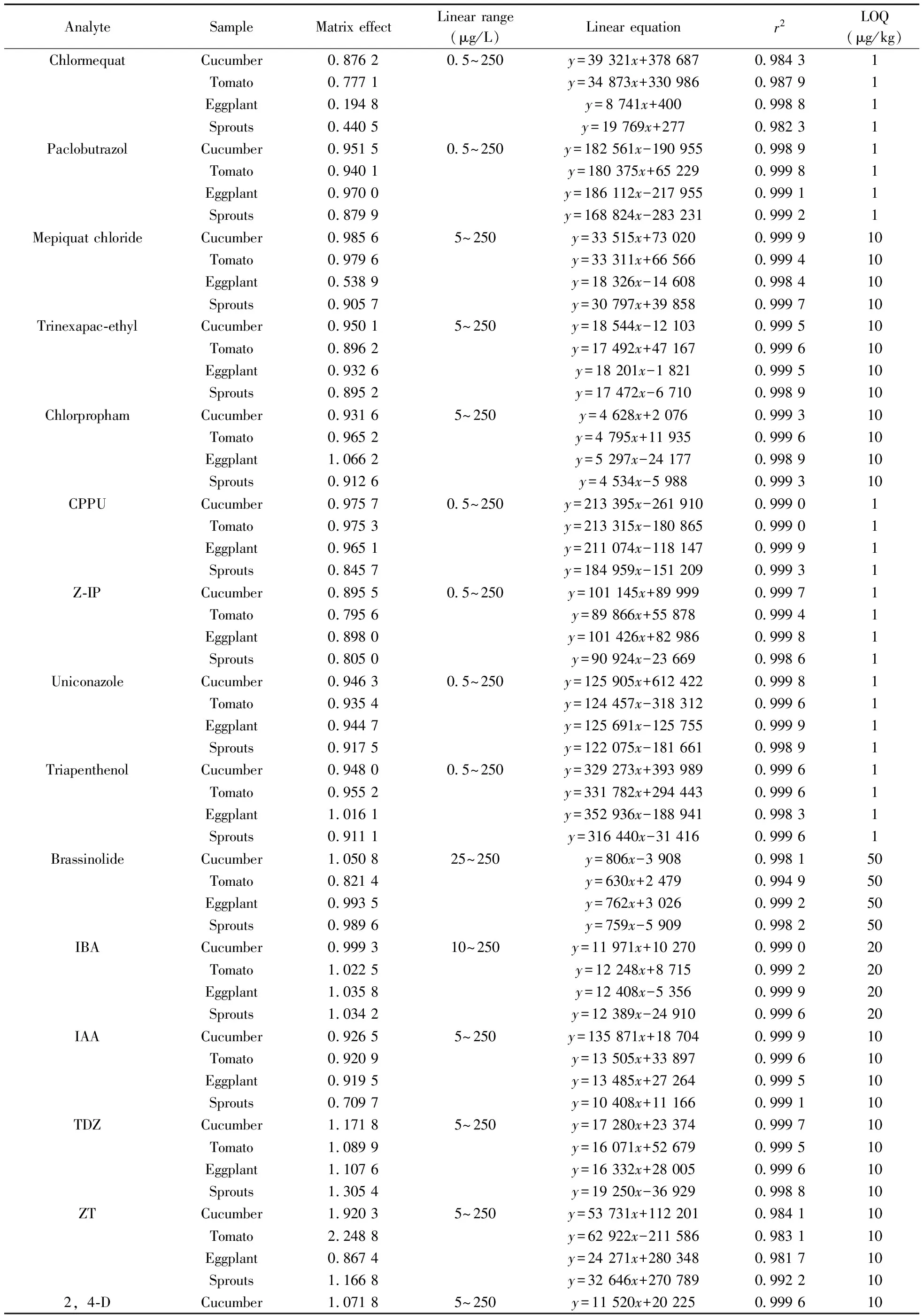
表2 23种植物生长调节剂的基质效应、线性范围、线性方程、相关系数(r2)和定量下限Table 2 Matrix effects,linear ranges,linear equations,correlation coefficients(r2) and LOQs of 23 plant growth regulators
(续表2)
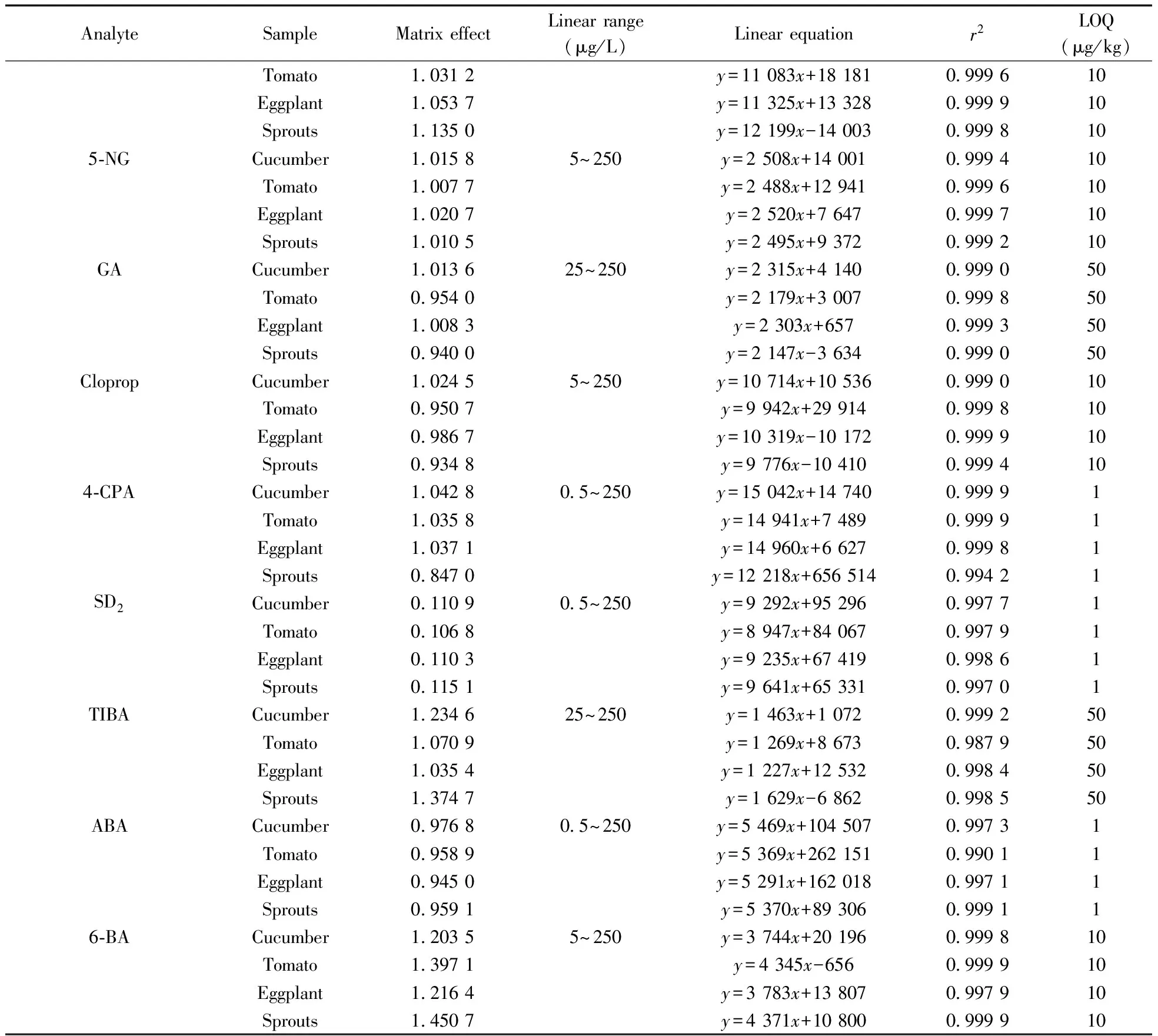
AnalyteSampleMatrixeffectLinearrange(μg/L)Linearequationr2LOQ(μg/kg)Tomato1 0312y=11083x+181810 999610Eggplant1 0537y=11325x+133280 999910Sprouts1 1350y=12199x-140030 9998105⁃NGCucumber1 01585~250y=2508x+140010 999410Tomato1 0077y=2488x+129410 999610Eggplant1 0207y=2520x+76470 999710Sprouts1 0105y=2495x+93720 999210GACucumber1 013625~250y=2315x+41400 999050Tomato0 9540y=2179x+30070 999850Eggplant1 0083y=2303x+6570 999350Sprouts0 9400y=2147x-36340 999050ClopropCucumber1 02455~250y=10714x+105360 999010Tomato0 9507y=9942x+299140 999810Eggplant0 9867y=10319x-101720 999910Sprouts0 9348y=9776x-104100 9994104⁃CPACucumber1 04280 5~250y=15042x+147400 99991Tomato1 0358y=14941x+74890 99991Eggplant1 0371y=14960x+66270 99981Sprouts0 8470y=12218x+6565140 99421SD2Cucumber0 11090 5~250y=9292x+952960 99771Tomato0 1068y=8947x+840670 99791Eggplant0 1103y=9235x+674190 99861Sprouts0 1151y=9641x+653310 99701TIBACucumber1 234625~250y=1463x+10720 999250Tomato1 0709y=1269x+86730 987950Eggplant1 0354y=1227x+125320 998450Sprouts1 3747y=1629x-68620 998550ABACucumber0 97680 5~250y=5469x+1045070 99731Tomato0 9589y=5369x+2621510 99011Eggplant0 9450y=5291x+1620180 99711Sprouts0 9591y=5370x+893060 999116⁃BACucumber1 20355~250y=3744x+201960 999810Tomato1 3971y=4345x-6560 999910Eggplant1 2164y=3783x+138070 997910Sprouts1 4507y=4371x+108000 999910
2.7.2方法的准确度与精密度对4种蔬菜样品进行低、中、高3个加标水平的回收率和精密度实验,按“1.3”的方法进行样品前处理,每个加标水平做6个平行样品,结果见表3。在3个加标水平下矮壮素、缩节胺的回收率为50.5%~73.7%,其余21种植物生长调节剂的平均回收率为70.2%~125.6%,RSD为0.7%~22.5%。
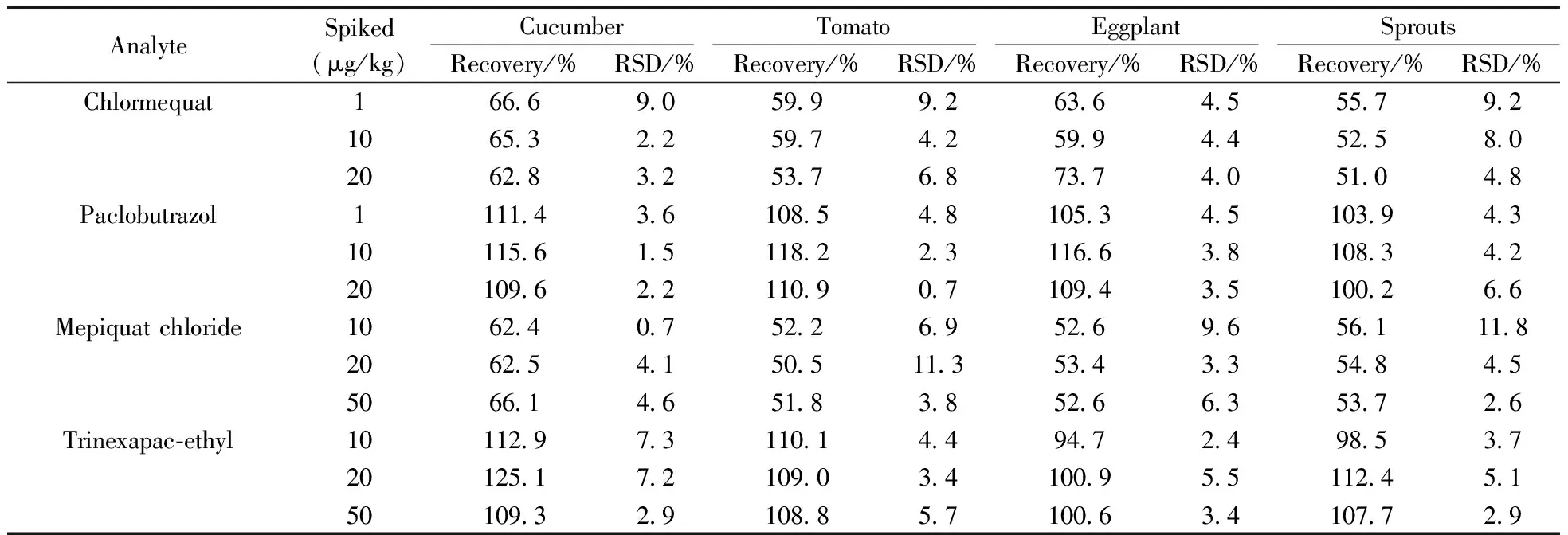
表3 23种植物生长调节剂在蔬菜基质中的加标回收率和相对标准偏差(RSD)(n=6)Table 3 Spiked recoveries and relative standard deviations(RSDs) of 23 plant growth regulators in vegetables(n=6)
(续表3)
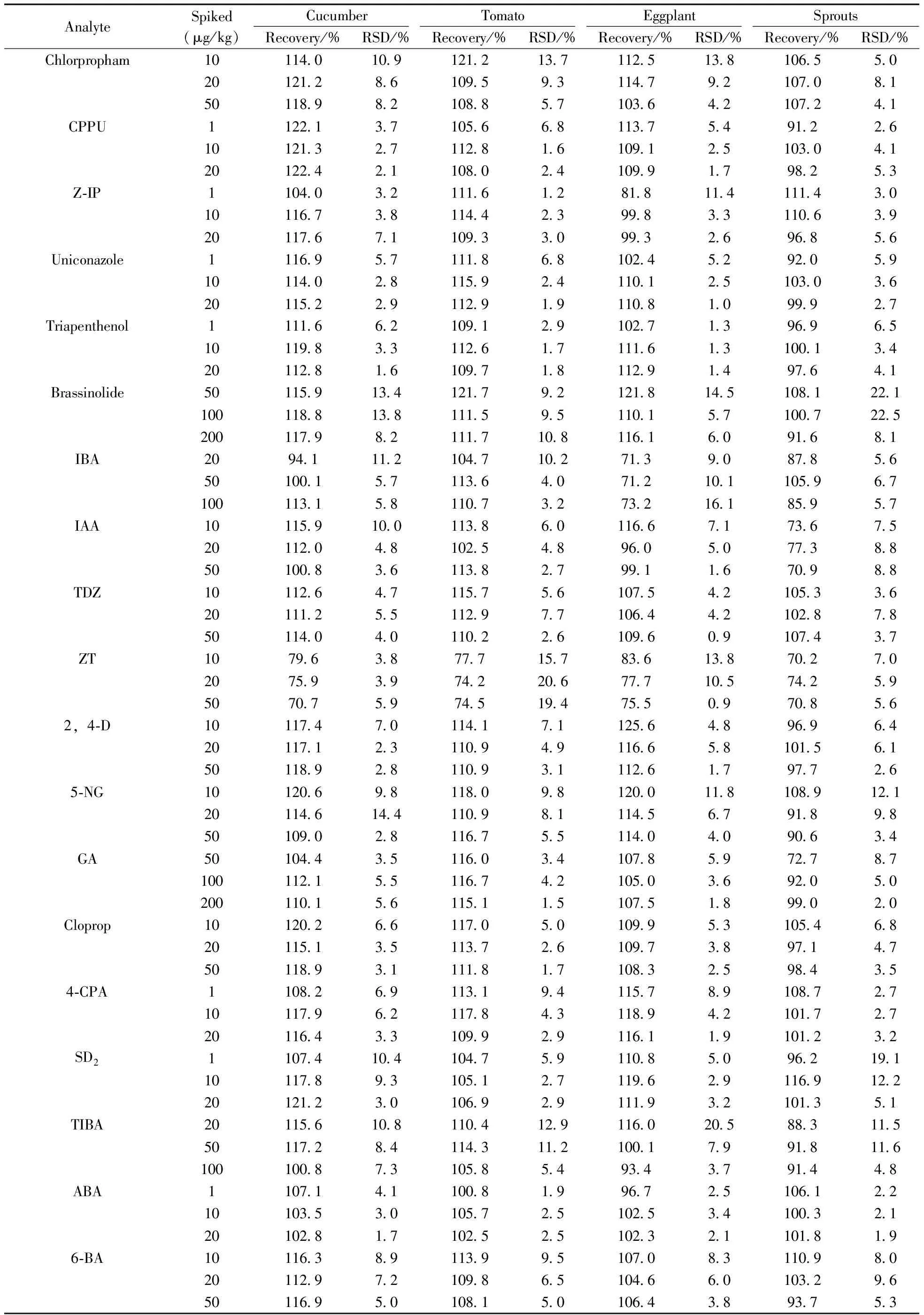
AnalyteSpiked(μg/kg)CucumberTomatoEggplantSproutsRecovery/%RSD/%Recovery/%RSD/%Recovery/%RSD/%Recovery/%RSD/%Chlorpropham10114 010 9121 213 7112 513 8106 55 020121 28 6109 59 3114 79 2107 08 150118 98 2108 85 7103 64 2107 24 1CPPU1122 13 7105 66 8113 75 491 22 610121 32 7112 81 6109 12 5103 04 120122 42 1108 02 4109 91 798 25 3Z⁃IP1104 03 2111 61 281 811 4111 43 010116 73 8114 42 399 83 3110 63 920117 67 1109 33 099 32 696 85 6Uniconazole1116 95 7111 86 8102 45 292 05 910114 02 8115 92 4110 12 5103 03 620115 22 9112 91 9110 81 099 92 7Triapenthenol1111 66 2109 12 9102 71 396 96 510119 83 3112 61 7111 61 3100 13 420112 81 6109 71 8112 91 497 64 1Brassinolide50115 913 4121 79 2121 814 5108 122 1100118 813 8111 59 5110 15 7100 722 5200117 98 2111 710 8116 16 091 68 1IBA2094 111 2104 710 271 39 087 85 650100 15 7113 64 071 210 1105 96 7100113 15 8110 73 273 216 185 95 7IAA10115 910 0113 86 0116 67 173 67 520112 04 8102 54 896 05 077 38 850100 83 6113 82 799 11 670 98 8TDZ10112 64 7115 75 6107 54 2105 33 620111 25 5112 97 7106 44 2102 87 850114 04 0110 22 6109 60 9107 43 7ZT1079 63 877 715 783 613 870 27 02075 93 974 220 677 710 574 25 95070 75 974 519 475 50 970 85 62,4⁃D10117 47 0114 17 1125 64 896 96 420117 12 3110 94 9116 65 8101 56 150118 92 8110 93 1112 61 797 72 65⁃NG10120 69 8118 09 8120 011 8108 912 120114 614 4110 98 1114 56 791 89 850109 02 8116 75 5114 04 090 63 4GA50104 43 5116 03 4107 85 972 78 7100112 15 5116 74 2105 03 692 05 0200110 15 6115 11 5107 51 899 02 0Cloprop10120 26 6117 05 0109 95 3105 46 820115 13 5113 72 6109 73 897 14 750118 93 1111 81 7108 32 598 43 54⁃CPA1108 26 9113 19 4115 78 9108 72 710117 96 2117 84 3118 94 2101 72 720116 43 3109 92 9116 11 9101 23 2SD21107 410 4104 75 9110 85 096 219 110117 89 3105 12 7119 62 9116 912 220121 23 0106 92 9111 93 2101 35 1TIBA20115 610 8110 412 9116 020 588 311 550117 28 4114 311 2100 17 991 811 6100100 87 3105 85 493 43 791 44 8ABA1107 14 1100 81 996 72 5106 12 210103 53 0105 72 5102 53 4100 32 120102 81 7102 52 5102 32 1101 81 96⁃BA10116 38 9113 99 5107 08 3110 98 020112 97 2109 86 5104 66 0103 29 650116 95 0108 15 0106 43 893 75 3
2.8 实际样品的测定
应用所建立的分析方法对87份蔬菜样品进行23种植物生长调节剂的快速筛查检测,结果见表4。结果表明,使用本法能准确可靠地检测植物生长调节剂,可显著提高蔬菜中植物生长调节剂安全风险的监控水平。
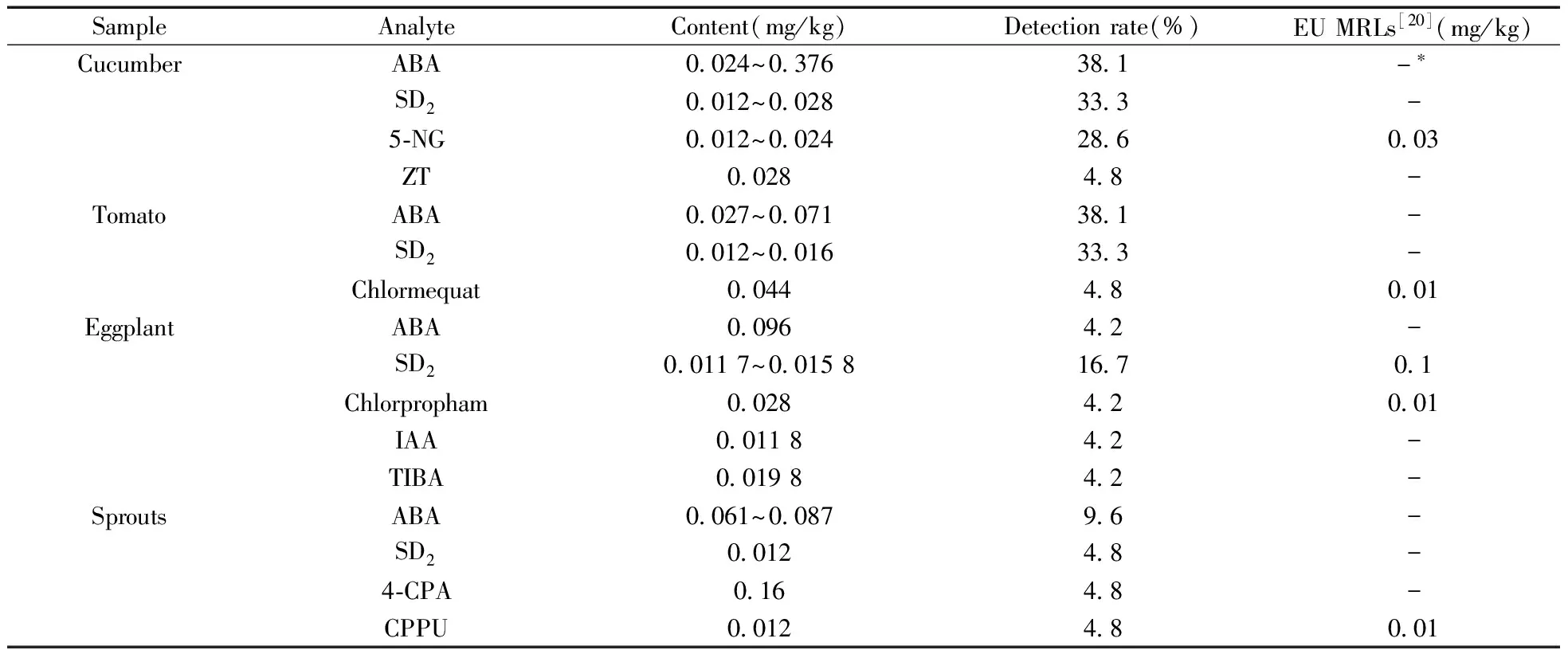
表4 实际蔬菜样品中23种植物生长调节剂的快速筛查结果Table 4 Rapid screening results of 23 plant growth regulators in vegetable samples
*no data
3 结 论
本文采用UHPLC-MS/MS技术建立了同时定性和定量分析蔬菜中23种植物生长调节剂残留的快速检测方法。样品经提取后无需净化,缩短了样品前处理的时间,高效经济。该方法简便、快速、准确、灵敏度高,适合于大批量蔬菜样品中植物生长调节剂残留的快速定性筛查和准确定量。
参考文献:
[1] Shi X M,Jin,F,Huang Y T,Du X M,Li C M,Wang M,Shao H,Jin M J,Wang J.J.Agric.FoodChem.,2012,60(1):60-65.
[2] Pei H R,Li W,Zhang L,Wu L,Guo Z R.ShandongAgric.Sci.(裴海荣,李伟,张蕾,武磊,郭宗端.山东农业科学),2015,47(7):142-146.
[3] Zhu L,Wang C,Chen H P,Zhang Y B,Zhou S J,Wang G Q,Liu X.Chin.J.Anal.Chem.(诸力,王晨,陈红平,张颖彬,周苏娟,王国庆,刘新.分析化学),2017,45(4):529-536.
[4] Hao J,Jiang J,Mao T,Sun X D,Yang L M,Zhang Z H,Cui F Y.FoodSci.(郝杰,姜洁,毛婷,孙晓冬,杨丽梅,张朝晖,崔凤云.食品科学),2018,39(8):267-275.
[5] Hu J Y,Deng Z B,Qin D M.Bull.Environ.Contam.Toxicol.,2009,83(6):803-807.
[6] Wu P G,Tan Y,Zhang J,Wang L Y,Tang W,Jiang W,Pan X D,Ma B J,Ni Z N,Wang T J.Chin.J.Anal.Chem.(吴平谷,谭莹,张晶,王立媛,汤望,姜维,潘晓东,马冰洁,倪竹南,王天娇.分析化学),2014,42(6):866-871.
[7] Zhang W H,Xie W,Hou J B,Tong Y K,Lu S,Wang P.J.Instrum.Anal.(张文华,谢文,侯建波,童赟恺,陆顺,汪鹏.分析测试学报),2016,35(10):1241-1247.
[8] Pu C H,Lin S K,Chuang W C,Shyu T H.J.FoodDrugAnal.,2018,26(2):637-648.
[9] Ma L Y,Zhang H Y,Xu W T,He X Y,Yang L L,Luo Y B,Huang K L.FoodAnal.Methods,2013,6(3):941-951.
[10] Liu B L,Xie J A,Zhao Z W,Wang X L,Shan X M.J.Instrum.Anal.(刘柏林,谢继安,赵紫微,王秀莉,单晓梅.分析测试学报),2017,36(5):601-606.
[11] Mou Y L,Guo D H,Ding Z P.J.Instrum.Anal.(牟艳莉,郭德华,丁卓平.分析测试学报),2013,32(8):935-940.
[12] Zhong L L,Hu L,Guo L A,Lei S R,Mao J F,Li X,Ouyang H X.J.Instrum.Anal.(仲伶俐,胡莉,郭灵安,雷绍荣,毛建霏,李曦,欧阳华学.分析测试学报),2016,35(4):466-470.
[13] Li L H,Zheng L.Chin.J.Anal.Lab.(李丽华,郑玲.分析试验室),2007,26(12):287-289.
[14] Huang H H,Zhang J,Xu D M,Zhou Y,Luo J,Lü M L,Chen S B,Wang L Z.Chin.J.Chromatogr.(黄何何,张缙,徐敦明,周昱,罗佳,吕美玲,陈树宾,王连珠.色谱),2014,32(7):707-716.
[15] Zhang L W,Jiao G R,Wang K,Liu C.J.FoodSaf.Qual.(张泸文,焦广睿,王柯,刘畅.食品安全质量检测学报),2016,7(7):2677-2689.
[16] Ma Z L,Zhao W,Li L Y,Zheng S N,Lin H,Zhang Y G,Gao Q Z,Liu S.Chin.J.Chromatogr.(马智玲,赵文,李凌云,郑姝宁,林桓,张延国,高青珍,刘肃.色谱),2013,31(3):228-239.
[17] Xiang P,Shen M,Zhuo X Y.J.Instrum.Anal.(向平,沈敏,卓先义.分析测试学报),2009,28(6):753-756.
[18] Liu Y Q,Liu S,Xu W J,Tian G L,Zhang J L.Chin.J.Chromatogr.(刘永强,刘胜,许文娟,田国宁,张金玲.色谱),2017,35(9):941-948.
[19] Wang L Q,He L M,Zeng Z L,Chen J X.J.Chin.MassSpectrom.Soc.(王立琦,贺利民,曾振灵,陈建新.质谱学报),2011,32(6):321-332.
[20] European Commission.EU Pesticide database.[2017-12-29].http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database.
