窄带光谱成像膀胱软镜与白光膀胱硬镜在非肌层浸润性膀胱癌术后随访中的应用比较
2018-07-06袁谦张凌汪青蓉肖克峰
袁谦 张凌 汪青蓉 肖克峰
1深圳市人民医院泌尿外科 深圳市泌尿外科微创工程中心 518020 广东深圳
白光成像(white-light imaging, WLI)膀胱硬镜已经使用了100多年的时间,这类传统内镜系统检查时患者疼痛较为明显;而且其成像鉴别力受限于人类肉眼鉴别力,难以发现微小病变及原位癌,是术后肿瘤复发的可能因素之一。 窄带光谱成像(narrow-band imaging, NBI)膀胱软镜技术是目前应用于膀胱病变检查最先进的技术。 首先用可弯曲的复合材料替代坚硬的金属材料,在增加可视角度的同时减轻了患者疼痛;其次采用窄带蓝、绿光替代白光成像,增加了图像的鉴别力,更易于发现微小病变及原位癌 。本研究通过回顾性分析我中心2014~2016年行TURBT并获随访镜检的患者资料,评估NBI膀胱软镜在非肌层浸润性膀胱癌术后随访中的应用价值。
1 资料与方法
1.1 临床资料
回顾本中心2014年1月~2016年12月进行膀胱镜检查并有手术记录以及病理报告的患者资料,按照如下标准选取资料进行分析,纳入标准: 接受了标准的TURBT术,病理诊断为Ta或T1期乳头状尿路上皮癌,术后采用我中心标准的膀胱灌注化疗方案。排除标准: 合并有其余部位尿路上皮癌或者记录不完全,包括病理报告中未描述肌层;镜检报告对病变部位、大小描述不清的。
标准的TURBT术要求为:深度至深肌层,边缘距肿瘤边缘0.5 cm,术后对肿瘤基底部及边缘均进行“冷活检”。
1.2 膀胱灌注化疗方案
采用吡柔比星30 mg或表柔比星50 mg,术后1 h内即刻灌注,此后每周一次共8周,再后每月一次共8个月。吡柔比星灌注出现严重化学性膀胱炎的患者改用表柔比星进行灌注,若仍不能耐受的患者采用表柔比星30 mg进行灌注。
1.3 膀胱镜随访方案
膀胱镜首次复查时间为术后第1个月,此后2年内病理为高级别的患者每3个月复查,低级别的患者每6个月复查;5年后高级别的患者每6个月复查,低级别的患者每年复查,直至终身。
1.4 统计学方法
分级资料的比较采用卡方检验。正态分布的连续数据资料采用t检验。偏态分布的连续数据资料采用wilcoxon秩和检验。统计软件采用开源软件R语言,版本 3.2.3。P<0.05为差异有统计学意义。
2 结果
总共纳入165份膀胱镜检记录进行分析,包括51例(82例次)的NBI膀胱软镜检查,46例(83例次)的WLI膀胱硬镜检查,所有镜检均由主治以上职称的泌尿外科医生施行。
NBI软镜组患者与WLI硬镜组患者的基本资料及手术病理结果比较见表1,NBI软镜组患者的年龄、性别、病变多发性与WLI硬镜组均有显著性差异。
NBI软镜组与WLI硬镜组复查镜检的比较见表2,两组患者的镜检复查时间(按术后第n月计算)由于呈偏态分布,采用median(q15,q75)表示。两组患者复查时间没有显著性差异,NBI软镜组复查时间中位数为术后13个月,WLI硬镜组为11个月。NBI软镜组共进行了13例次活检,活检部位三角区1例次、顶壁3例次、前壁5例次、侧壁4例次。WLI硬镜组共进行了4例次活检,活检部位三角区1例次、顶壁2例次、侧壁1例次。NBI软镜组的活检例次要明显多于WLI硬镜组,而且NBI软镜组在前壁发现可疑病变的例数明显多于WLI硬镜组。但两组病理复发的例次没有显著性差异,NBI软镜组为5例次,WLI硬镜组为3例次。NBI软镜组复发率为7.8%,镜检假阳性率为10.4%。WLI硬镜组复发率为6.5%,镜检假阳性率为1.2%。
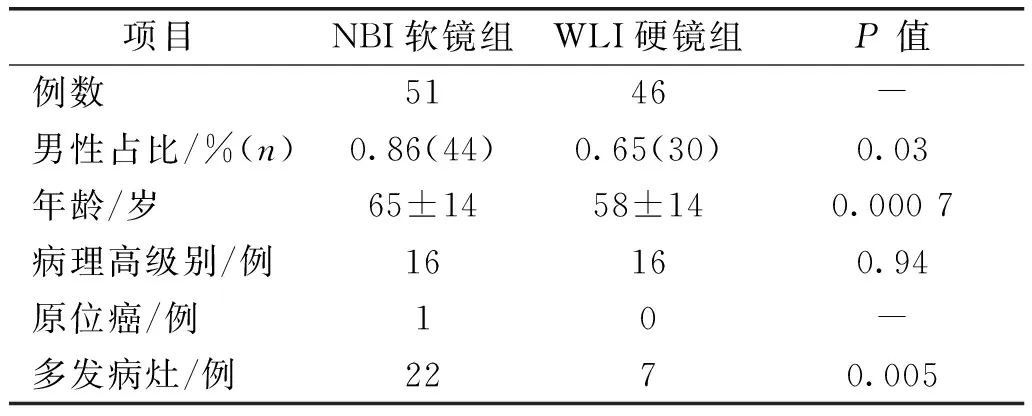
表1 两组患者基本资料比较

表2 两组镜检结果比较
3 讨论
相较于传统的膀胱硬镜,膀胱软镜具有可视角度大、患者痛苦小的优点。 膀胱软镜于上世纪80年代应用于临床。早期的纤维软镜成像质量差、视野狭窄、价格昂贵,并未受到临床医生的欢迎。随着电子软镜的推出,成像质量及视野得到了很大改善[1]。由于膀胱软镜镜头可弯曲,没有检查死角[2],能够观察到传统70°硬镜难以发现的位于膀胱前壁接近颈部的病变。 本研究中,软镜检查发现异常的13例次中有5例次位于前壁,而硬镜检查没有发现位于前壁的病变,这进一步证明了软镜的视角优势。同时软镜检查的痛苦显著小于硬镜检查。 近年来多中心随机对照研究表明,不论男性还是女性,在局麻下膀胱软镜检查的疼痛显著低于硬镜。男性患者术后尿频、尿道烧灼感更低[3~5]。 本研究软镜组中男性患者比例高达86%,也反映了在真实的临床实践中,医生和男性患者本人更倾向于膀胱软镜检查。
近年来膀胱镜成像技术的改进主要有荧光成像技术和NBI成像技术。 荧光成像技术需要提前将光敏剂灌入膀胱,受光漂白对诊断时间的限制。 NBI成像技术将白光过滤为蓝光(波长415 nm)和绿光(波长540 nm),在这个光谱范围的蓝绿光大部分被血红蛋白吸收,因此仅能穿过组织表层,增加了黏膜表层毛细血管和黏膜下血管网的可见性,进而增加了肿瘤组织和周围正常组织的对比,使得肿瘤组织更容易被发现[6, 7]。 NBI技术简便易行,更易于在门诊施行。 很多前瞻性研究表明NBI在进行膀胱肿瘤初检方面明显优于传统白光成像,能够发现更多的微小病灶或原位癌[6, 8]。 还有的前瞻性研究发现NBI能够加强非肌层浸润性膀胱癌复发的发现率[9]。 由本研究的患者特征比较可以看出,医生在选择检查方式时受到以上信息的影响,会产生明显的选择偏倚。在此次回顾性分析中,NBI软镜组男性患者的比例为86%,WLI硬镜组为65%,NBI软镜组患者的年龄中位数比WLI硬镜组大7岁,两组的性别和年龄均有显著性差异。 而且NBI软镜组多发病灶的病例数明显多于WLI硬镜组。 男性、高龄、多发都是膀胱癌复发的相关因素[10, 11]。 可以看出医生对于膀胱癌术后复发高危患者更倾向于建议NBI软镜检查。
Herr等[12]认为,NBI技术还存在着两个疑问:①NBI技术是否客观上能够增加膀胱癌病灶的发现率?②NBI技术是否导致了更高的假阳性率,造成患者进行了不必要的活检? 目前已报道的NBI与WLI进行比较的样本量最大的两项前瞻性研究采用的研究方法相似,都是同一病例先进行WLI膀胱软镜检查,再进行NBI膀胱软镜检查[8, 9]。这种研究方法虽然很好的避免了患者和病变的差异性,但同时也造成了观察者偏倚——NBI检查多发现的病灶可能是由于医生更仔细地进行了重复检查。因此,更合理的实验设计应该是将患者随机分为NBI和WLI两组,两组均仔细地进行两遍检查,才能有效地消除观察者偏倚。
本研究中,NBI软镜组镜下发现可疑病变进行活检的例次明显多于WLI硬镜组,NBI软镜组检查中约16%进行了活检,WLI硬镜组仅5%。这表明NBI软镜检查对病变的敏感度显著高于WLI硬镜。但是,在膀胱灌注化疗药物或卡介苗后,黏膜经常呈现炎性表现,NBI技术并不能有效区分炎性表现与微小肿瘤或原位癌,由于病变在镜下变得更为明显,增加了检查医生的疑虑,进而增加了活检概率,而这些活检并非都是必要的。本研究中,NBI软镜组13例次活检中确认5例次病理复发,发生在4例患者复查过程中。其中有1例最初病理为多发、高级别的患者发生了两次复发,相距1年,第一次复发位于前壁,第二次复发位于侧壁,因此可以排除漏诊。软镜组复发比率为7.8%,假阳性率为10.4%。WLI硬镜组4例次活检中确认3例次病理复发,分别发生于不同的患者,复发比率为6.5%,假阳性率为1.2%。由此看来,NBI软镜检查的假阳性率较高,患者接受了不必要的活检。
综上所述,膀胱软镜技术由于患者痛苦小,没有视野死角等优势,替代硬镜是必然趋势。 NBI技术比传统WLI检查敏感度高,同时假阳性率也较高,导致患者进行了不必要的活检。NBI技术仍需要进一步的改进,例如建立评分系统以明确NBI镜检时病理活检的指征。
[参考文献]
[1] Okhunov Z, Hruby GW, Mirabile G, et al. Prospective comparison of flexible fiberoptic and digital cystoscopes. Urology, 2009,74(2):427-430.
[2] Pavone-Macaluso M, Lamartina M, Pavone C, et al. The flexible cystoscope. Int Urol Nephrol, 1992,24(3):239-242.
[3] Greenstein A, Greenstein I, Senderovich S, et al. Is diagnostic cystoscopy painful? Analysis of 1,320 consecutive procedures. Int Braz J Urol, 2014,40(4):533-538.
[4] Seklehner S, Remzi M, Fajkovic H, et al. Prospective multi-institutional study analyzing pain perception of flexible and rigid cystoscopy in men. Urology, 2015,85(4):737-741.
[5] Quiroz LH, Shobeiri SA, Nihira MA, et al. Randomized trial comparing office flexible to rigid cystoscopy in women. Int Urogynecol J, 2012,23(11):1625-1630.
[6] Li K, Lin T, Fan X, et al. Diagnosis of narrow-band imaging in non-muscle-invasive bladder cancer: a systematic review and meta-analysis. Int J Urol, 2013,20(6):602-609.
[7] Zare R. Comparison of flexible blue light cystoscopy and rigid blue light cystoscopy in bladder cancer. Eur Urol Suppl, 2016,15(6):166.
[8] Chen G, Wang B, Li H, et al. Applying narrow-band imaging in complement with white-light imaging cystoscopy in the detection of urothelial carcinoma of the bladder. Urol Oncol, 2013,31(4):475-479.
[9] Herr HW, Donat SM. A comparison of white-light cystoscopy and narrow-band imaging cystoscopy to detect bladder tumour recurrences. BJU Int, 2008,102(9):1111-1114.
[10] Der HV, Witjes JA. Recurrence, Progression, and Follow-Up in Non-Muscle-Invasive bladder cancer. Eur Urol Suppl, 2009,8(7):556-562.
[11] Dobruch J, Daneshmand S, Fisch M, et al. Gender and bladder cancer: a collaborative review of etiology, biology, and outcomes. Eur Urol, 2016,69(2):300-310.
[12] Herr HW. Narrow-band imaging evaluation of bladder tumors. Curr Urol Rep, 2014,15(4):395.
