改性光催化剂的制备与表征及其在光芬顿中的应用*
2018-07-06刘金涛王宇晶张治宏
高 樱,刘金涛,王宇晶,房 剑,张治宏
(1.西安工业大学 建筑工程学院,西安 710021;2.西安工业大学 材料与化工学院,西安 710021)
随着社会工业化程度的提高,企业排出的废水中难降解有机物数量随之增加.针对现如今难降解废水的特点,高级氧化技术可以有效对其矿化至无机形态[1-4].其中,芬顿法是一种通过芬顿试剂Fe2+与H2O2持续反应,生成具有强氧化性的羟基自由基(·OH)的氧化技术[5-9].近年来,学者们发现将芬顿法与光、电、超声等联用,降解能力可以得到有效提升.此类芬顿法有效降低试剂的使用量,并提升降解效率[10].Chen等人发现改性的光芬顿系统可以完成对含酚废水和钻井废水的高效降解,同时拓宽了系统的可适用酸度范围[11].Liu等人设计一种新型双池电芬顿系统,实现了对邻苯二甲酸二甲酯(DMP)的高效降解,并拓宽了系统pH及实现铁离子的重复利用[12].
石墨相氮化碳作为无机半导体光催化剂,可以完成对太阳能到化学能的转化,将氧分子还原后与水分子反应生成过氧化氢.g-C3N4禁带宽度为2.7 eV,光波长为460 nm,合适的禁带宽度可以给上述反应提供能量.但是,g-C3N4仍然存在一些缺点:由于光生电子-空穴极易复合而导致降低的量子效率;禁带宽度不合适而导致的太阳能利用率低.Kofuji等人制备出改性光催化剂g-C3N4/PDI/rGO,极大地降低了光生电子-空穴对的复合,实现了高达0.2%的太阳能利用率[13].
文中以三聚氰胺和均苯四甲酸酐(PMDA)为
原料,通过固相热聚合法制备出不同掺比的改性光催化剂PI,通过SEM、TEM、XRD、FTIR、TG等其进行表征,并将光催化剂聚酰亚胺(PI)应用于光芬顿反应中,解决了光芬顿系统需要外加过氧化氢的问题,为光芬顿的广泛应用提供可能.实验中选择的污染物为罗丹明B,通过对污染物降解来比较PI与g-C3N4的催化能力差异,并研究不同pH下PI的最佳降解效率.通过添加乙二胺四乙酸二钠(EDTA-2NA)、叔丁醇(TBA)、对苯醌(PBA)等捕获剂来探索系统的降解机理.
1 实验部分
1.1 PI的制备
称取5 g三聚氰胺,在坩埚加盖子的半封闭环境中置于马弗炉加热至425 ℃,升温速率为8 ℃·min-1,保温时间为4 h,待马弗炉恢复室温时将坩埚取出,得到白色粉末状的蜜勒胺.取一定量蜜勒胺置于马弗炉内 加热至550 ℃,升温速率为8 ℃·min-1,保温时间为4 h,待马弗炉恢复室温时将坩埚取出,得到淡黄色粉末状的g-C3N4.反应过程如图1,将蜜勒胺与改性剂均苯四甲酸酐(PMDA)混合(比例为1∶1,1∶2,2∶1),取一定量放置于管式炉内加热至325 ℃, 升温速率为7 ℃·min-1,保温时间为4 h.待管式炉恢复室温时取出,得到淡黄色粉末状的PI.
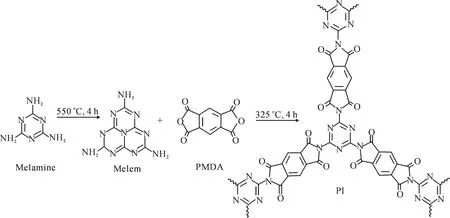
图1 PI的热聚合过程示意图
1.2 结构表征
电子扫描(SEM)采用菲利普公司的扫描电子显微镜(Quanta 400F)进行测定.电子透射(TEM)采用日本电子株式会社的透射电子显微镜(JEM-2010)进行测定,加速电压为200 KV,点分辨率为0.23 nm,配置GATAN 794 CCD型号相机.X射线衍射光谱(XRD)采用日本岛津公司的X射线衍射仪(XRD-6000)进行测定,其辐射源为CuKα,工作电压40 KV,管电流30 mA,扫描范围为10~60°,扫描速度为5 (°)·min-1.傅里叶变换红外(FT-IR)采用美国Thermo Nicolet公司的傅里叶红外光谱仪(Nexus)进行测定.热重分析(TG)采用瑞士梅特勒-托利多公司的热重及同步热分析仪(TGA/DSC1)进行测定,从室温下以10 ℃·min-1的速率升温至800 ℃.
1.3 催化活性探索
以250 W的汞钨混光灯为可见光光源,降解染料罗丹明B来完成对PI催化活性的探索.取40 mL的罗丹明B溶液(7 mg·L-1),加入0.1 g硫酸亚铁后磁力搅拌5 min.静置后在室温、常压条件,鼓入氧气速率1.5 L·min-1,外加光源照射下每隔一定时间取样,用紫外-可见光分光光度计在吸收峰554 mn处测其吸光度.将数据进行反应动力学拟合,方程为-ln(C/C0)=kt(C与C0代表任意时刻t和初始时刻t0罗丹明B的浓度),若关于-ln(C/C0)和t的线性方程成立,那么直线的斜率即为速率常数k.以丁叔醇、聚乙醇胺为自由基和空穴捕获剂来研究催化剂作用的反应机理.
2 结果与讨论
2.1 催化剂的表征
由高温-烧结法制备的g-C3N4与PI样品如图2所示.图2(a)中g-C3N4样品为淡黄色粉末, 图2b)中的 PI为黄色粉末,颜色深于g-C3N4.通过扫描电镜(SEM)来观察材料的表面形貌,图3为图2分别为PI 的SEM和TEM图.图3(a)、图3(b)是PI(1∶2)的SEM图,图3(a)工作电压为10 kV,图3(b)工作电压为3 kV,分别放大了20 000倍和8 000倍.从图3(a)中可以看到PI的层状叠落结构,任意层形状不规则.而图3(b)中可以看出PI(1∶2)的层间距大约为50 nm左右,层与层间排列规矩有序,规整的层状结构保证了PI较大的比表面积,从而在光催化反应中有足够的吸附能力和电子附着点的提供.为进一步广解复合材料的结构,对材料进行了分辨透射电镜表征(TEM),图3(c)、3(d)是PI(1∶2)的TEM图,由图可以清晰地看出PI的片状结构,边缘处浅色部分为单层结构,中心深色部分为层状堆叠.

图2 g-C3N4与PI的外观
为了进一步说明PI确实形成,对样品进行了X射线衍射测试.图4是g-C3N4、PI(1∶2)和蜜勒胺的XRD谱图.从图4中可以看出,g-C3N4在27.5出现一条衍射峰,该峰对应的晶面间距d=0.326 nm,与g-C3N4(002)晶面的特征峰相对应,表明样品类石墨材料的层内堆积.相比g-C3N4,PI在30°左右出现了一条明显的新峰,该峰对应的是二维结构之间约为0.3 nm的层间距,说明PI样品二维层状结构的形成.与蜜勒胺相比,PI在18°左右出现明显的衍射峰,该峰对应PI的特征峰.此外,π-π键共轭使得PI的高分子链较有规律,结晶度较好,没有杂质.
图5为g-C3N4和PI在Ar氛围下的热重图.由图5可以看出,在550 ℃之前g-C3N4都能够保持很好的结构稳定性,560 ℃后开始分解,直至740 ℃时g-C3N4完全分解,这说明了其具有较高的热稳定性.PI在加热至350 ℃的过程中,没有明显的失重.而在360 ℃到400 ℃之间有一个明显的热失重台阶,这与相关文献上DSC曲线上中心位于422°的吸热峰相对应[14],从而说明这是因为聚酰亚胺结构的热分解引起的.

图3 PI的SEM、TEM图
Fig.3 SEM and TEM images of PI

图4 PI、g-C3N4、melem的XRD图谱
图6为PI(1:2)的红外光谱图,图中有四个较明显的PI的特征吸收峰,位置如图示.1772,1725和725 cm-1为五元酰亚胺环上的C=O的非对称收缩,对称收缩和弯曲振动吸收峰;1376 cm-1处

图5 g-C3N4、PI在氩气中的TG图
得到吸收峰对应于五元酰亚胺环上的C-N伸缩振动吸收峰,这进一步说明制备的材料为PI.此外,在PI中没有发现明显的酸酐的吸收峰(1 850 cm-1附近),表明酰亚胺化反应完全进行.
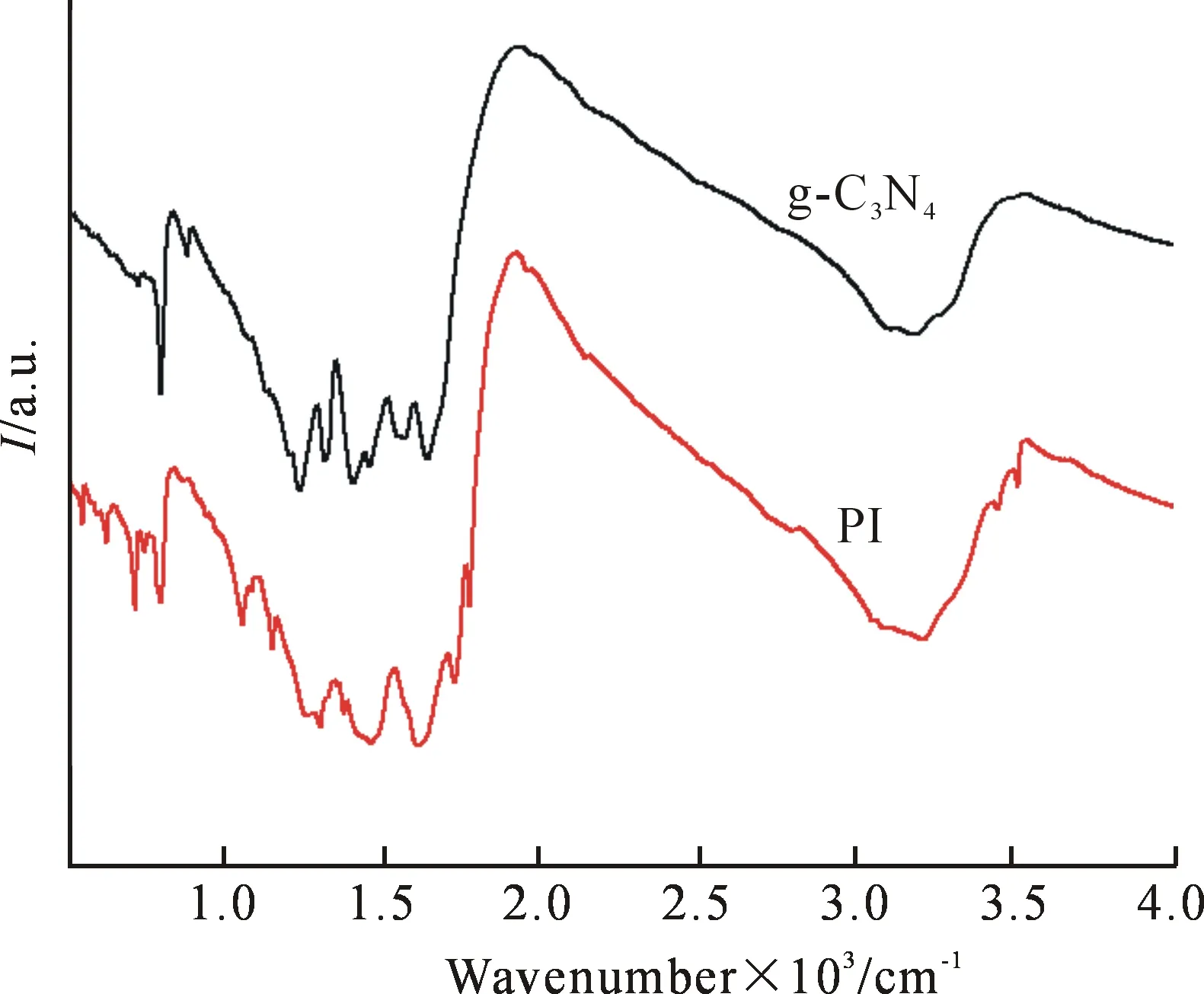
图6 PI的FTIR图
2.2 催化剂的应用
将催化剂应用于光芬顿中降解污染物罗丹明B,图7表示了120分钟内g-C3N4、PI的有机物去除率.由图7可知,PI的降解效果要好于g-C3N4,在反应进行60分钟时有机物去除率相差17.6%,在第120分钟时差异扩大至30.9%.加入具有吸收电子的能力的PMDA,使得PI具有更加促进光生载流子分离的性能.因此,通过本实验可以改善传统光催化剂光生电子-空穴对易复合的问题,提高半导体催化剂可见光催化性能.
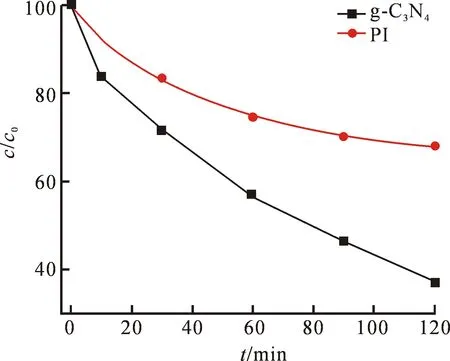
图7 g-C3N4、PI的有机物去除率图Fig.7 Organic removal rates of g-C3N4、PI
为了探索制备PI时三聚氰胺和PMDA的最佳比例,本实验制备出比例分别为2∶1,1∶1,2∶3,1∶3,1∶2的催化剂.图8(a)为不同配比的PI降解罗丹明B的降解率.
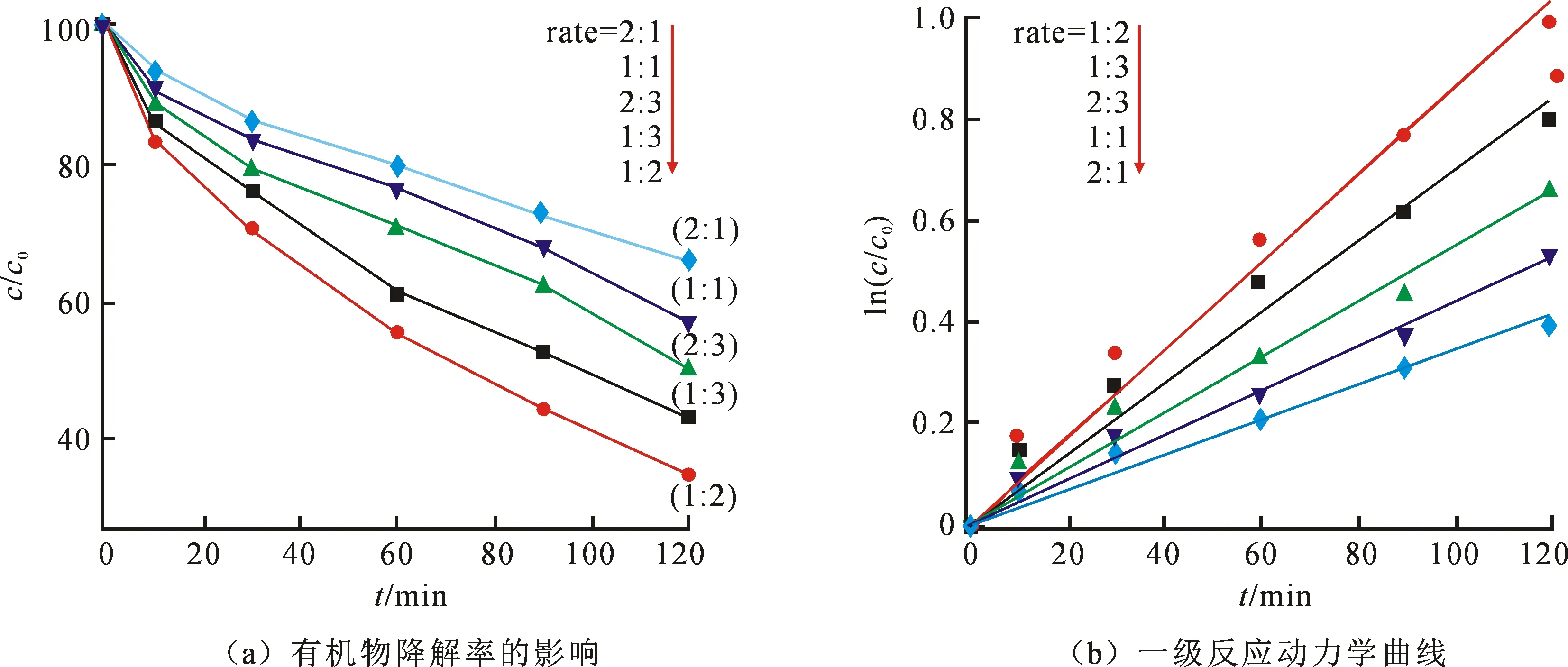
图8不同配比的PI对有机物降解率的影响及一级反应动力学曲线
Fig.8 Effects on different ratios of PI on the degradation rate of organics and the first-orderkinetics curves
由图8可知在反应进行至60 min时,比例为1∶2的PI已经显示出较好的降解能力,高于掺比为PI(1∶3) 的8.1%, 高于PI(2∶1) 30.1%.当反应进行至120 min时,1∶2掺比的PI降解率为62.8%,PI(2∶1)、PI(1∶1)、PI(2∶3)、PI(1∶3)的降解率为32.7%,41.6%,48.3%,54.7%,相比60 min时差距增大.上述结果表明三聚氰胺和PMDA 1∶2是制备PI的最佳配比.同时,对本降解反应进行反应动力学拟合,如图8(b)所示.表1为不同配比的反应动力学常数和相关系数,PI(2∶1)、PI(1∶1)、PI(2∶3)、PI(1∶3)的k值分别为0.003 45、0.004 42、0.005 46、0.007,最大速率常数k为掺比为PI(1∶2)的0.008 61,是上述配比的2.49、1.95、1.58、1.23倍.三聚氰胺和PMDA比例为1∶2时制备出的PI具有最高催化性能,致使体系有机物降解效率提升.
图9为不同pH条件下PI的降解效率图.由图可知在pH3.5时体系达到最高降解效率,120 min后62.8%的污染物得以降解,这与芬顿反应的最佳酸度一致.而pH在3和4时也有很好的降解效果,降解率分别为55.3%和49%.在pH=2时,体系降解能力最差,仅有38.1%去除.这是由于溶液中的H+浓度过高,催化剂的活性收到抑制,这会降低过氧化氢的生成量.在pH=5时,降解率为45.3%,低于pH为3.5时的17.5%.同时,对本降解反应进行反应动力学拟合(图9(b)).表2为不同pH的反应动力学常数和相关系数,当pH3.5时速率常数达到最大k=0.008 61,而当pH=2.0,5.0,4.0,3.0时k值分别等于0.004 06,0.005 01,0.0055 7,0.007 05.由此进一步说明适合的酸度会提升体系降解效率.
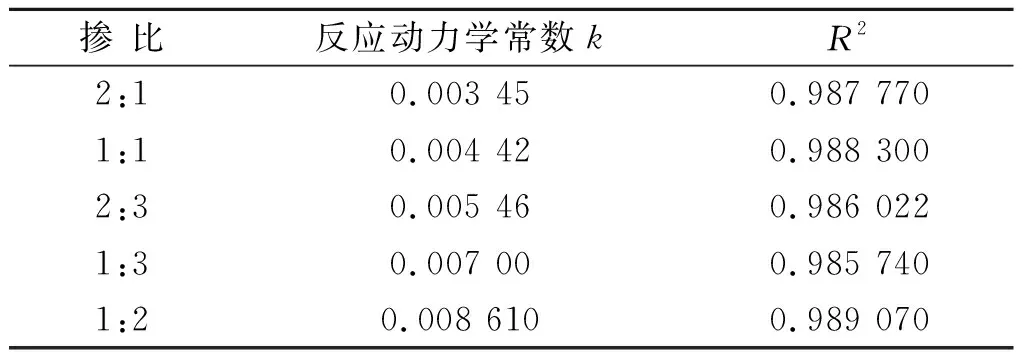
表1 不同配比对有机物降解的 反应动力学常数和相关系数
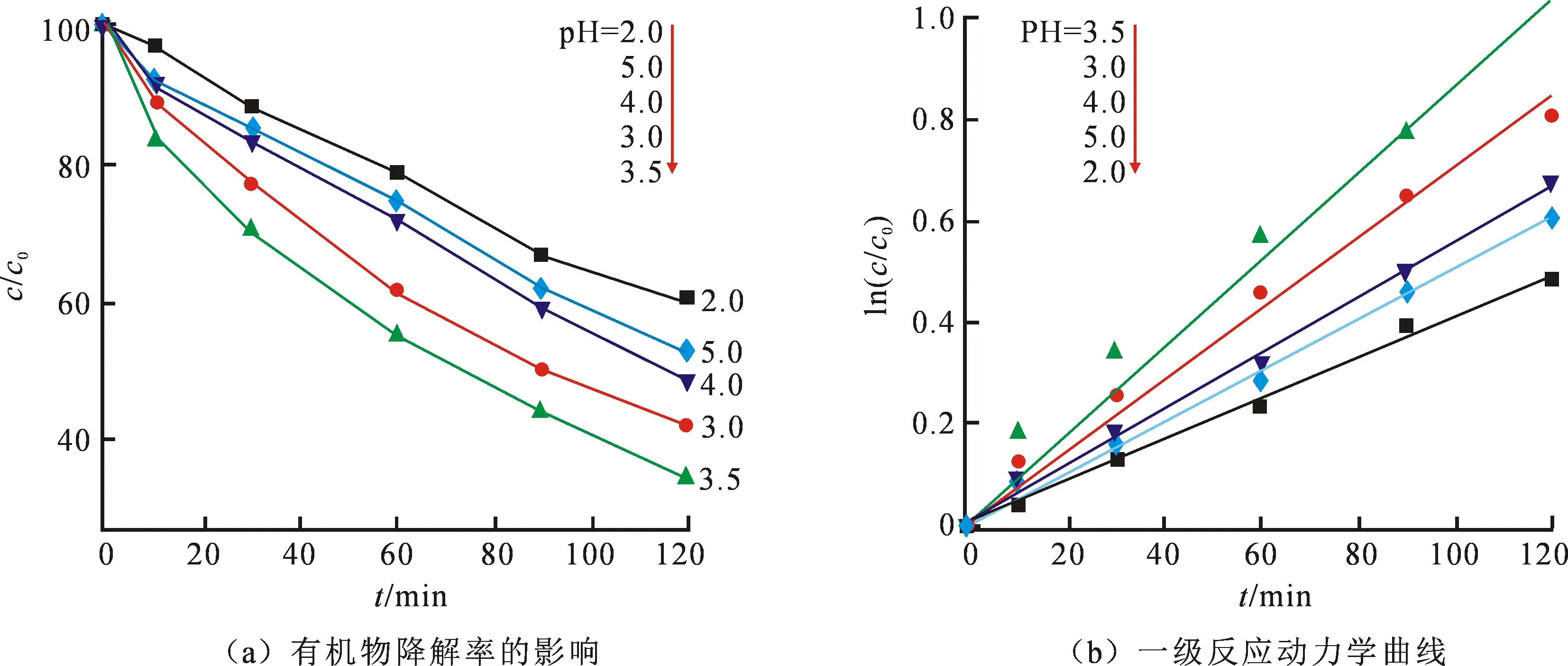
图9 不同pH对有机物降解率的影响及一级反应动力学曲线

pH反应动力学常数kR22.00.004 060.998 005.00.005 010.997 594.00.005 570.998 113.00.007 050.994 713.50.008 610.989 07

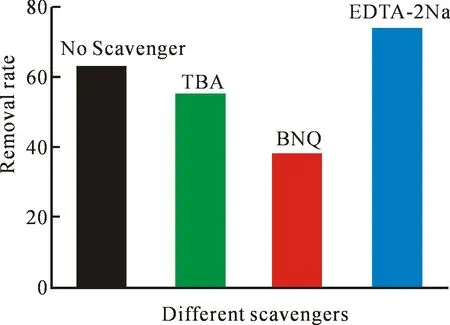
图10 不同捕获剂对PI降解有机物性能的影响
3 结 论
1) 实验针制备出三聚氰胺与均苯四甲酸酐掺杂的改性光催化剂PI,相比传统光催化剂g-C3N4,它能够有效提升体系降解效率.在降解污染物120分钟后,PI的降解效率高出g-C3N430.9%.
2) 将PI应用于光芬顿系统中,不需外界能耗供给,仅在可见光照射下,水中有机物可以得到有效降解,为高级氧化法的发展提供的新的思路.
3) 制备PI时三聚氰胺和PMDA的最优配比为1∶2.其反应速率常数为其他配比催化剂PI(2∶1)、PI(1∶1)、PI(2∶3)、PI(1∶3)的2.49、1.95、1.58、1.23倍.
4) PI应用于光芬顿体系的最优pH为3.5,pH=3.5时速率常数达到最大k=0.008 61分别为pH=2.0、5.0、4.0、3.0时k值的2.12、1.72、1.54、1.22倍.
参考文献:
[1] 江传春,肖蓉蓉,杨平.高级氧化技术在水处理中的研究进展[J].水处理技术,2011,37(7):12.
JIANG Chuanchun,XIAO Rongrong,YANG Ping.Research Progress of Advanced Oxidation Processes in Water Treatment[J].Water Treatment Technology,2011,37(7):12.( in Chinese)
[2] 赖波,周岳溪,杨平,等.不同高级氧化法对ABS树脂生产废水的降解特性[J].浙江大学学报(工学版),2012,46(3):476.
LAI Bo,ZHOU Yuexi,YANG Ping,et al.Degradation Characteristics of ABS Resin Production Wastewater by Different Advanced Oxidation Processes[J].Journal of Zhejiang University(Engineering Science),2012,46(3):476.(in Chinese)
[3] CAPRIO V,INSOLA A,MAROTTA R.Advanced Oxidation Processes (AOP) for Water Purification and Recovery[J].Catalysis Today,1999,53:51.
[4] MATILAINEN,ASILLANPAA M.Removal of Natural Organic Matter from Drinking Water by Advanced Oxidation Processes[J].Chemosphere,2010,80(4):351.
[5] 魏玉江.芬顿的原理与应用[J].能源与节能,2014(3):172.
WEI Yujiang.Principle and Application of Fenton[J].Energy and Energy Conservation,2014 (3):172.
(in Chinese)
[6] 李建旭.非均相芬顿试剂处理含酚废水的研究[D].南京:南京大学,2012.
LI Jianxu.Study on Treatment of Wastewater Containing Phenol by Heterogeneous Fenton Reagent [D].Nanjing:Nanjing University,2012.( in Chinese)
[7] ARSLAN-ALATON I,GURSOY B H,SCHMIDD J M.Advanced Oxidation of Acid and Reactive Dyes:Effect of Fenton Treatment on Aerobic,Anoxic and Anaerobic Processes[J].Dyes and Pigments,2008,78(2):117.
[8] BELTRAN F J,GIMENO O,FRADES J.Treatment of Olive Oil Mill Wastewater by Fenton’s Reagent[J].Jouranl of Agricuttural and Food Chemisty,2001.49:1873.
[9] ZAZO J A,et al.Chemical Pathway and Kinetics of Phenol Oxidation by Fenton’s Reagent.Environmental Science & Technology,2005.39(23):9295.
[10] MONTEAGUDO J M,DURAN A,AGUIRRE M,et al.Optimization of the Mineralization of a Mixture of Phenolic Pollutants under a Ferrioxalate-Induced Solar Photo-Fenton Process[J].Journal of Hazardous Materials,2011,185(1):131.
[11] CHEN W J.The Treatment of Phenolic Contaminants from Shale Gas Drilling Wastewater:A Comparison with UV Fenton and Modified UV-Fenton Processes at Neutral pH[J].The Royal Society of Chemistry,2016,6:90682.
[12] LIU H,XIANG C W,LI Z,et al.A Novel Electro-Fenton Process for Water Treatment:Reaction-controlled pH Adjustment and Performance Assessment[J].Environ Science & Tehnology,2007,41:2937.
[13] KOFUJI Y,ISOBE Y,SHIRAISHI Y,et al.Carbon Nitride-Aromatic Diimide-Graphene Nanohybrids:Metal-Free Photocatalysts for Solar-to-Hydrogen Peroxide Energy Conversion with 0.2% Efficiency[J].Journal of the American Chemical Society,2016,138(31):10019.
[14] 储升.共轭聚合物半导体光催化材料的研制及构效关系研究[D].南京:南京大学,2013.
CHU Sheng.Study of Preparation and Structure Activity Relationship of Conjugated Polymer Semiconductor Photocatalytic Materials[D].Nanjing:Nanjing University,2013.(in Chinese)
[15] 金瑞瑞,游继光,张倩,等.Fe掺杂g-C3N4的制备及其可见光催化性能[J].物理化学学报,2014,30(9):1706.
JIN Ruirui,YOU Jiguang,ZHANG Qian,et al.Preparation of Fe Doped g-C3N4and Its Photocatalytic Performance with Visible Light[J].Journal of physical chemistry,2014,30 (9):1706.(in Chinese)
