磷脂酶产生菌株的筛选·鉴定和培养条件优化
2018-07-06朱丹峰胡雪芹张洪斌
朱丹峰,胡雪芹,张洪斌
(合肥工业大学生物与医学工程学院,安徽合肥 230009)
磷脂酶是用于磷脂改性专一性较强的酶,能够催化磷脂的各种水解反应,并在一定酰基的受体和供体存在下催化酯交换反应,对磷脂的结构进行各种改变或修饰,从而得到不同结构和用途的磷脂[1]。磷脂酶是脂肪酶的一种,是界面酶,能在脂质-水界面催化水解磷脂,磷脂分散在水中,形成双层胶束,胶束与水的界面就是酶反应的点,反应界面的大小直接反映反应速度与水解程度[2-5]。磷脂酶能应用于植物油的脱胶,即在炼油过程中(油脱胶)磷脂的去除[6-7],相比传统方法,酶法脱胶是一种经济节约、高效稳定、绿色环保的脱胶方法。此外,其在焙烤食品工业、乳制品加工业、蛋黄酱加工业等领域具有重要用途[8]。微生物种类繁多,生长周期短,易于分离和诱变,可工业化大规模培养,利用微生物发酵是工业化生产磷脂酶的良好途径。因此,获得高酶活的磷脂酶产生菌具有广阔的应用前景。笔者从土样中筛选磷脂酶产生菌株并对其特性进行研究,以期为磷脂酶的生产提供优良菌株。
1 材料与方法
1.1试验材料
1.1.1土壤样品。合肥地区油脂类物质污染后的表层土壤。
1.1.2培养基。孟加拉红培养基(W/V)(分离真菌:加入放线菌酮以抑制真菌生长):孟加拉红培养基粉末3.5%,pH 7.2±0.2。真菌分离培养基(W/V):大豆卵磷脂3.0%,(NH4)2SO40.2%,NaH2PO4·H2O 0.05%, K2HPO4·3H2O 0.1%,MgSO4·7H2O 0.05%,CaCl20.10%,琼脂 2.0%,溴甲酚紫0.003 %,pH 7.2±0.2。真菌发酵培养基(W/V):大豆卵磷脂3.0%,(NH4)2SO40.2%,NaH2PO4·H2O 0.05%, K2HPO4·3H2O 0.1%,MgSO4·7H2O 0.05%,CaCl20.10%,pH 7.2±0.2。灭菌条件:121 ℃灭菌20 min。
1.2产磷脂酶菌株的筛选
1.2.1平板初筛。将采集的土样按照10倍稀释法稀释,使用分离平板培养基进行菌株筛选。利用涂布法进行涂布,30 ℃恒温培养,菌落周围产生透明圈者为磷脂酶产生菌。透明圈直径和菌株直径比越大则表明磷脂酶的活力越大。将有透明圈的菌株用划线分离法进行分离纯化,并选择纯种的菌株进行下一步复筛。
1.2.2摇瓶复筛。将平板初筛获得的菌株进行摇瓶培养,按照酶活力测定方法测定磷脂酶的活性,比较酶活力的大小,最终获得产酶能力最高的菌株,并斜面保存。
1.3菌株鉴定
1.3.1形态鉴定。观察菌株在分离培养基上的菌落形态、颜色等;参照《真菌鉴定手册》确定菌种。
1.3.2分子生物学鉴定。利用真菌基因组DNA提取试剂盒提取菌株的基因组DNA,并以此为模板采用18S rDNA基因的通用引物NS6(5′-GCATCACAGACCTGTTATTGCCTC-3′)和NS1(5′-GTAGTCATATGCTTGTCTC-3′)进行PCR扩增。反应条件:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃10 min[9-10]。PCR产物经琼脂糖凝胶电泳检测鉴定后,交由上海生工生物工程股份有限公司测序。测序结果经GenBank上利用BLAST程序进行相似性搜索,选取相似性最高且有效发表的典型菌株的序列,用ClustalX 1.83进行序列比对,运用MEGA 4.0的Neighbor-Joining方法构建系统发育树。
1.4磷脂酶活力的测定[11-12]将一定量经丙酮提纯的大豆卵磷脂溶于预订pH缓冲液中,10 000 r/min均质10 min,得到底物溶液。取100 mL三角瓶加20 mL底物溶液,于预订温度的水浴中预热5 min,然后在各瓶中加入一定量的酶液,同时做空白样品,混匀计时,在预订温度的水浴中180 r/min振荡准确反应一定时间,于样品中和空白瓶中立即补加95%乙醇10 mL终止反应,取出,在自动滴定仪下用NaOH标准溶液滴定,计算标准碱液平均消耗量。
在特定条件下,1 min水解磷脂产生1 μmol游离脂肪酸所需的酶量即为1个磷脂酶活力单位U[13]。
X=(V-V0)×C×100/(0.1×t×m)
式中,X为样品酶活力,U/mL;V为样品消耗碱液的体积,mL;V0为空白消耗碱液的体积,mL;C为NaOH溶液的溶度,mol/L;t为反应时间,min;m为酶液用量,mL。
1.5发酵条件优化
1.5.1不同碳源、复合碳源比例对菌株B8产磷脂酶的影响。在基础发酵培养基其余组分和培养条件保持不变的情况下,以2%的比例,分别添加甘油、环糊精、蔗糖、乳糖、麦芽糖、葡萄糖、卵磷脂作为发酵产酶的碳源;根据碳源结果,卵磷脂是诱导物,考察碳源比例(麦芽糖和卵磷脂的比例为5∶1,4∶1,3∶1,2∶1,1∶1)对B8产酶的影响。
1.5.2氮源对菌株B8产磷脂酶的影响。以1.0%的比例,分别添加蛋白胨、牛肉膏、酵母膏、(NH4)2HPO4、NH4Cl作为发酵的氮源,考察其对产酶的影响。
1.5.3无机盐对B8菌株产磷脂酶的影响。选择4种无机盐:NaH2PO4·3H2O(0.04%、0.05%、0.06%)、K2HPO4·3H2O(0.05%、0.10%、0.15%)、MgSO4·7H2O(0.04%、0.05%、0.06%)、CaCl2(0.05%、0.10%、0.15%),4种无机盐设3个水平,以磷脂酶活力为指标,选择L9(34)进行正交试验[14]。
1.6培养条件优化
1.6.1转速对菌株B8产磷脂酶的影响。在其他培养条件一致的条件下,将培养基在160、180、200、220、240 r/min条件下摇床培养24 h后,检测磷脂酶活力,确定摇床转速。
1.6.2发酵时间对菌株B8产磷脂酶的影响。在其他培养条件一致的条件下,摇床振荡培养24、48、72、96、120 h后检测磷脂酶活力,确定最适发酵时间。
1.7磷脂酶特性研究
1.7.1反应温度对磷脂酶活力的影响。按照上述测定酶活的方法,将酶活力测定温度分别设置为25、30、35、40、45、50、55 ℃,测定其酶活力,以确定磷脂酶的最适反应温度。
1.7.2pH对磷脂酶活力的影响。将酶活力测定初试pH分别设定为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,测定酶活力,以确定磷脂酶的最适pH。
2 结果与分析
2.1产磷脂酶菌株的分离以卵磷脂为诱导物和底物,以溴甲酚紫为显色剂对土壤样本进行分离,可以形成白色透明圈,此法能粗略分离产磷脂酶的菌株。将初筛得到的菌株发酵提取酶液,细菌发酵温度37 ℃,摇床转速250 r/min,发酵2~3 d,放线菌和真菌发酵温度30 ℃,摇床转速200 r/min,发酵3~5 d。每天观察发酵液的状态,发酵到一定程度后取出发酵液,8 000 r/min、4 ℃离心15 min,取上清液即酶液,在新体系中催化卵磷脂生成GPC量作为评价标准。利用薄层色谱检测产GPC的能力进行初步定性分析,初筛得到的6株较优菌株摇瓶发酵测定酶活,发现菌株B8活力最高,为2.06 U/mL,进一步对该菌株进行鉴定和产酶条件优化。菌株B8转化产物TLC检测结果见图1。
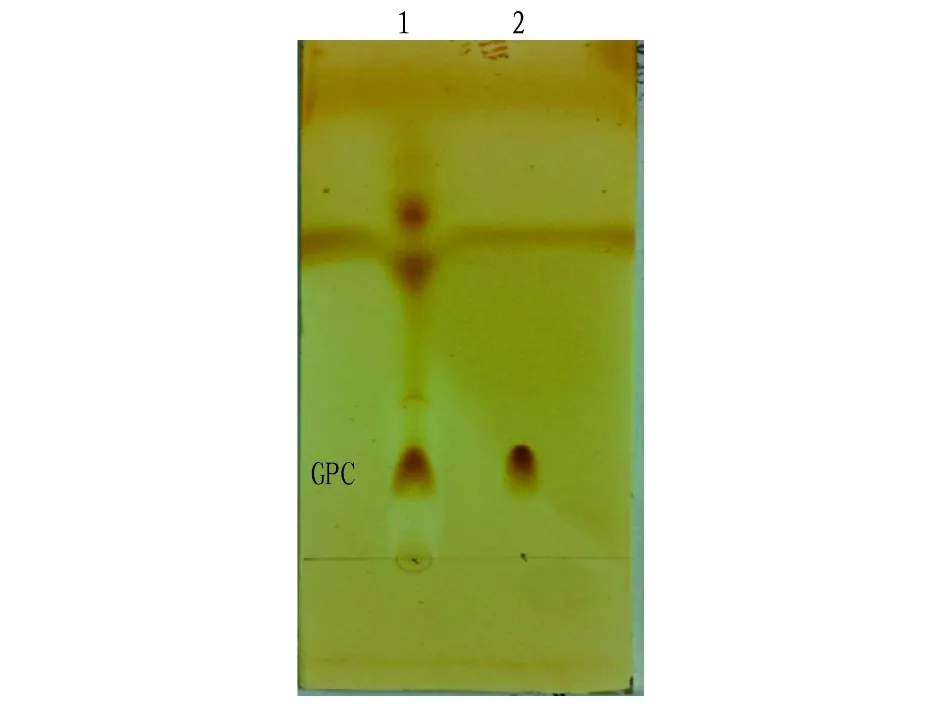
图1 菌株B8转化产物TLC检测Fig.1 TLC test of transformation products from strain B8
2.2菌株B8的鉴定
2.2.1菌落形态鉴定。B8菌株在分离培养基能产生明显的透明圈,菌落表面粗糙、蓬松,呈黑褐色,下层黏附在培养基上。
2.2.2菌株分子生物学鉴定。将菌株B8的18S rDNA进行PCR扩增,测序得到一条1 281 bp左右的条带,利用BLAST程序与GenBank中已登录的基因序列进行比对,选取同源性高且已定名菌株的相关序列信息,用ClustalX 1.83进行序列比对,用MEGA 4.1的Neighbor-Joining法构建系统发育树。结合菌落形态及18S rDNA基因序列的比对结果,鉴定菌株B8为黑曲霉(图2)。

图2 基于18S rDNA序列的系统发育树Fig.2 Phylogenetic tree based on 18S rDNA sequences simility of selected strains
2.3发酵条件优化
2.3.1碳源对B8菌株产磷脂酶的影响。菌株B8以选定的7种碳源进行发酵试验,其中麦芽糖的发酵液酶活力最高,达2.21 U/mL,其次是卵磷脂、葡萄糖、乳糖、蔗糖及甘油,环糊精产酶效果最差(图3)。考虑到卵磷脂对酶有一定的诱导作用,继续考察复合碳源(麦芽糖和卵磷脂的比例为5∶1、4∶1、3∶1、2∶1、1∶1)对B8产酶的影响,结果显示复合碳源较单一碳源有所提高,但各试验组差别不大,其中麦芽糖和卵磷脂比例3∶1磷脂酶活力最高(图4)。
2.3.2氮源对B8菌株产磷脂酶的影响。氮源能构成微生物细胞和含氮的代谢产物,选择合适的氮源对获得高产量的磷脂酶有重要影响[15]。结果显示,B8对有机氮源的利用效果较好,其中以麦芽糖作为氮源时,磷脂酶活力最高,达2.54 U/mL(图5)。
2.3.3无机盐的正交试验。对NaH2PO4·3H2O(A)、K2HPO4·2H2O(B)、MgSO4·7H2O(C)、CaCl2(D)进行正交设计试验,进一步确定无机盐的最佳配比,结果见表1。由表1可知,各因素的影响由大到小依次为NaH2PO4·3H2O、MgSO4·7H2O、K2HPO4·3H2O、CaCl2。NaH2PO4·3H2O是影响发酵产酶结果的最重要因素。最优无机盐的组成为NaH2PO4·3H2O 0.05%,K2HPO4·2H2O 0.10%,MgSO4·7H2O 0.06%,CaCl20.05%。

图3 碳源对B8产磷脂酶的影响Fig.3 Effect of carbon sources on phospholipase activity of submerged cultured B8
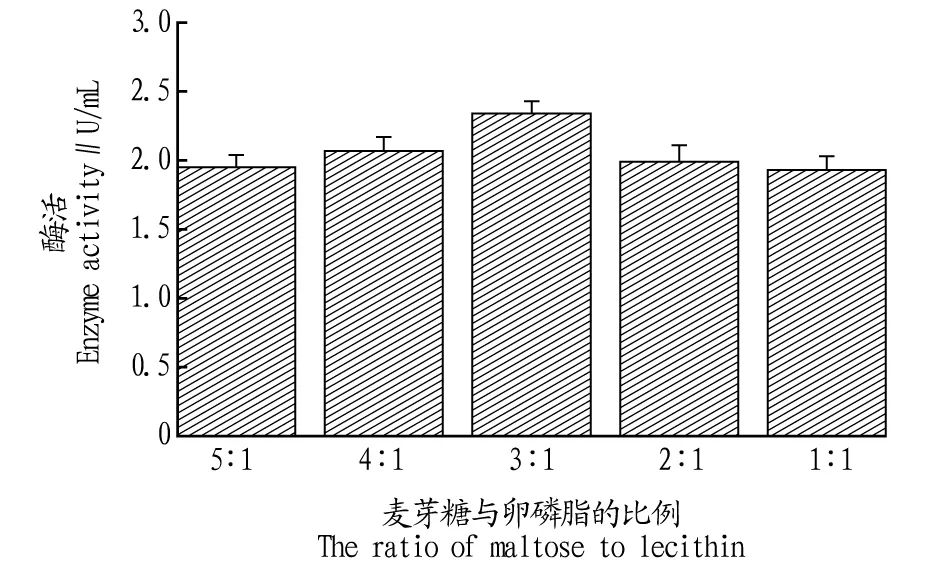
图4 复合碳源比例对B8产磷脂酶的影响Fig.4 Effect of compoud carbon sources on phospholipase activity of submerged cultured B8
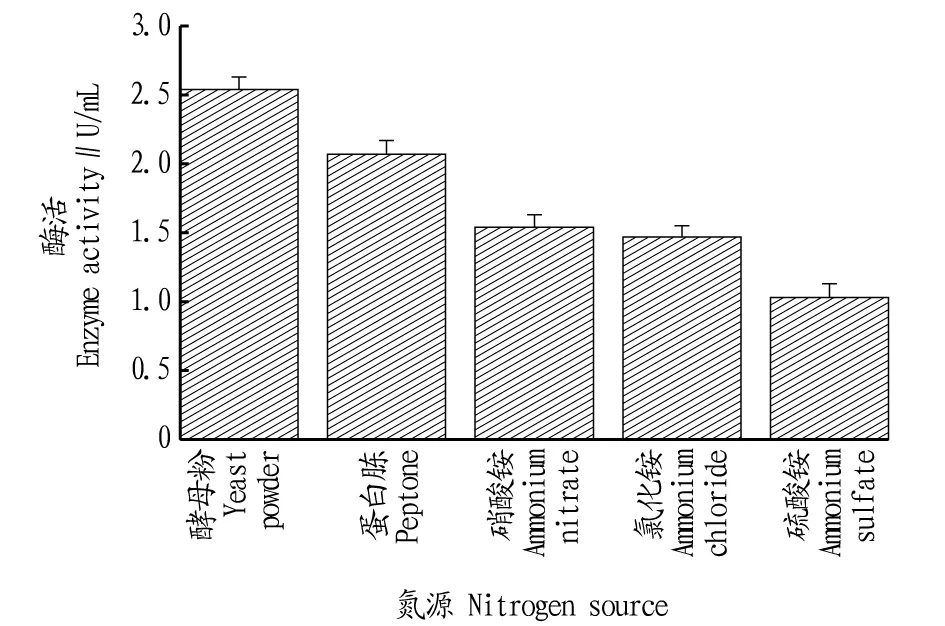
图5 氮源对B8产磷脂酶的影响Fig.5 Effect of nitrogen sources on phospholipase activity of submerged cultured B8
2.4培养条件优化在确定发酵培养基配方的基础上,通过单因素试验对培养条件进行优化。由图6可知,提高转速可以提高发酵体系的溶氧浓度,对磷脂酶的合成非常有利,转速220 r/min时酶活性最高。培养3~4 d时酶活力相对较高(图7),继续培养营养条件恶化,菌体生长停滞甚至自溶,酶活降低。
表1无机盐对B8产磷脂酶的正交试验结果
Table.1QuadratureanalysisofinorganicsaltonphospholipaseactivityofsubmergedculturedB8

试验号No.因素FactorABCD酶活Enzyme activity∥U/mL111112.350212222.440313332.610421232.790522313.140623122.830731322.590832132.480933212.420k12.4672.5772.5532.637k22.9202.6872.5502.620k32.4972.6202.7802.627R0.4530.1100.2300.017

图6 转速对B8产磷脂酶的影响Fig.6 Effect of nitrogen rotate on phospholipase activity of submerged cultured B8
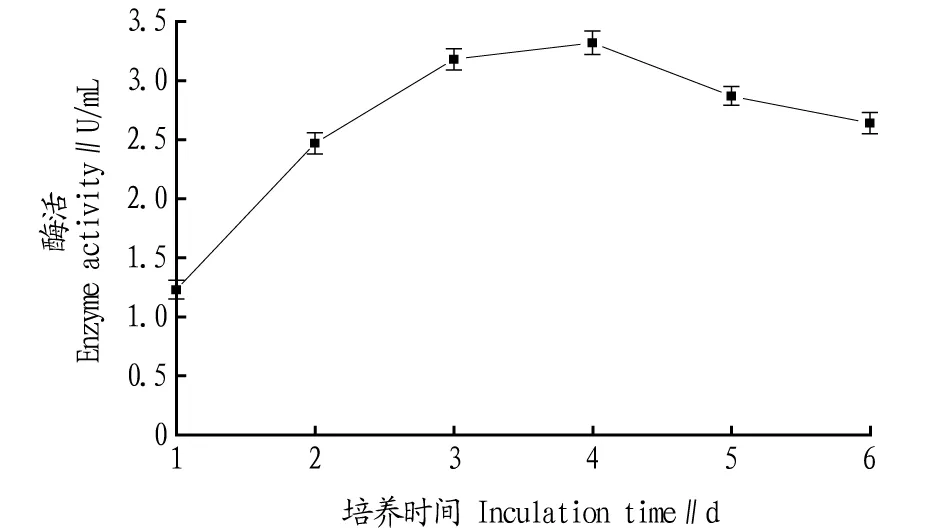
图7 培养时间对B8产磷脂酶的影响Fig.7 Effect of inculation time on phospholipase activity of submerged cultured B8
2.5磷脂酶特性
2.5.1反应温度对磷脂酶活性的影响。由图8可知,发酵液的磷脂酶活约在30 ℃时达到最大,超过30 ℃后,酶活下降。这说明发酵得到的是一种低温磷脂酶。

图8 温度对磷脂酶活性的影响Fig.8 Effect of temperature on phospholipase enzyme activity
2.5.2pH对磷脂酶活性的影响。由图9可知,发酵液的磷脂酶活约在pH 7.5时达到最大,pH超过8.0后酶活显著下降。这说明发酵得到的磷脂酶最佳pH为7.5。
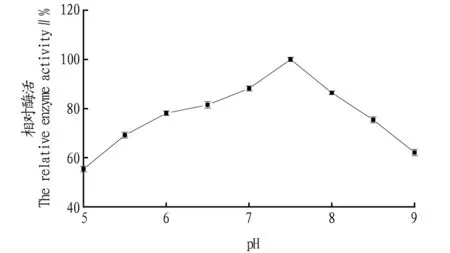
图9 pH对磷脂酶活性的影响Fig.9 Effect of pH on phospholipase enzyme activity
3 结论
生物酶催化反应条件温和,具有严格的对应或区域选择性,在工业化学合成中应用十分广泛,有机化学品的制造逐渐向生物法靠拢[16]。该试验采用固体平板初筛和摇瓶复筛获得了磷脂酶高产菌株,初步鉴定其为黑曲霉,对该菌株培养条件优化,通过摇瓶发酵检测得出,复合碳源麦芽糖与大豆卵磷脂比例为1.5%与0.5%,最佳氮源为酵母粉1.0%,无机盐组成为NaH2PO4·3H2O 0.05%,K2HPO4·2H2O 0.10%,MgSO4·7H2O 0.06%,CaCl20.05%,发酵温度30 ℃,发酵时间4 d,较出发菌株酶活提高了1.61倍。菌株所产磷脂酶是低温酶,其最适作用温度为30 ℃,最适作用pH为7.5。
该菌种为野生菌,经多次传代后基本不变,适合作为出发菌株进行后续研究,如诱变、基因重组和纯化等,从而更好地用于磷脂改性与植物油脱胶。
[1] 郭浩.磷脂酶D高产菌株的选育及发酵条件优化[D].西安:西北大学,2007.
[2] KHAN F I,NIZAMI B,ANWER R,et al.Structure prediction and functional analyses of a thermostable lipase obtained fromShewanellaputrefaciens[J].Journal of biomolecular structure & dynamics,2017,35(10):2123-2135.
[3] ARAVINDAN R,ANBUMATHI P,VIRUTHAGIRI T.Lipase applications in food industry[J].Indian journal of biotechnology,2007,6(2):141-158.
[4] ALOULOU A,RODRIGUEZ J A,FERNANDEZ S,et al.Exploring the specific features of interfacial enzymology based on lipase studies[J].Biochimica et biophysica acta,2006,1761(9):995-1013.
[5] 王大海,于才渊,杨天奎.磷脂酶A1催化水解大豆浓缩磷脂的研究[J].食品工业科技,2008,29(2):233-235.
[6] YU D Y,MA Y,JIANG L Z,et al.Optimization of magnetic immobilized phospholipase A1degumming process for soybean oil using response surface methodology[J].European food research & technology,2013,237(5):811-817.
[7] YU D Y,MA Y,XUE S J,et al.Characterization of immobilized phospholipase A1on magnetic nanoparticles for oil degumming application[J].LWT-Food Science and Technology,2013,50(2):519-525.
[8] CASADO V,MARTIN D,TORRES C F,et al.Phospholipases in food industry:A review[J].Methods in molecular biology,2012,861:495-523.
[9] 曹凤明,杨小红,马鸣超,等.枯草芽孢杆菌近缘种群鉴定方法研究进展[J].微生物学通报,2014,41(5):968-974.
[10] 冯志彬,张娟,陈国忠,等.产L-天冬氨酸α-脱羧酶细菌的分离、鉴定及发酵条件优化[J].微生物学报,2016,56(1):44-55.
[11] YANG J G,WANG Y H,YANG B,et al.Degumming of vegetable oil by a new microbial lipase[J].Food technology & biotechnology,2006,44(1):101-104.
[12] 占剑峰.磷脂酶A1的发酵制备、分离纯化及催化特性的研究[D].合肥:合肥工业大学,2013.
[13] 郭勇.酶工程原理与技术[M].北京:高等教育出版社,2005.
[14] 赵春海,阚振荣.无机盐及微量元素对乙酰乳酸脱羧酶发酵活力的影响[J].中国酿造,2005,24(6):26-29.
[15] 沈萍,陈向东.微生物学[M].北京:高等教育出版社,2007.
[16] OGAWA J,SHIMIZU S.Microbial enzymes:New industrial applications from traditional screening methods[J].Trends in biotechnology,1999,17(1):13-20.
