中老年女性腰椎MR信号值与骨质疏松风险分层的关系及诊断价值研究
2018-07-05邢东炜黄学菁吴佳桢翁子敬俞健力张闽光
邢东炜,黄学菁,吴佳桢,翁子敬,俞健力,张闽光△
(1.上海中医药大学附属市中医医院放射科 200071;2.上海中医药大学附属曙光医院放射科 200021)
骨质疏松(osteoporosis,OP)易累及腰椎,引发骨质疏松性骨折而引起腰痛,甚至致残[1-2]。绝经后亚洲女性OP自我筛查工具(osteoporosis self-assessment tool for Asian,OSTA)因只需要年龄和体质量两个参数,使用方便,便于OP人群的筛查和自我评估,且有研究显示其灵敏度高、特异性好[3-5]。临床上腰痛患者行磁共振成像(MRI)检查的越来越多,MRI除显示形态、局灶性信号变化外,腰椎体磁共振(MR)信号普遍增高也是老年腰痛患者常见的征象之一。本研究对209例中老年女性不同OSTA-OP风险分层的腰椎常规MR信号进行对照研究,并探讨腰椎MR信号值对OP风险的诊断价值。
1 资料与方法
1.1一般资料 回顾性收集2014年1月至2016年12月在上海中医药大学附属市中医医院行腰椎MR检查的40岁以上女性。排除标准:(1)资料不全者;(2)有腰椎压缩性骨折者;(3)患有腰椎骨肿瘤和肾性骨营养不良、Paget′s病、骨软化症等可引起骨代谢病变的疾病者;(4)有严重肝肾疾病者;(5)卧床不起者。本组共纳入209例被检测者,年龄41~88岁,平均(64.27±10.23)岁;身高142~172 cm,平均(159.61±4.75)cm;体质量41~94 kg,平均(60.17±9.42)kg。
1.2方法
1.2.1腰椎MRI检查 使用德国Siemens公司Avanto 1.5T超导MRI仪,梯度场强45 mT/m,切换率200 mT·m-1·s-1,采用8通道体部相控阵线圈,包括全部腰椎,进行常规快速自旋回波(TSE)矢状面T1WI、T2WI、脂肪抑制(FS)-T2WI。各序列成像参数见表1。
1.2.2MR信号的测定和分析 测量每例被检者各个序列腰1(L1)至腰4(L4)椎体MR信号值,并测量各序列脊髓腰膨大信号值及背景信号值(噪声)的标准差。计算L1至L4椎体MR信噪比(SNR)和对比噪声比(CNR)。本组209例被检者腰椎MR图像被直接上传PACS,在诊断用浏览终端上调阅常规T1WI、T2WI和FS-T2WI图像,选取腰椎正中矢状面,根据腰椎体大小选取1个椭圆形感兴趣区(ROI,面积250~300 mm2)测量L1~L4椎体信号值;根据脊髓腰膨大大小选取1个纵行椭圆形(面积75~100 mm2)测量脊髓信号值;在腰椎背侧距皮肤约10 mm处空白背景区选取1个纵行椭圆形(面积75~100 mm2)测量信号值的标准差。椎体SNR=椎体信号值/背景噪声的标准差;椎体CNR=(椎体信号值-脊髓腰膨大信号值)/背景噪声的标准差。以SNR和CNR验证腰椎体MR信号值的稳定性和可靠性。
1.2.3OSTA指数计算及分组 参照文献[3-6]:OSTA指数=0.2×[体质量(kg)-年龄(岁)]。OP风险评估:OSTA指数小于或等于-4为OP高风险组,>-4~-1为OP中等风险组,>-1为OP低风险组。

2 结 果
2.1腰椎MR信号值与SNR和CNR的相关性分析 L1~L4椎体的MR各序列信号值与SNR和CNR呈正相关,各椎体MR信号值与SNR相关系数(r)值均大于0.8(P=0.000);与CNR之间的r值,除FS-T2WI序列位于0.67~0.71外,其余均大于0.9(P=0.000),见表2。
2.2腰椎体MR信号值在OSTA-OP各风险级别组间差异分析 经两两比较表明,在低风险组和中、高风险组之间,L1~L4各椎体及合并L1~L4椎体后T1WI、T2WI、T2WI减FS-T2WI序列各序列的MR信号值均存在明显差异(P=0.000),FS-T2WI序列MR信号值均无明显差异(P>0.05);而在中风险组和高风险组之间,各椎体、各序列MR信号值均无明
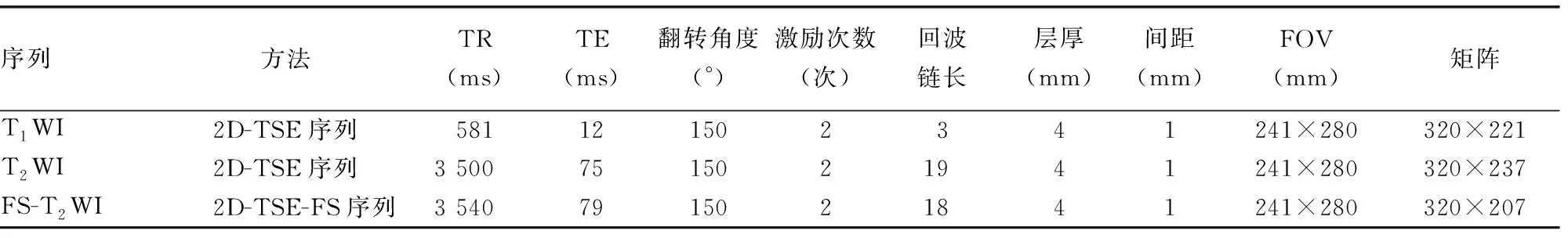
表1 腰椎MR序列参数表
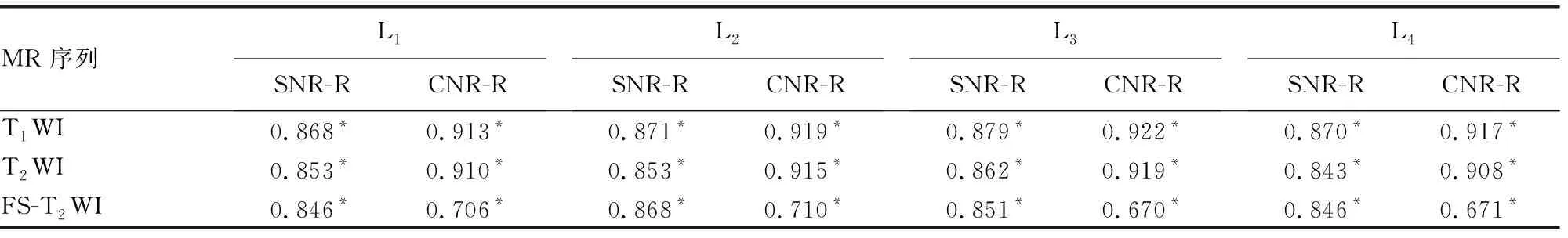
表2 209例被检测者腰椎椎体MR信号与SNR和CNR的相关性
SNR-R:椎体MR信号值与SNR间的r值;CNR-R:椎体MR信号值与CNR间的r值;*:P=0.000
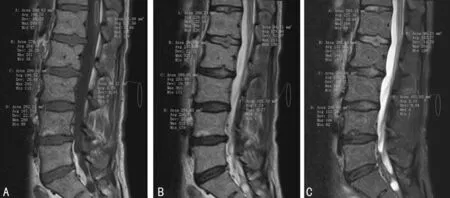
显差异(P>0.05),见表3~7。典型腰椎MRI信号测量图:(1)女性,75岁,体质量54 kg,OSTA指数为-4.2,处于OP高风险,L1~L4椎体T1WI、T2WI信号值较高,T2WI与FS-T2WI信号差较大,见图1;(2)女性,46岁,体质量55 kg,OSTA指数为1.8,处于OP低风险,L1~L4椎体T1WI、T2WI信号较低,T2WI与FS-T2WI信号差较小,见图2。
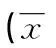
表3 中老年女性各OSTA-OP风险级别组间L1椎体MRI信号值比较±s)
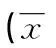
表4 中老年女性各OSTA-OP风险级别组间L2椎体MRI信号值比较±s)
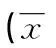
表5 中老年女性各OSTA- OP风险级别组间L3椎体MRI信号值比较±s)
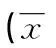
表6 中老年女性各OSTA- OP风险级别组间L4椎体MRI信号值比较±s)
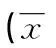
表7 中老年女性各OSTA- OP风险级别组间合并L1~L4椎体MRI信号值比较±s)
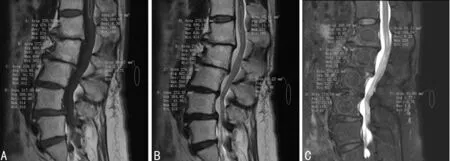
A:T1WI;B:T2WI;C:FS-T2WI
图1 OP高风险组腰椎MRI信号测量图
A:T1WI;B:T2WI;C:FS-T2WI
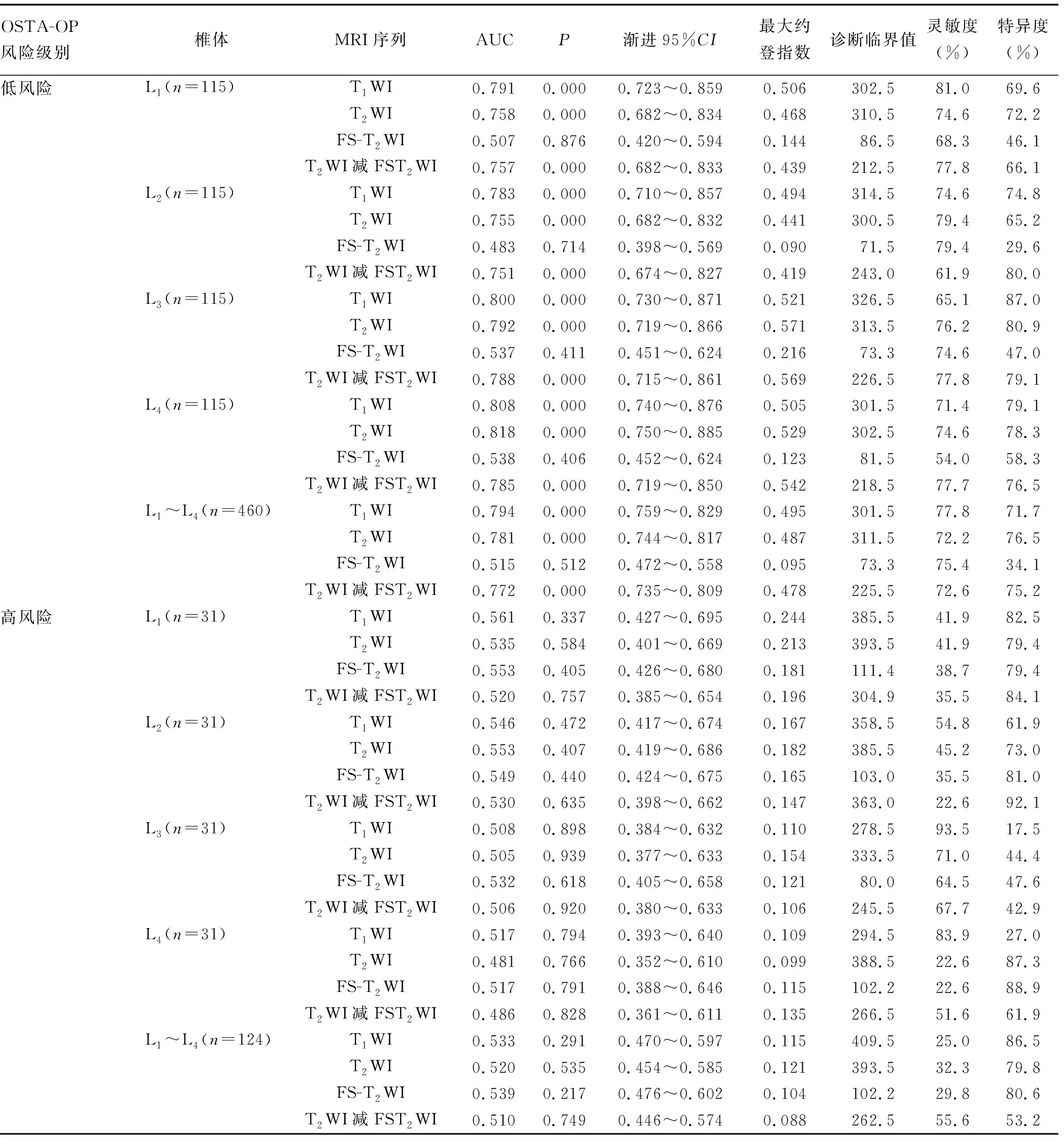
图2 OP低风险组腰椎MRI信号测量图
2.3腰椎体MR信号值对OSTA-OP风险的诊断价值分析 利用ROC曲线分析209例中老年女性腰椎体MRI信号值对OSTA-OP风险的诊断价值,结果表明,各椎体T1WI、T2WI、T2WI减FS-T2WI序列MRI信号值对于OSTA-OP低风险ROC曲线下面积(AUC)在0.751~0.818(P=0.000);渐进95%CI均在0.674~0.885(不包括0.5),其灵敏度61.9%~81.0%、特异度65.2%~80.9%。各椎体FS-T2WI序列信号值对OSTA-OP低风险的诊断价值、所有序列对OSTA-OP高风险的诊断价值均较低,AUC均在0.6以下(P>0.05),渐进95%CI下限均在0.5以下,见表8。
3 讨 论
中老年人群骨量丢失增加,尤其是女性受卵巢功能减退、雌激素减少的影响,骨量丢失更加明显,形成老年性骨质疏松症[7]。OSTA仅涉及体质量和年龄两个指标,简单有效。OP是单位体积内骨组织量减少,即骨基质的矿物质和有机成分都减少。临床上检测骨矿物质的含量相对容易,如目前作为金标准的双能X射线吸收法测定骨矿物质密度[8]。但是,活体检测骨基质的有机成分较为困难。为促进精准医疗,OP的诊断需要依靠CT和MRI等对骨微结构、几何形态等生物力学特征的影像学研究[9-10]。
随着年龄的增加,由于对造血需求的降低,发生红黄骨髓的转换,骨髓中脂肪细胞增多,形成黄骨髓。尽管脂肪量对骨矿物质沉积和骨量峰值的作用存在争议[11]。但是,有尸检发现髂嵴骨髓脂肪含量从30岁的40%增加到100岁的68%,脂肪细胞的大小和数量随着年龄的增长而增加。脊椎的脂肪,小于55岁男性较高,55~65岁男性随年龄逐渐增加,而女性陡然增加,使老年女性的骨髓脂肪含量高于男性[12]。不同的方法研究发现,骨密度的降低伴随着骨髓脂肪含量的增加,且与OP相关。组织形态学研究表明骨髓脂肪与骨形成呈负相关[12]。
MRI对OP、骨髓脂肪的研究报道主要是利用磁共振氢质子波谱(1H-MRS)、Dixon法水脂分离技术及弥散加权成像等[13-16]。但是,笔者在日常工作中发现,常规MR T1WI和T2WI图像中老年人脊柱椎体骨质信号较高,而FS-T2WI序列无明显变化,推测与老年性骨质疏松症、骨组织量减少、脂肪浸润增加有关。通过比较不同OSTA-OP风险级别中老年女性间L1~L4椎体常规MR T1WI、T2WI、FS-T2WI信号值和T2WI与FS-T2WI信号差值发现,OSTA-OP高、中等风险组腰椎体MR T1WI、T2WI信号值和T2WI与FS-T2WI信号差值明显高于低风险组,FS-T2WI信号值无明显差异,印证了笔者的推测。中风险组和高风险组间各序列MR信号值均无明显差异,可能与高风险组病例较少有关。
MR T1WI、T2WI、FS-T2WI成像是常规做法,所有MRI技术人员和诊断医生都很熟悉,与1H-MRS、Dixon法水脂分离技术及弥散加权成像比较,技术要求不高,成像时间短。虽然1H-MRS被认为是MRI衡量脂肪组织的金标准,但是MRS检查对技术和设备要求较高,且常用MRS有成像区域小、感兴趣区不完全代表整体状况的限制[12]。所以,在常规MR T1WI、T2WI、FS-T2WI诊断中,除关注是否有与OP有关的形态学和局部性信号变化、隐形骨折外[2,17-18],MR信号有无普遍增高、结合被检查者的年龄和体质量情况,对OP的提示和筛选具有较大意义。
考虑到常规MR信号的稳定性和可靠性,本研究对腰椎MR信号值与SNR和CNR进行了相关性分析,结果表明,除FS-T2WI序列外,各腰椎体、各序列MR信号值与SNR、CNR均呈正相关,r值分别在0.8以上和0.9以上。表明本研究MR各序列L1~L4信号值是稳定和可靠的,其分析结果具有稳定性和可靠性。本研究ROC曲线分析表明腰椎体MR T1WI和T2WI信号值对中老年女性OP低风险具有较高的诊断价值,对OP高风险的诊断准确性较低。本研究OSTA-OP高风险病例较少、相关结果可能不可靠,有待增加样本量进一步研究。
[1]COSMAN F,DE BEUR S J,LEBOFF M S,et al.Clinician′s guide to prevention and treatment of osteoporosis[J].Osteoporos Int,2014,25(10):2359-2381.
[2]顾晨琦,陈广东,顾云斌.核磁共振对骨质疏松性骨折疼痛责任椎体的诊断价值研究[J].中国血液流变学杂志,2016,26(2):259-261.
[3]KOH L K,SEDRINE W B,TORRALBA T P,et al.A simple tool to identify Asian women at increased risk of osteoporosis[J].Osteoporosis Int,2001,12(8):699-705.
[4]刘敏燕,李春霖,裴育,等.亚洲人骨质疏松自我筛查工具对老年男性骨质疏松症的诊断价值[J].中华医学杂志,2011,91(30):2112-2115.
[5]孙艳格,杜雪平,黄凯,等.亚洲人骨质疏松自我筛查工具对社区绝经后妇女骨质疏松症筛查效果评价[J].中华全科医师杂志,2014,13(8):655-658.
[6]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2-17.
[7]JILKA R L.The relevance of mouse models for investigating age-related bone loss in humans[J].J Gerontol A Biol Sci Med Sci,2013,68(10):1209-1217.
[8]LEWIECKI E M.Clinical applications of bone density testing for osteoporosis[J].Minerva Med,2005,96(5):317-330.
[9]OEI L,KOROMANI F,RIVADENEIRA F,et al.Quantitative imaging methods in osteoporosis[J].Quant Imaging Med Surg,2016,6(6):680-698.
[10]程晓光,LI J,刘霞,等.健康老年妇女近段股骨骨密度和结构的定量CT研究[J].中华放射学杂志,2009,43(2):126-130.
[11]WEAVER C M,GORDON C M,JANZ K F,et al.The National osteoporosis foundation′s position statement on peak bone mass development and lifestyle factors:a systematic review and implementation recommendations[J].Osteoporos Int,2016,27(4):1281-1386.
[12]SCHWARTZ A V.Marrow fat and bone:review of clinical findings[J].Front Endocrinol (Lausanne),2015,6(40):40.
[13]SHEN W,GONG X,WEISS J,et al.Comparison among T1-weighted magnetic resonance imaging,modified dixon method,and magnetic resonance spectroscopy in measuring bone marrow fat[J].J Obes,2013(298675):298675.
[14]张灵艳,李绍林,郝帅.比较氢质子磁共振波谱和正反相位 MRI 成像在骨髓脂肪沉积中的价值[J].中国骨质疏松杂志,2015,21(6):691-696.
[15]常飞霞,黄刚,樊敦徽,等.磁共振水-脂分离成像技术对椎体脂肪含量的测量[J].磁共振成像,2016,7(12):902-908.
[16]郑修竹,于金芬,张红,等.MR水、脂分离Dixon方法及弥散成像对椎体骨折性质的鉴别研究[J].医学影像学杂志,2015,25(10):1859-1863.
[17]孙洪勋,王乃宏,华伯埙.原发性骨质疏松症研究进展[J].中国中西医结合影像学杂志,2005,3(1):44-47.
[18]李锦军,唐海,王炳强,等.隐性骨质疏松性椎体骨折的诊断[J].实用骨科杂志,2011,17(12):1070-1072.
