D-1′-脱氧-2′-异腺苷的合成研究
2018-07-04朱云龙肖伟洪丁海新
朱云龙 唐 杰 肖伟洪 丁海新*
(1.江西科技师范大学有机功能分子研究所,江西 南昌 330013;2.江西省有机功能分子重点实验室,江西 南昌 330013)
异核苷是一类新型的核苷类似物,是天然核苷的碱基位移到糖环的2′或3′位,由于没有天然核苷那样的缩醛结构,因而具有较好的耐酸和耐酶解稳定性。这种独特的性质及与天然核苷结构的相似性使得异核苷具有重要的研究价值和潜在的应用前景[1-3]。已有的研究结果表明一些异核苷具有较强的抗病毒活性[4-5],如D-1′-脱氧-2′-异腺苷对单纯疱疹病毒HSV-1、HSV-2具有良好的抑菌活性[6],L-1′,3′-双脱氧-2′-异腺苷能够有效抑制HIV活性[7]。异核苷化合物由于其糖苷键位置从反应活性活泼的C-1位转移到反应活性较低的C-2位,使其合成难度加大。因此,如何简洁、高效地合成该类化合物从而促进其生物学研究是亟需解决的问题。
本文以四乙酰核糖为原料,经过四步反应得到糖基前体3,5-O-二苄基-1-脱氧-D-核糖(图1),通过对2位离去基团和反应条件的优化,最后经7步反应以55.4%的总产率得到D-腺嘌呤异核苷,操作简便,易于分离,产率高,较之前的反应效果具有明显的改善。
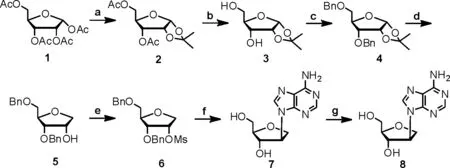
反应条件:a)I2,CH3COCH3,r.t.,3h;b)K2CO3,MeOH,r.t.,2h,85%;c)NaH,BrBn,DMF,r.t.,4h,98%;d)Et3SiH,TMSOTf,DCM,r.t.,4h,80%;e)MsCl,Et3N,CH2Cl2,r.t.,4h,98%;f)Adenosine,K2CO3,18-Crown-6,DMF,110℃,10h,85%;g)BCl3,CH2Cl2,-20℃,10h,98%.图1 D-1′-脱氧-2′-异腺苷的合成路线
一、实验部分
(一)主要试剂和仪器
DMF、二氯甲烷、THF等溶剂均直接采购于北京东方龙顺试剂公司,实验所用柱层析硅胶(200-300目)采购自青岛海洋化工厂,薄层硅胶板(GF254)采购于烟台江友硅胶开发有限公司,其他的试剂均采购于北京伊诺凯试剂公司。
核磁共振谱采用Bruker AV400型核磁共振仪,氘代氯仿和氘代二甲基亚砜为溶剂,TMS为内标,熔点测定采用X-4数字显示显微熔点测定仪,旋光测定采用Autopol IV-T A21200-T 型高精度全自动数字式旋光仪,高分辨数据测定采用Amazon SL型离子阱电喷雾质谱仪。
(二)实验步骤
1、1,2-O-亚异丙基-D-核糖(3)的合成
将β-D-四乙酰核糖1(10.0g,31.4mmol)加入到丙酮(100mL)中并使其溶解,并常温下加入碘(0.5g,2mmol),抽真空,充氩气保护,室温下反应3h,TLC确定反应完全后,加入50mL的NaS2O3(3g,19mmol)溶液来淬灭反应,减压蒸去溶剂,加入蒸馏水(200mL),使用二氯甲烷(200mL ×3)进行萃取,合并有机相,分别用饱和的碳酸氢钠溶液(200mL)和饱和的食盐水(200mL)洗,有机相减压旋干,剩余物溶解在甲醇(100mL)中,加入K2CO3(0.5g,3.6mmol),室温下搅拌2h,TLC确定反应完全后,减压旋干,剩余物进行柱层析纯化,最后得到白色固体5.1g,两步产率为85%。m.p.89-91℃,[α]=+62.3(c 0.1,CH3OH)。
1H NMR(400 MHz,DMSO)δ 5.64(d,J=3.7 Hz,1H),4.97(d,J=6.7 Hz,1H),4.64(t,J=5.7 Hz,1H),4.43(t,J=3.9 Hz,1H),3.77-3.57(m,3H),3.43-3.36(m,1H),1.43(s,3H),1.26(s,3H).
13C NMR(101 MHz,DMSO)δ 111.7,103.8,80.8,79.6,71.0,60.7,27.1,26.9.
HRMS(ESI+):m/z calcd for:C8H14O5[M+Na]+:217.0733,found:217.0733.
3、3,5-O-二苄基-1,2-O-亚异丙基-D-核糖(4)的合成
将上步得到的1,2-O-亚异丙基-D-核糖(20.0g,105.2mmol)加入到DMF中,冰浴0.5h后加入NaH(12.7g(含60%,315.5mmol),室温反应2h后,再重新冰浴0.5h后缓慢滴加苄溴(39.6g,231.3mmol),室温下继续反应6h。TLC确定反应完全后,加入冰水(200mL)淬灭,用二氯甲烷进行萃取(250mL ×3),合并有机相用饱和的食盐水(200mL)洗,减压旋干,剩余物进行柱层析,得到淡黄色油状液体38.3g产率为98%。[α]=+57.7(c 0.1,CH2Cl2)。
1H NMR(400 MHz,DMSO)δ 7.44-7.19(m,10H),5.73(d,J=3.7 Hz,1H),4.71(t,J=4.1 Hz,1H),4.65(d,J=11.9 Hz,1H),4.53-4.42(m,1H),4.00(ddd,J=9.1,5.0,1.9 Hz,1H),3.74(dd,J=9.2,4.4 Hz,1H),3.65(dd,J=11.2,1.9 Hz,1H),3.47(ddd,J=12.1,9.1,5.1 Hz,1H),1.45(s,1H),1.29(s,1H).
13C NMR(101 MHz,DMSO)δ 138.7,138.4,128.7,128.7,128.1,128.0,127.9,112.2,104.3,77.9,77.8,76.9,72.8,71.4,69.2,27.1,26.9.
HRMS(ESI+):m/z calcd for:C22H26O5[M+Na]+:393.1673,found:393.1672.
4、3,5-O-二苄基-1-脱氧-D-核糖的(5)合成
将3,5-O-二苄基-1,2-O-亚异丙基-D-核糖(10.0g,27mmol)加入到精制的二氯甲烷(200mL)中并使其溶解,加入三乙基硅烷(15.7g,134.98mmol),冰浴的条件下缓慢滴入TMSOTf(12g,53.99mmol),室温下反应4h,TLC确定反应完全后,加入冰水(200mL)淬灭,用二氯甲烷(100mL ×3)进行萃取,合并有机相分别用饱和的碳酸氢钠溶液(150mL)和饱和的食盐水(150mL),减压旋干,剩余物进行柱层析,得到淡黄色油状液体6.8g,产率为80.1%。[α]=+47.6(c 0.1,CH2Cl2)。
1H NMR(400 MHz,DMSO)δ 7.42-7.08(m,10H),4.92(d,J=5.3 Hz,1H),4.69(d,J=12.0 Hz,1H),4.52-4.43(m,1H),4.26-4.17(m,1H),3.94(d,J=7.1 Hz,1H),3.90-3.84(m,1H),3.80-3.70(m,1H),3.61(dd,J=9.2,3.1 Hz,1H),3.54(dd,J=10.7,2.7 Hz,1H),3.44(dd,J=10.7,5.2 Hz,1H).
13C NMR(101 MHz,DMSO)δ 138.9,138.8,128.7,128.6,128.1,127.9,127.8,79.9,79.8,73.3,72.8,71.4,71.0,69.3.
HRMS(ESI+):m/z calcd for:C19H26O4[M+Na]+:337.1410,found:337.1416.
5、3,5-O-二苄基-2-甲磺酰基-1-脱氧-D-核糖(6)的合成
将3,5-O-二苄基-1-脱氧-D-核糖(10.0g,31.8mmol)加入到精制二氯甲烷中,再加入精制的三乙胺(44mL,318mmol),抽真空,充氩气保护,在冰浴的条件下加入甲磺酰氯(4.37g,38.2mmol),室温下反应4h,TLC确定反应完全后,加入冰水(100mL)淬灭,用二氯甲烷(100mL ×3)进行萃取,合并有机相分别用饱和的碳酸氢钠溶液(100mL)和饱和的食盐水(100mL)洗,减压旋干,剩余物进行柱层析,得到白色粉状固体14.7g,产率为98%。m.p. 70-71℃,[α]=+92.9(c 0.1,CH2Cl2)。
1H NMR(400 MHz,CDCl3)δ 7.43-7.23(m,10H),5.29(td,J=4.3,2.3 Hz,1H),4.74(d,J=11.4 Hz,1H),4.52(dt,J=12.0,10.9 Hz,3H),4.24-3.99(m,4H),3.70(dd,J=10.8,2.6 Hz,1H),3.53(dd,J=10.8,3.8 Hz,1H),3.05(s,3H).
13C NMR(101 MHz,CDCl3)δ 138.1,137.2,128.7,128.6,128.3,128.3,127.9,127.9,79.6,77.9,77.8,73.7,73.1,71.3,69.2,39.1.
HRMS(ESI+):m/z calcd for:C20H24O6S[M+H]+:415.1185,found:415.1174.
6、D-3′,5′-O-二苄基-1′-脱氧-2′-核糖异腺苷(7)的合成
将3,5-O-二苄基-2-甲磺酰基-1-脱氧-D-核糖(5g,12.7mmol),腺嘌呤(3.5g,25.5mmol),K2CO3(3.5g,25.5mmol),18-冠醚(13.5g,51.0mmol)分别加入到精制的DMF(100mL),抽真空,充氩气保护,移入到110℃油浴中反应10h,TLC确定反应完全后,加入水(200mL)淬灭,用二氯甲烷(100mL ×3)进行萃取,合并有机相用水(200mL ×3)洗,再用饱和的食盐水(100mL)洗,减压旋干,剩余物进行柱层析,得到白色固体4.7g,产率为85%。m.p.135-136 ℃,[α]=+51.6(c 0.1,CH2Cl2)。
1H NMR(400 MHz,DMSO)δ 8.21(s,1H),8.10(s,1H),7.38-7.18(m,12H),5.14(dt,J=5.9,3.0 Hz,1H),4.72(d,J=12.0 Hz,1H),4.57(d,J=12.0 Hz,1H),4.52-4.40(m,2H),4.35(dd,J=10.2,3.1 Hz,1H),4.25-4.12(m,2H),4.02(q,J=4.8 Hz,1H),3.66-3.54(m,2H).
13C NMR(101 MHz,DMSO)δ 156.5,153.0,149.7,139.1,138.5,138.1,128.7,128.1,127.9,127.8,119.3,85.0,83.7,72.8,71.7,70.6,69.8,59.9.
HRMS(ESI+):m/z calcd for:C24H25N5O3[M+Na]+:454.1855,found:454.1857.
8、D-1′-脱氧-2′-核糖异腺苷(8)的合成
将得到的3′,5′-O-二苄基-1′-脱氧-2′-核糖异腺苷(2.0g,4.6mmol)加入到精制的二氯甲烷(20mL)中,抽真空,充氩气保护,放入低温槽将温度调至零下60℃,0.5h后,加入三氯化硼的二氯甲烷溶液(1M)(18.4mL,18.4mmol),在零下60℃反应2h后,再把低温槽的温度调为零下20℃,低温反应6h,然后再向反应溶液中加入甲醇(30mL),室温搅拌4h,后减压旋干,剩余物进行柱层析纯化,最后得到白色固体1.14g,产率为98%。m.p. 222-224 ℃,[α]=-18.1(c 0.1,CH3OH)。
1H NMR(400 MHz,DMSO)δ 8.20(s,1H),8.16(d,J=5.7 Hz,1H),7.28(s,2H),5.81(s,1H),5.18-4.68(m,2H),4.50-4.33(m,1H),4.13(ddd,J=14.5,9.6,5.8 Hz,2H),3.75-3.66(m,1H),3.58(ddd,J=16.9,12.0,4.0 Hz,2H).
13C NMR(101 MHz,DMSO)δ 156.5,152.9,149.9,139.7,119.2,86.4,76.2,70.1,62.4,61.4.
HRMS(ESI+):m/z calcd for:C10H14N5O3[M+H]+:252.1091,found:252.1094.
二、结果与讨论
本文的关键在于利用亲核取代反应并对反应进行不断优化来实现糖基前体和修饰碱基的偶联,在实际的合成中发现,3,5-O-二苄基-2-甲磺酰基-D-核糖作为糖基前体和碱基发生亲核取代反应的效果很好,可以以较高产率得到预期的目标产物,反应选择性较高,操作简便,后处理简单,较之前文献报道的反应效果具有明显的改善。
*基金项目:国家自然科学基金(No.21462019 and No.21676131)、江西省自然科学基金(20143ACB20012)。
[1]Porcheddu A,Giacomelli G,Piredda I,Carta M,Nieddu G.J.Org.Chem.,2008,12,5795-5797.
[2]Akio K,Satoshi S,Takemitsu N,Jun S,Takuma S,Akira M.Tetrahedron,1994,50,10167-10182.
[3]孙志东,朱云龙,黄海洋,宋贤荣,肖强.有机化学,2016,36,2729-2734.
[4]Yu H W,Zhang L R,Zhou J C,Ma L T,Zhang L H.Studies on the Synthesis and Biological Activities of 4′-(R)-Hydroxy-5′-(S)-Hydroxymethyl-Tetrahydrofuranyl Purines and Pyrimidines.Bioorg.Med.Chem.,1996,4,609-612.
[5]Jiang C,Li B,Guan Z,Yang Z,et al.Bioorg.Med.Chem,.2007,15,3019.
[6]Montgomery J A,Thomas H J.Isonucleosides.2.Purine and Pyrimidine-Derivatives of 1,4-Anhydro-2-Deoxy-D-Arabinitol.J.Org.Chem.,1978,43,541.
[7]Huryn D M,Sluboski B C,Tam S Y,Todaro L J,Weigele M.Synthesis of Iso-ddA,Member of a Novel Class of Anti HIV Agents.Tetrahedron Lett.,1989,30,6259-6262.
