变异猪流行性腹泻病毒M和N融合双基因的原核表达及表达产物免疫原性分析
2018-07-04王隆柏王晨燕吴学敏陈秋勇车勇良陈如敬周伦江福建省农业科学院畜牧兽医研究所福建省畜禽疫病防治工程技术研究中心福州350013
王隆柏,王晨燕,吴学敏,陈秋勇,车勇良,陈如敬,周伦江(福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福州 350013)
猪流行性腹泻(porcine epidemic diarrhea PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的急性、高度接触性的肠道疾病,主要导致各阶段发病猪群腹泻、呕吐、脱水或死亡,是目前导致哺乳仔猪发生腹泻死亡的全球性疫病之一[1-2]。该病自1978年英国首次报道[3],随后世界各国均有发生。我国于1980年首次报道PED,并陆续有该病的发生。从2007年以来,因PEDV的基因发生了变异,PEDV又开始在泰国、韩国和越南等国家流行,随后蔓延至日本、中国、加拿大和美国等养猪国家[4-6],导致该病再次暴发,席卷全球。由于该病来势凶猛,且临床症状比以往更为严重,哺乳仔猪的发病率高达100%,死亡率在80%以上,尤其是对7日龄以内的仔猪危害严重[7],死亡率高达100%。PEDV为冠状病毒科,冠状病毒属的成员,主要含有4个结构蛋白,分别为S、M、N及E蛋白。虽然M和N基因相对比较保守,但与经典毒株CV777以及早些年份的毒株相比较,其氨基酸也发生了部分变异,遗传进化树也不在一个分支上[8-11]。目前,已见利用经典PEDV的单个基因(如N、M及S1基因片段),表达出单基因蛋白[1,12],并测定出蛋白具有免疫原性。在双基因表达方面,未见通过变异PEDV的M和N基因片段,利用原核表达载体,通过无缝克隆技术,构建出PEDV的pE2-S-N的融合双基因原核表达质粒。因此,一种构建PEDV的M-N融合双基因表达载体方法的建立,对今后开展该病的诊断技术和免疫研究,具有重要意义和应用前景。
1 材料与方法
1.1 材料
RNA提取试剂盒、胶回收试剂盒、pEASY-Blunt E2(pE2)原核表达载体、pEASY-UniSeamless Cloning and Assembly Kit、dNTPs、FastPfu Fly DNA Polymerase、5×TransStart KD Plus Buffer、TransStart KD Plus DNA Polymerase、Trans1-T1感受态细胞、转染试剂等主要试剂均购自北京全式金生物技术有限公司;羊抗兔IgG-HRP酶和羊抗鼠IgG-HRP酶购自武汉博士德;BLAB/c鼠购自吴氏试验动物公司;10%分离胶和转印膜购自碧云天公司;变异PEDV-FJFQ2014毒株(GenBank登陆号KJ646580)、M蛋白高免血清、N蛋白高免血清及PEDV兔抗高免血清由本科室制备保存。
1.2 方法
1.2.1 引物设计与合成 根据变异PEDV 的M、N基因片段,结合pE2表达载体的引物序列,设计合成引物序列,具体见表1。
表1引物序列
Table1Thesequenceofprimer

片段Fragment引物序列(5′→3′)Sequenceofprimer退火温度/℃Annealingtemperature片段大小/bpSizeoffragmentsM上引M⁃F:ATGTCTAACGGTTTTATTCC55678下引M⁃R:GACTAAATGAAGCACTTTCTM+E2上引E2⁃F:AAGGGCCAATTCCTCGAGCAC606071下引E2⁃R:GACTAAATGAAGCACTTTCTN(引物包含载体部分同源臂)上引N⁃F:GAGAAAGTGCTTCATTTAGTCGCTTCTGTCAGCTTTCAGGAT55 551359下引N⁃R:TGCTCGAGGAATTGGCCCTTATTTCCTGTATCGAAGATCTC
1.2.2 RNA提取及RT反应 按常规方法采用商品化试剂盒提取变异PEDV的RNA。以提取PEDV的RNA为模板,进行RT反应,反应条件为25 ℃ 10 min;50 ℃ 30 min;85 ℃ 5 s。
1.2.3M基因和N基因PCR扩增 按常规方法,以cDNA为模板,进行 PCR扩增。扩增M基因片段的反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,40个循环;72 ℃ 5 min。扩增N基因片段的反应条件为94 ℃ 10 min;94 ℃ 3 s,55 ℃ 30 s,72 ℃ 1.5 min,40个循环;72 ℃ 5 min。扩增产物均通过1.5%琼脂糖凝胶电泳检测。
1.2.4M基因克隆至E2载体 参考说明书进行。连接体系如下:M片段2.0 μL,Blunt-E2载体1.0 μL,使用ddH2O补齐体积至5.0 μL,25 ℃连接10 min;连接产物转化至Trans1-T1感受态细胞中,轻弹混匀,冰浴30 min;42 ℃热激30 s,立即置于冰上2 min;加入平衡至室温的LB培养基,250 r·min-1,37 ℃培养1 h;4 000 r·min-1离心1 min,弃部分上清,保留100 μL,轻弹重悬后涂于Amp+抗性平板上,37 ℃培养过夜,构建出pE2-M质粒。
1.2.5E2-M基因PCR扩增 以pE2-M质粒为模板,反应体系与“1.2.3”相同,进行扩增。反应条件:94 ℃ 10 min;94 ℃ 3 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。扩增产物通过1.5%琼脂糖凝胶电泳检测。
1.2.6 纯化片段 采用回收和纯化试剂盒,分别胶回收纯化PCR扩增的N片段和PCR扩增的E2-M片段。
1.2.7 无缝拼接 参考pEASY-Uni Seamless Cloning and Assembly Kit无缝拼接试剂盒说明书进行。连接体系如下:2×Assembly Mix 5 μL,纯化回收N片段2 μL,纯化回收E2-M片段3 μL;于PCR仪中50 ℃连接15 min。
1.2.8 构建pE2-M-N重组质粒 将N基因片段和E2-M基因片段连接产物全部转化Trans 1-T1感受态细胞中,42 ℃热激30 s,冰上静置2 min,加入400 μL LB培养基中,37 ℃ 200 r·min-1摇菌1 h;取摇好的菌液4 000 r·min-1离心1 min后弃部分上清,取菌株吹悬后涂于Amp+抗性的LB平板上,在37 ℃培养箱里培养过夜;18 h后从培养箱中取出平板,随机挑取转化至Trans1-T1感受态,菌落PCR鉴定阳性单克隆测序。取活菌经过活化后转接入LB氨苄抗性培养基,放入摇床37 ℃ 200 r·min-1培养16 h后,收集菌液提取质粒。
1.2.9 原核蛋白表达及鉴定 取pE2-M-N质粒转化Transetta(DE3)感受态细胞,将克隆菌种分别按照37 ℃(加0.25 μg·mL-1IPTG)、16 ℃(0.25 μg·mL-1IPTG)温度摇床培养,表达融合蛋白。将菌液12 000 r·min-1离心5 min,将上清移入新的EP管中,沉淀用500 μL的1×PBS重悬,分别取50 μL上清和50 μL沉淀重悬液,加入10 μL 蛋白上样缓冲液,煮沸10 min。将蛋白样品跑10% SDS-PAGE,之后进行考染,鉴定表达蛋白情况。
1.2.10 Western blot验证目的蛋白 以PEDV的兔抗高免血清为一抗,羊抗兔IgG-HRP酶为二抗,进行Western blot试验,采用化学发光成像仪进行检测。分别以PEDV的M蛋白和N蛋白鼠抗高免血清为一抗,羊抗鼠IgG-HRP酶为二抗,进行Western blot试验,采用化学发光成像仪进行检测。
1.2.11 鼠抗M-N融合蛋白抗体的制备及活性检测 将诱导融合蛋白进行纯化,与弗氏完全佐剂充分乳化后,以100 μg·只-1的剂量皮下多点接种6只8周龄小鼠,间隔14 d后,将融合蛋白与弗氏不完全佐剂充分乳化后,以同样的方式及剂量进行再次免疫。在第二次免疫21 d后,采小鼠血并分离血清。同时设立2只小鼠免疫生理盐水,作为阴性对照。分别采用纯化的PEDV、M蛋白和N蛋白包被的酶标板,采用ELISA方法检测融合蛋白诱导产生的抗体水平。
2 结 果
2.1 M基因的PCR扩增
以cDNA为模板,进行PCR扩增,扩增产物通过1.5%琼脂糖凝胶电泳检测,获得约678 bp的基因片段,与预期大小相符,如图1。

1. M基因片段;M. DL8000相对分子质量标准1. Fragment of M gene; M. DL8000 marker
图1 M基因扩增结果Fig.1 Colony PCR confirmation of M gene
2.2 N基因的PCR扩增
以cDNA为模板,进行N基因PCR扩增,扩增产物通过1.5%琼脂糖凝胶电泳检测,获得1 359 bp的基因片段,与预期大小相符,如图2。
2.3 E2-M基因的PCR扩增
以M基因片段连接至pE2载体,连接产物转化至Trans1-T1感受态细胞中,再以pE2 -M质粒为模板,进行扩增,扩增产物使用1.5%琼脂糖凝胶电泳检测,获得6 071 bp目的片段,与预期大小相符,如图2。

1. N基因片段;2、3. E2-M基因片段;M. DL8000相对分子质量标准1. Fragment of N gene; 2, 3. Fragment of E2-M gene;M. DL8000 marker
图2 E2-M和N基因片段扩增结果Fig.2 Colony PCR confirmation of E2-M and N gene
2.4 M+N基因的PCR鉴定
将N基因和E2-M基因连接产物全部转化Trans1-T1感受态细胞中,构建出pE2-M-N重组质粒,采用PCR技术进行鉴定,获得大约为2 037 bp基因片段,与预期大小相符,如图3。将PCR产物进行序列测定比对分析,表明扩展序列与PEDV-FJFQ2014毒株相应序列的相似性为99.4%。

1~7 . M+N基因片段; M. DL8000 相对分子质量标准1-7. Fragment of M-N gene; M. DL8000 marker
图3 pE2-M-N重组质粒PCR鉴定电泳图Fig.3 Colony PCR confirmation of pE2-M-N
2.5 原核蛋白的表达
pE2-M-N重组质粒在0.25 μg·mL-1IPTG的诱导下,转化Transetta(DE3)感受态细胞中,在37和16 ℃诱导下蛋白均表达,蛋白条带大小约75 ku,与预期相符,如图4。诱导目的蛋白在上清和包涵体中均有表达,但主要是在沉淀的包涵体表达量比较多。

1. 未诱导的上清; 2. 37 ℃诱导下的上清; 3. 37 ℃诱导下的沉淀;4. 16 ℃诱导下的上清;5 .16 ℃诱导下的沉淀;M. 蛋白质相对分子质量标准1. Not revulsive supernatant; 2 . Revulsive supernatant at 37 ℃; 3.Revulsive precipitation at 37 ℃ ; 4.Revulsive supernatant at 16 ℃; 5. Revulsive precipitation at 16 ℃; M. Protein marker
图4 SDS-PAGE电泳图Fig.4 The SDS-PAGE of protein expressed in Transetta (DE3)
2.6 M-N表达蛋白的纯化
采用包涵体洗涤方法对提取蛋白质进行纯化后,取蛋白质再次进行SDS-PAGE试验,结果获得约75 ku的蛋白片段,如图5。
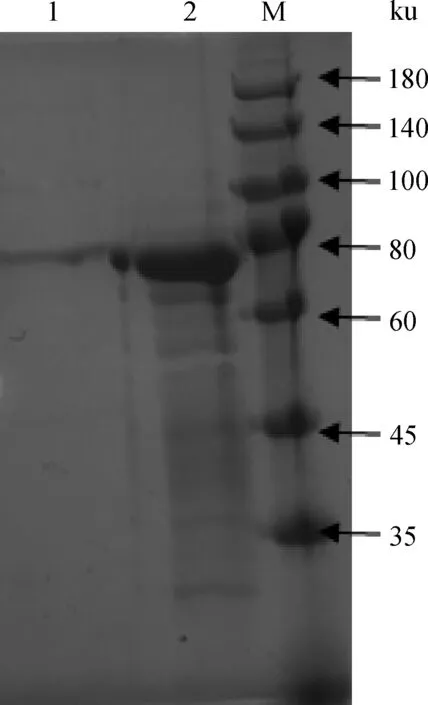
1. 诱导后上清;2.诱导后的沉淀;M.蛋白质相对分子质量标准1. Revulsive supernatant;2.Revulsive precipitation;M. Protein marker
图5 SDS-PAGE检测蛋白表达结果Fig.5 The SDS-PAGE of protein expressed in Transetta(DE3)
2.7 验证目的蛋白的表达情况
以兔抗PEDV高免血清为一抗, 通过Western blot试验表明,获得约75 ku的目的片段,与预期大小相符,说明表达蛋白能与病毒抗体反应,具有反应原性,如图6。

1.表达的蛋白; M.蛋白质相对分子质量标准1. Expressed protein; M.Protein marker
图6 以兔抗PEDV高免血清为一抗用Western blot验证蛋白表达Fig.6 The Western blot of protein expressed in Transetta (DE3) with hyperimmume serum against PEDV
分别以PEDV的M蛋白和N蛋白鼠抗高免血清为一抗,通过Western blot试验表明,分别获得约25和57 ku大小的目的片段,与预期大小相符,说明表达蛋白能与病毒的M蛋白抗体和N蛋白抗体反应,具有反应原性,见图7。

1.M蛋白高免血清组;2. N蛋白高免疫血清组; M.蛋白质相对分子质量标准1. Hyperimmune serum group of M protein;2. Hyperimmune serum group of N protein; M.Protein marker
图7 以PEDV M、N蛋白高免血清为一抗用Western blot验证蛋白表达Fig.7 The Western blot of protein expressed in Transetta (DE3) with hyperimmune sera against M and N protein of PEDV
2.8 鼠抗M-N融合双基因蛋白抗体的获得及活性检测
在M-N融合蛋白二免小鼠21 d后,免疫小鼠血清能与PEDV全病毒、M蛋白和N蛋白发生反应,且相应的效价均在1∶1 000以上,而阴性对照小鼠血清未检测到相应抗体,表明融合蛋白具有较好的免疫活性,见图8。

图8 抗体产生情况Fig.8 The situation of generated antibody
3 讨 论
PEDV属于尼多病毒目、冠状病毒科冠状病毒属成员,病毒核酸为正义单链RNA,PEDV基因组全长约为28 kb[17],主要结构蛋白为纤突糖蛋白(S蛋白)、核衣壳蛋白(N蛋白)、膜蛋白(M蛋白)和小膜蛋白(E蛋白)[18-19]。PEDV的M基因编码整合膜蛋白,是一种穿膜糖蛋白,从N端到C端有3个糖基化位点,通过其C末端与核衣壳结合可使核衣壳和病毒包膜联系在一起[20],从而决定和影响了病毒的出芽。另外,M蛋白能介导机体产生α干扰素,可作为PEDV基因工程疫苗的候选抗原,并已成为开展PEDV血清学诊断抗原的主要蛋白之一。N蛋白与基因组RNA结合, 形成螺旋状的核蛋白体, 参与病毒基因组转录、RNA 的包装、病毒组装,也是病毒主要的免疫原蛋白之一,可诱发机体产生有效的免疫应答[21]。另外,由于N蛋白具有抗原性,在PEDV感染早期就能在猪体内产生较高水平的抗体并诱导病猪体内进行细胞免疫反应[22]。基于M和N基因为病毒的重要功能基因,在体外通过生物技术把M与N基因进行双基因融合,并表达出相应的融合蛋白,对今后开展该病的诊断技术和免疫机制研究,具有重要的现实意义和应用前景。
本文选用pE2哺乳动物原核表达载体,该载体为平末端线性载体,载体两端偶联有拓扑异构酶,此酶具有限制性内切酶和连接酶的功能,因此在构建载体时,只需将载体和特异性片段在25 ℃孵育5~10 min便可快速平端克隆技术克隆PCR产物,通过增强型CMV启动子高效表达目的基因,转化到感受态细胞中进行克隆。另外,在基因连接方面,采用pEASY-Uni Seamless Cloning and Assembly Kit无缝拼接试剂盒,利用试剂盒特殊的重组酶和同源重组的原理,将E2-M线性化后的载体末端片段基因与扩增N基因片段的上游引物中重叠区域的片段进行定向重组,成功实现了M与N基因的高效无缝拼接,这种连接方式仅需要15 min的反应时间,无需对片段进行酶切,不受酶切位点的影响,也不需要额外引进其他基因序列,连接效果可通过PCR和测序方法进行鉴定。本研究将建立的pE2-M-N重组质粒进行了序列测定分析,获得准确的基因片段。
在双基因原核表达方面,乐敏等[23]利用原核表达载体 pGEX-KG构建出猪繁殖与呼吸综合征病毒ORF7和ORF5双基因质粒,并表达出了具有免疫原性的双基因蛋白。本文则根据变异PEDV的M和N基因,通过pE2原核表达载体,构建出变异PEDV的M和N双基因融合质粒,并表达出了M-N融合双基因蛋白,通过Western blot技术和应用于免疫小鼠也进一步验证了表达蛋白具有免疫活性,这为今后开展变异PEDV的免疫诊断技术和免疫学研究奠定了理论基础和技术支撑。
4 结 论
构建变异PEDV的pE2-M-N融合双基因质粒,并表达了具有免疫原性M-N融合蛋白。为进一步开展变异PEDV的诊断技术和免疫学等研究,奠定良好基础。
参考文献(References):
[1] CHANG S H,BAE J L,KANG T J,et al.Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J].MolCells,2002,14(2):295-299.
[2] KO S M,SUN Y J,OH M Y.Expression of the protective antigen for PEDV in transgenic duckweed,Lemnaminor[J].HortEnvironBiotechnol,2011,52(5):511-215.
[3] PURANAVEJA S,POOLPERM P,LERTWATCHARASARAKUL P,et al. Chinese-like strain of porcine epidemic diarrhea virus,Thailand[J].EmergInfectDis,2009,15(7):1112-1115.
[4] WANG L Y,BYRUM B,ZHANG Y.New variant of porcine epidemic diarrhea virus,United States,2014[J].EmergInfectDis,2014,20(5):917-919.
[5] CHEN Q,LI G W,STASKO J,et al.Isolation and characterization of porcine epidemic diarrhea viruses associated with the 2013 disease outbreak among swine in the United States[J].JClinMicrobiol,2014,52(1):234-243.
[6] STEVENSON G W,HOANG H,SCHWARTZ K J,et al.Emergence ofPorcineepidemicdiarrheavirusin the United States:clinical signs,lesions,and viral genomic sequences[J].JVetDiagnInvest,2013,25(5):649-654.
[7] SUN R Q,CAI R J,CHEN Y Q,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China[J].EmergInfectDis,2012,18(1):161-163.
[8] 胡 凌,王 印,杨泽晓,等.7株猪流行性腹泻病毒M基因的克隆与分析[J].中国兽医学报,2015,35(9):1404-1408.
HU L,WANG Y,YANG Z X,et al.Cloning and sequence analysis of M gene of seven strain porcine epidemic diarrhea viruses[J].ChineseJournalofVeterinaryScience,2015,35(9):1404-1408.(in Chinese)
[9] 王隆柏,林裕胜,车勇良,等.猪流行性腹泻病毒S、N和ORF3基因的遗传变异分析[J].畜牧兽医学报,2014,45(11):1830-1836.
WANG L B,LIN Y S,CHE Y L,et al.Genetic variation analysis ofS,NandORF3 genes of porcine epidemic diarrhea virus[J].ActaVeterinariaetZootechnicaSinica,2014,45(11):1830-1836.(in Chinese)
[10] 宋 聪,刘 宁,李美荃,等.猪流行性腹泻病毒云南流行毒株N基因序列分析[J].动物医学进展,2016,37(5):15-19.
SONG C,LIU N,LI M Q,et al.Sequence analysis of N gene of porcine epidemic diarrhea virus epidemic strains in Yunnan Province[J].ProgressinVeterinaryMedicine,2016,37(5):15-19.(in Chinese)
[11] 刘艳成,杜雅楠,吴卫杰,等.内蒙古地区猪腹泻病毒的检测与分析[J].畜牧兽医学报,2015,46(9):1620-1628.
LIU Y C, DU Y N, WU W J, et al.Detection and analysis of porcine diarrhea associated virus in Inner Mongolia[J].ActaVeterinariaetZootechnicaSinica, 2015,46(9):1620-1628.
[12] 向 敏,张 洁,高其双,等.猪流行性腹泻病毒COE核酸疫苗的构建及免疫原性[J].中国兽医学报,2013,33(11):1627-1630.
XIANG M,ZHANG J,GAO Q S,et al.Construction of DNA vaccine of porcine epidemic diarrhea COE and its immunogenicity in mice[J].ChineseJournalofVeterinaryScience,2013,33(11):1627-1630.(in Chinese)
[13] 葛俊伟,姜艳平,汪 淼,等.表面表达猪流行性腹泻病毒核蛋白蛋白的重组干酪乳杆菌诱导产生的免疫应答[J].生物工程学报,2009,25(6):813-818.
GE J W,JIANG Y P,WANG M,et al.Induction of immune response after oral inoculation of mice withLactobacilluscaseisurface-displayed porcine epidemic diarrhea viral N protein[J].ChineseJournalofBiotechnology,2009,25(6):813-818.(in Chinese)
[14] BAE J L,LEE J G,KANG T J,et al.Induction of antigen-specific systemic and mucosal immune responses by feeding animals transgenic plants expressing the antigen[J].Vaccine,2003,21(25-26):4052-4058.
[15] 姚作俊,郝达仁,白 云,等.检测猪流行性腹泻病毒S1蛋白抗体的间接ELISA方法[J].畜牧兽医学报,2017,48(6):1085-1091.
YAO Z J,HAO D R,BAI Y,et al.Indirect ELISA for detecting antibody to porcine epidemic diarrhea virus S1 protein[J].ActaVeterinariaetZootechnicaSinica,2017,48(6):1085-1091.(in Chinese)
[16] 朱卫霞,袁万哲,李丽敏,等.截短猪流行性腹泻病毒N蛋白的可溶性表达及其抗原活性[J].畜牧兽医学报,2014,45(9):1561-1566.
ZHU W X,YUAN W Z,LI L M,et al.Prokaryotic soluble expression of trunked N protein of porcine epidemic diarrhea virus and its antigenic activity[J].ActaVeterinariaetZootechnicaSinica,2014,45(9):1561-1566.(in Chinese)
[17] VLASOVA A N,MARTHALER D,WANG Q H,et al.Distinct characteristics and complex evolution of PEDV strains,North America,May 2013-February 2014[J].EmergInfectDis,2014,20(10):1620-1628.
[18] 张强敏,郭福生,尹燕博,等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学,2002,17(4):381-384.
ZHANG Q M,GUO F S,YIN Y B,et al.Molecular biological traits ofPorcineepidemicdiarrheavirus[J].VirologicaSinica,2002,17(4):381-384.(in Chinese)
[19] SPAAN W,CAVANAGH D,HORZINEK M C.Coronaviruses:structure and genome expression[J].JGenVirol,1988,69:2939-2952.
[20] ESCORS D,ORTEGO J,LAUDE H,et al.The membrane M protein carboxy terminus binds to transmissible gastroenteritis coronavirus core and contributes to core stability[J].JVirol,2001,75(3):1312-1324.
[21] DUARTE M, GELFI J, LAMBERT D, et al.Genome organization of porcine epidemic diarrhea virus[J].AdvExpMedBiol, 1993, 342: 55-60.
[22] KWEON C H,KWON B J,JUNG T S,et al.Isolation of porcine epidemic diarrhea virus (PEDV) in Korea[J].KoreanJVetRes,1993,33(2):249-254.
[23] 乐 敏,邱德新,陈焕春,等.猪繁殖与呼吸综合征病毒orf7和orf5双基因的原核表达研究[J].中国病毒学,2004,19(5):476-480.
YUE M, QIU D X, CHEN H C, et al. Expression of the combinedorf7 andorf5 genes of porcine reproductive and respiratory syndrome virus inE.coli[J].VirologicaSinica, 2004, 19(5):476-480. (in Chinese)
