发酵玉米-豆粕型全价饲料对生长猪生长性能、粪便臭味物质和菌群区系的影响
2018-07-04刘志云钟晓霞谢跃伟黄金秀周晓容重庆市畜牧科学院农业部养猪科学重点实验室重庆402460
刘志云,钟晓霞,谢跃伟,肖 融,江 山,黄 健,黄金秀,周晓容(重庆市畜牧科学院 农业部养猪科学重点实验室,重庆 402460)
随着我国畜牧业的稳定发展以及人们对绿色安全畜产品关注的进一步提升,生物发酵饲料已成为我国饲料工业的重要组成部分。通过微生物的代谢作用,不仅可以降解饲料中的部分多糖、蛋白质、脂肪等大分子物质,生成有机酸、可溶性多肽等小分子物质,提高饲料养分消化率[1],而且发酵饲料中的大量活性益生菌及其代谢产物可调节畜禽肠道微生态平衡,改善肠道功能和健康,对于提高动物生长性能、减少抗生素使用具有重要作用[2]。生物饲料对动物肠道菌群的调节作用,尤其是后肠微生物的改变,直接影响到后肠微生物的发酵方式,进而影响粪便中的恶臭化合物组成[3-4]和猪舍环境卫生。目前,国外关于发酵全价饲料的研究较为成熟,在养猪生产上具有较好的应用效果,但多为液体发酵饲料。国内受限于饲喂设备、工艺等,液体饲喂模式未得到较好发展,研究多为固态发酵工艺,近年来多集中在花生粕[1]、棉粕[5]、豆粕[6]等原料的发酵,全价饲料发酵研究相对较少。
本试验以玉米-豆粕型基础日粮为发酵底物,通过添加外源菌剂,进行厌氧固态发酵,制备成发酵全价饲料,研究固态发酵全价饲料对生长猪生产性能、粪便臭味物质以及粪便菌群区系的影响。
1 材料与方法
1.1 发酵饲料的制备
参照《中国猪饲养标准2004》肉脂型生长猪营养需要量,配制玉米-豆粕型基础日粮,日粮组成及其营养水平见表1。随后将日粮与水按55∶47的比例混合均匀,使水分含量达到50%左右,接种0.5%的发酵菌液,混合均匀后分装入发酵桶中密封,自然发酵3 d后即可使用,每桶拆封后3 d内用完。所用发酵菌液为短乳杆菌与地衣芽孢杆菌,二者比例为1∶1。
1.2 试验设计
试验于2017年4-5月在重庆市畜牧科学院动物营养研究所试验猪场进行。选取22 kg左右,体重相近的(约克夏×荣昌猪二元杂交猪)生长猪90头,随机分成3组,每组6个重复,每个重复5头,经7 d预饲后,分别饲喂无抗日粮(对照组),含0.04% 杆菌肽锌(有效含量为10%)的日粮(抗生素组),发酵全价日粮(发酵组),试验期30 d。试验期间,猪只自由采食和饮水,按猪场常规程序消毒免疫。
表1基础饲粮组成及营养水平(风干基础)
Table1Thecompositionandnutrientlevelsofbasaldiets(airdrybasis) %

1). 预混料为每千克饲粮提供: VA 1 500 IU,VD3200 IU,VE 10 IU,VK 30.5 mg,生物素0.05 mg,胆碱0.3 g,叶酸0.3 mg,烟酸10.0 mg,泛酸10.0 mg,VB11.0 mg,VB22.5 mg,VB61.0 mg,VB1210.0 μg,Cu 4 mg,Fe 60 mg,Zn 65 mg,Mn 3 mg,Se 0.25 mg,I 0.15 mg。2). 所有营养成分均为计算值
1). The premix provides the following per kg of diets: VA 1 500 IU, VD3200 IU, VE 10 IU, VK 30.5 mg, Biotin 0.05 mg, choline 0.3 g, folic acid 0.3 mg, niacin 10.0 mg, pantothenic acid 10.0 mg, VB11.0 mg, VB22.5 mg, VB61.0 mg, VB1210.0 μg, Cu 4 mg, Fe 60 mg, Zn 65 mg, Mn 3 mg, Se 0.25 mg, I 0.15 mg.2). All of the values are calculated
1.3 样品采集与生长性能测定
试验期间,以圈为单位记录采食量。试验结束时空腹称重,记录猪只末重,计算平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)。
试验结束当天上午8:00,以圈为单位采集猪新鲜排泄的粪便,使用无菌勺掰开粪便,取未沾到地面的中心部分,放到无菌封口袋中,收集半袋后混匀,一部分分装于EP管中,-80 ℃保存,用于粪便菌落多样性检测和分析;另一部分分装于50 mL离心管,放置于冰盒中,运回实验室后立即处理样品,测定吲哚、3-甲基吲哚、对甲酚以及挥发性脂肪酸(VFA)含量。
1.4 粪便臭味物质测定
饲料常规养分测定参照《饲料分析及饲料质量检测技术》[7]。发酵饲料pH的检测:称取10 g样品置于90 mL水中,混匀后在摇床上震荡30 min,静置,用pH计测定pH。饲料中乳酸含量测定采用对羟基联苯比色法进行测定[8];乳酸菌含量按照《GB4789.35-2010食品微生物学检验 乳酸菌检验》进行测定。粪便中苯环类化合物(对甲酚、吲哚、3-甲基吲哚)[9]以及VFA[10]的测定采用气相色谱法。
1.5 粪便菌群丰度和多样性测定
粪便总DNA的抽提采用MoBio PowerFecal®DNA提取试剂盒(MoBio, USA),参照说明书的提取方法提取总DNA。DNA片段的完整性经1%琼脂糖胶检测。随后对16S rRNA V3-V4基因片段进行PCR(ABI GeneAmp®9700型)扩增,所用引物为338F (5′-ACTCCTACGGGAGGCAGCA-3′) 和806R (5′-GGACTACHVGGGTWTCTAAT-3′)[11]。试验采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase 20 μL反应体系:5×FastPfu Buffer 4 μL,2.5 mmol·L-1dNTPs 2 μL,Forward Primer(5 μmol·L-1) 0.8 μL,Reverse Primer(5 μmol·L-1) 0.8 μL,FastPfu Polymerase 0.4 μL,Template DNA 10 ng,补ddH2O至20 μL。PCR扩增产物经2%琼脂糖凝胶电泳检测,切胶回收,进行MiSeq 高通量测序(Illumina, San Diego, USA),高通量测序由上海美吉生物医药科技有限公司完成。
对测序得到的序列质量进行质控和过滤后,在97%的相似水平下进行OUT聚类和生物信息统计分析,以MOTHUR软件及序列聚类软件Usearch(vsesion 7.1)进行序列比较及分析(对比数据库为Silva)。
1.6 数据处理及统计分析
试验数据以“平均值±标准误”表示。采用SPSS19.0对发酵饲料营养物质变化进行独立样本t-检验,对猪只生长性能、臭味物质进行单因素方差分析,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 饲粮发酵前后营养物质变化
由表2可以看出,基础日粮经发酵处理后,粗蛋白、粗灰分、粗纤维含量未见显著变化,粗脂肪含量显著升高(P<0.01),钙(P<0.01)和总磷(P<0.05)含量显著降低,pH显著降低(P<0.01),乳酸菌含量为9.67 lg cfu·g-1,乳酸含量为421.67 mmol·kg-1,大肠杆菌未检出。由表3可以看出,基础日粮经发酵处理后,总氨基酸和必需氨基酸含量都没有出现显著变化,非必需氨基酸的丝氨酸(P<0.05)和精氨酸(P<0.01)显著降低,丙氨酸显著升高(P=0.01)。
表2饲料发酵前后营养成分变化(风干基础)
Table2Nutrientsvariationoffeedbeforeandafterfermentation(airdrybasis)

项目Item发酵前Beforefermentation发酵后AfterfermentationP值P⁃value粗蛋白/%CP15.76±0.2515.87±0.110.526粗灰分/%ASH4.27±0.124.04±0.090.052粗脂肪/%EE2.37±0.042.73±0.100.005粗纤维/%CF3.60±0.073.87±0.190.074钙/%Ca0.82±0.0060.79±0.010.007总磷/%TP0.48±0.0060.46±0.0060.013乳酸菌/(lgcfu·g-1)LAB-9.67±0.17-pH6.89±0.024.11±0.01<0.0001乳酸/(mmol·kg-1)Lacticacid-421.67±69.70-
-表示检测限以下
- is below detection threshold
表3饲料发酵前后氨基酸含量的变化(风干基础)
Table3Changeofaminoacidcontentsoffeedbeforeandafterfermentation(airdrybasis) %

2.2 发酵饲料对生长猪生产性能的影响
由表4可以看出,发酵组猪只末重和ADG均显著高于对照组(P<0.05),与抗生素组相比差异不显著(P>0.05);ADFI显著高于对照组和抗生素组(P=0.001);F/G显著低于对照组(P<0.05),与抗生素组相比差异不显著(P>0.05)。试验期间发酵组和抗生素组猪只均未出现患病淘汰,对照组淘汰两头。
表4发酵全价饲料对生长猪生长性能的影响
Table4TheeffectofFCFonthegrowthperformanceofgrowingpigs

项目Item对照组Controlgroup抗生素组Antibioticsgroup发酵组FermentationgroupP值P⁃value初始均重/kgIABW22.53±0.1522.90±0.1922.82±0.040.589末重/kgFinalweight38.58±0.28b39.42±0.40ab40.12±0.25a0.025平均日增重/gADG548.30±7.84b569.50±11.79ab596.60±7.96a0.018平均日采食量/gADFI1.31±0.005b1.32±0.002b1.36±0.01a0.001F/G2.41±0.03a2.33±0.05ab2.27±0.05b0.086死淘率/%Mortality6.67±4.22a0.00±0.00b0.00±0.00b0.068
各组间,同行肩标字母不同表示差异显著(P<0.05),下同
Values with different letters superscripts mean significant difference among different groups (P<0.05). The same as below
2.3 发酵饲料对生长猪粪便臭味物质的影响
由表5可以看出,发酵组猪只新鲜粪便中的吲哚含量极显著低于对照组和抗生素组(P<0.01),对甲酚含量有升高趋势,粪臭素和VFA含量有下降趋势,其中丙酸和丁酸含量显著低于抗生素组(P<0.05),与对照组相比差异不显著(P>0.05),乙酸、异戊酸、戊酸含量差异不显著(P>0.05)。
表5发酵饲料对生长猪粪便臭味物质的影响
Table5TheeffectofFCFontheodorconcentrationinfaecesofgrowingpigs

项目Item对照组Controlgroup抗生素组Antibioticsgroup发酵组FermentationgroupP值P⁃value对甲酚/(μg·g-1)P⁃cresol426.27±27.73370.48±15.56430.34±57.270.351吲哚/(μg·g-1)Indole50.21±5.80a38.26±3.50a23.46±5.09b0.006粪臭素/(μg·g-1)Skatole59.71±9.0657.68±11.5055.88±14.870.834乙酸/(mg·g-1)Aceticacid3.89±0.594.46±0.353.66±0.270.222丙酸/(mg·g-1)Propionicacid1.67±0.20ab1.98±0.12a1.42±0.10b0.115丁酸/(mg·g-1)Butyrate0.95±0.13ab1.14±0.15a0.73±0.08b0.103异戊酸/(mg·g-1)Isovalericacid0.16±0.050.19±0.030.16±0.040.616戊酸/(mg·g-1)Valericacid0.07±0.030.13±0.040.03±0.010.051
2.4 发酵饲料对生长猪粪菌群的影响
2.4.1 粪便细菌α-多样性分析 提取粪便微生物基因组进行测序,分析不同处理粪便菌群的丰度和多样性,从宏观上评估发酵饲料对猪肠道微生物菌群的影响。从表6可以看出,发酵组猪只粪便菌群物种的丰度指数Sobs显著高于对照组和抗生素组(P<0.05),对照组和抗生素组相比差异不显著;发酵组和抗生素组的Chao 1指数和Ace指数显著高于对照组(P<0.05)。与对照组和抗生素组相比,发酵组的多样性指数Shannon升高、Simpson指数降低,但均未达到显著水平。表明饲喂发酵饲料可以提高猪粪便菌群的丰度,同时具有提高粪便菌群多样性的趋势。
2.4.2 粪便菌群结构变化 由图1可以看出,发酵组的样本聚类程度很高,组内相似度高,而与对照组和抗生素组的样本距离较远,与二者的组间相似度低。
从图2可以看出,在门水平上(图2a、2b),发酵组的Tenericutes相对丰度高于其他两组,Saccharibacteria含量高于抗生素组。在属水平上(图2c、2d),发酵组的菌落组成明显区别于其他两组,其中发酵组的Lactobacillus、Streptococcus、Rikenellaceae、Megasphaera、Oscillospira、Mitsuokella、Prevotella相对丰度低于对照组和抗生素组;Clostridium、Turicibacter、Mollicutes、Anaerostipes、Acetitomaculum相对丰度高于对照组和抗生素组;对照组的Bifidobacterium相对丰度高于抗生素组和发酵组,抗生素组的Escherichia-Shigella相对丰度高于发酵组和对照组。
表6粪便菌群多样性指数表
Table6Alphadiversityindexesofbacterialcommunityinfaeces
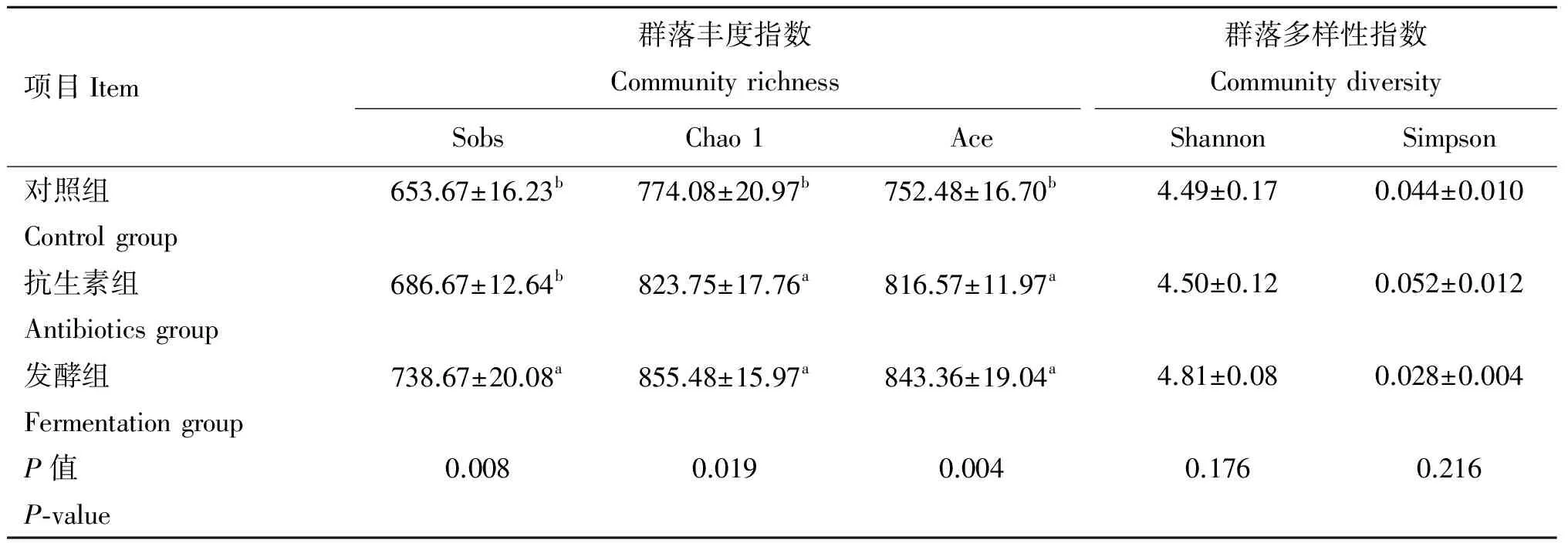
项目Item群落丰度指数CommunityrichnessSobsChao1Ace群落多样性指数CommunitydiversityShannonSimpson对照组Controlgroup653.67±16.23b774.08±20.97b752.48±16.70b4.49±0.170.044±0.010抗生素组Antibioticsgroup686.67±12.64b823.75±17.76a816.57±11.97a4.50±0.120.052±0.012发酵组Fermentationgroup738.67±20.08a855.48±15.97a843.36±19.04a4.81±0.080.028±0.004P值P⁃value0.0080.0190.0040.1760.216
不同组间,同列肩标字母不同表示差异显著(P<0.05)
Values with different letters superscripts mean significant difference among different groups (P<0.05)
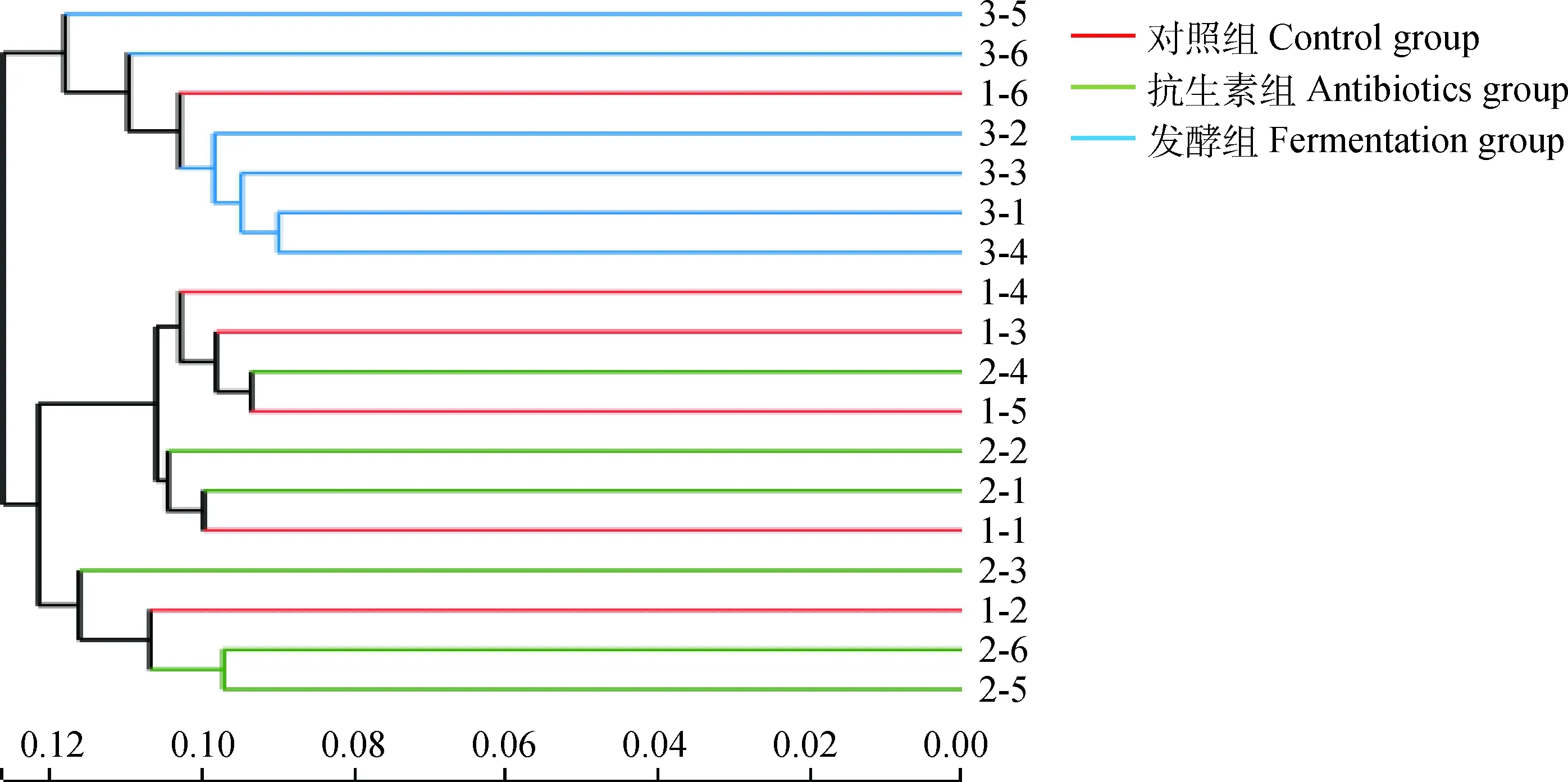
1-1~1-6为对照组的6个样本,2-1~2-6为抗生素组的6个样本,3-1~3-6为发酵组的6个样本,下同1-1 to 1-6 are the 6 samples of control group, 2-1 to 2-6 are the 6 samples of antibiotics group, 3-1 to 3-6 are the 6 samples of fermentation group, the same as below
图1 基于OTU水平的样本聚类分析图Fig.1 Hierarchical clustering tree at OTU level
3 讨 论
试验采用短乳杆菌和地衣芽孢杆菌作为发酵菌株,对全价饲料进行了3 d自然发酵后,得到发酵全价饲料,经测定发酵饲料的pH为4.11,乳酸菌活菌数为9.67 lg cfu·g-1,乳酸含量约为421.67 mmol·kg-1,这与Brooks[2]和Missotten等[12]描述的理想发酵饲料的条件相符。研究表明,发酵饲料的低pH以及高浓度的乳酸含量可以有效抑制肠杆菌、沙门氏菌等病原菌在饲料中生长繁殖[2, 13-14]。饲料在发酵过程中,大肠杆菌和沙门氏菌能够使赖氨酸等合成氨基酸降解,生成1,5-二氨基戊烷(尸胺)[15-16],人工接种乳酸菌,通过控制发酵饲料的乳酸含量和pH,可以有效保护赖氨酸等合成氨基酸不被分解[17],有利于发酵饲料长期安全存储。本研究测得的发酵全价饲料中既没有大肠杆菌检出,赖氨酸含量也没有显著改变,保证了发酵全价饲料的安全性。
在生长猪生产性能方面,与无抗基础日粮相比,饲喂发酵饲料可以提高生长猪ADFI、ADG和饲料转化率,降低生长猪死淘率。与含抗生素的基础日粮相比,饲喂发酵饲料可以显著提高生长猪ADFI、ADG和饲料转化效率,但差异不显著。大量研究结果表明,饲喂发酵饲料可以减少生长猪饮水量,提高干物质采食量、动物日增重和饲料转化效率[18-20]。本试验对生长猪生产性能的分析结果与上述研究相一致。表明发酵全价饲料具有替代抗生素、促进动物生长、提高饲料转化率的作用。

a、c为样本平均丰度,b、d为各个样本丰度;a、b为门水平,c、d为属水平a, c. The average abundance of samples; b, d. The abundance of individual sample; a, b. At the phylum level; c, d. At the genus level
图2 猪粪便菌群丰度柱状图Fig.2 Bar plots showing percentage of bacterial community in pig feces
研究表明,猪粪便中最主要的恶臭气体是挥发性脂肪酸、酚类、吲哚类、硫醇类[21]。其中对甲酚、吲哚、粪臭素在猪粪臭味物质中的相对含量高且不易去除;挥发性脂肪酸则与猪粪恶臭强度之间存在良好的相关性,且碳链越长除臭难度越大[22-23]。因此,本试验主要以对甲酚、吲哚、粪臭素和挥发性脂肪酸的含量作为考核指标。从结果中可以看出,饲喂发酵全价饲料可以降低粪便中吲哚、粪臭素、挥发性脂肪酸(乙酸、丙酸、丁酸、异戊酸、戊酸)含量,其中对吲哚、丙酸、丁酸的降低效果达到了显著水平。表明全价料经发酵后,一方面养分消化率得到了提高;另一方面,饲喂发酵饲料改变了猪肠道微生物的菌群结构,从而影响了其对营养物质的消化吸收以及后肠微生物发酵方式,最终影响到粪便挥发性臭味物质的含量[3-4]。
研究表明,日粮类型可以改变肠道菌群结构[24],而新鲜粪便菌落组成在一定程度上可以反映猪后肠道菌群组成的特征。本试验比较了无抗基础日粮、含抗生素的基础日粮以及发酵全价料对猪粪便微生物群落的影响。结果表明,与无抗基础日粮相比,含抗生素的基础日粮在一定程度上提高了粪便菌群的丰度,对粪便菌群多样性没有显著影响;与这两组相比,发酵全价饲料显著提高了粪便菌群的物种丰度,在一定程度上提高了物种多样性。此外,饲喂无抗基础日粮、含抗生素基础日粮的猪只粪便物种组成相似,但明显区别于发酵全价饲料组,其中饲喂发酵全价饲料的粪便中属Lactobacillus、Streptococcus、Rikenellaceae、Megasphaera、Oscillospira、Mitsuokella、Prevotella的相对丰度低于其它两组;门Tenericutes,属Clostridium、Turicibacter、Mollicutes、Anaerostipes、Acetitomaculum的相对丰度高于其它两组。发酵饲料可以改变动物胃肠道菌群组成,其中影响最显著的就是乳酸菌,研究表明,饲喂液态发酵饲料可以提高生长猪后肠段中乳酸菌的相对丰度[25],提高母猪及其后代生长猪粪便中的乳酸杆菌数量[26],然而本研究发现,饲喂发酵饲料降低了猪只粪便中乳酸菌的相对丰度,这可能是由于发酵饲料对胃肠道中乳酸菌的影响,与不同品种猪的生理阶段、肠道位点以及肠道内容物的培养条件都有关系,因此有待于进一步分析不同肠段位点中菌落组成特征。
4 结 论
发酵玉米-豆粕型全价饲料饲喂生长猪可以提高其生长性能,降低粪便中吲哚、粪臭素、挥发性脂肪酸的含量,提高对甲酚含量,提高新鲜粪便菌群丰度和多样性,改变粪便菌落组成。
参考文献(References):
[1] YANG X J,TENG D,WANG X M,et al.Enhancement of nutritional and antioxidant properties of peanut meal by bio-modification withBacilluslicheniformis[J].ApplBiochemBiotechnol,2016,180(6):1227-1242.
[2] BROOKS P H.Fermented liquid feed for pigs[J].CABRev:PerspectAgric,VetSci,NutrNatResour,2008,3(73):437-466.
[3] NEISH A S.Microbes in gastrointestinal health and disease[J].Gastroenterology,2009,136(1):65-80.
[4] ITO T,MIYAMOTO H,KUMAGAI Y,et al.Thermophile-fermented compost extract as a possible feed additive to enhance fecundity in the laying hen and pig:modulation of gut metabolism[J].JBiosciBioeng,2016,121(6):659-664.
[5] 聂存喜,张文举,闫理东,等.基于棉籽粕源发酵饲料的鸡血浆代谢组学研究[J].畜牧兽医学报,2013,44(5):737-744.
NIE C X,ZHANG W J,YAN L D,et al.A metabolomics study on chicken plasma based on fermented feed from cottonseed meal mixed substrate[J].ActaVeterinariaetZootechnicaSinica,2013,44(5):737-744.(in Chinese)
[6] IL K K,JIN H S,JUN C S,et al.Process for preparing fermented soybean meal:US,US2016015055[P].2016-01-21.
[7] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
ZHANG L Y.Feed analysis and feed quality testing technology[M].3rd ed.Beijing:China Agricultural University Press,2007.(in Chinese)
[8] 万楚筠,钮琰星,黄凤洪,等.对羟基联苯比色法测定乳酸显色反应条件的研究[J].食品工业科技,2013,34(7):322-324,353.
WAN C Y,NIU Y X,HUANG F H,et al.Study on chromogenic reaction conditions of lactic acid determination by p-hydroxydiphenyl colorimetry[J].ScienceandTechnologyofFoodIndustry,2013,34(7):322-324,353.(in Chinese)
[9] 宋 凡.气相色谱法快速测定猪排泄物中吲哚和3-甲基吲哚含量[J].饲料与畜牧,2014(5):35-37.
SONG F.Rapid determination of indole and 3-methylindole content in swine excreta by gas chromatography[J].FeedandHusbandry,2014(5):35-37.(in Chinese)
[10] 龙黎明,毛胜勇,苏 勇,等.一株瘤胃源乳酸利用菌的分离鉴定及其体外代谢特性[J].微生物学报,2008,48(12):1571-1577.
LONG L M,MAO S Y,SU Y,et al.Isolation andinvitrometabolic characterization of a lactate-utilizing bacterium from goat rumen[J].ActaMicrobiologicaSinica,2008,48(12):1571-1577.(in Chinese)
[11] XU N,TAN G C,WANG H Y,et al.Effect of biochar additions to soil on nitrogen leaching,microbial biomass and bacterial community structure[J].EurJSoilBiol,2016,74:1-8.
[12] MISSOTTEN J A,MICHIELS J,DEGROOTE J,et al.Fermented liquid feed for pigs:an ancient technique for the future[J].JAnimSciBiotechnol,2015,6(1):4.
[13] BEAL J D,NIVEN S J,CAMPBELL A,et al.The effect of temperature on the growth and persistence ofSalmonellain fermented liquid pig feed[J].IntJFoodMicrobiol,2002,79(1-2):99-104.
[14] LINDGREN S E,DOBROGOSZ W J.Antagonistic activities of lactic acid bacteria in food and feed fermentations[J].FEMSMicrobiolRev,1990,7(1-2):149-164.
[15] NIVEN S J,BEAL J D,BROOKS P H.The effect of controlled fermentation on the fate of synthetic lysine in liquid diets for pigs[J].AnimFeedSciTechnol,2006,129(3-4):304-315.
[16] CANIBE N,JENSEN B B.饲料加工方式对发酵过程中游离赖氨酸微生物降解的影响[J].张兰兰,刘 洁,译.饲料与畜牧,2010(9):53-55.
CANIBE N,JENSEN B B .The effect of artifactitious pattern of the feed,on the biodegradation of free amino acid during the in fermentation processes[J].ZHANG L L,LIU J,Trans.FeedandHusbandry,2010(9):53-55.(in Chinese)
[17] 王金全,周岩华,蔡辉益.国际猪液体饲喂研究进展[J].养猪,2009(4):11-14.
WANG J Q,ZHOU Y H,CAI H Y.Research progress of fermented liquid feed in the world[J].SwineProduction,2009(4):11-14.(in Chinese)
[18] RUSSELL P J,GEARY T M,BROOKS P H,et al.Performance,water use and effluent output of weaner pigs fedadlibitumwith either dry pellets or liquid feed and the role of microbial activity in the liquid feed[J].JSciFoodAgr,1996,72(1):8-16.
[19] ROTH F X,KIRCHGESSNER M.Organic acids as feed additives for young pigs:nutritional and gastrointestinal effects[J].JAnimFeedSci,1998,7(S1):25-33.
[20] 马 广,欧阳张智,廖秀冬,等.复合菌固态发酵全价饲料对猪生产性能的影响[J].饲料工业,2015,36(1):19-23.
MA G,OUYANG Z Z,LIAO X D,et al.Effect of complete feed of solid state fermentation by compound bacteria on production performance in pig[J].FeedIndustry,2015,36(1):19-23.(in Chinese)
[21] HOBBS P J,PAIN B F,KAY R M,et al.Reduction of odorous compounds in fresh pig slurry by dietary control of crude protein[J].JSciFoodAgr,1996,71(4):508-514.
[22] 李 峰,张 可,金 鑫,等.武汉亮斑水虻对猪粪的除臭功能研究[J].化学与生物工程,2016,33(7):28-33.
LI F,ZHANG K,JIN X,et al.Research on swine manure deodorization by larvae of black soldier fly Wuhan strain[J].Chemistry&Bioengineering,2016,33(7):28-33.(in Chinese)
[23] 曾正清,孙振钧,VAN KEMPEN T,等.牛粪和蚯蚓粪对猪排泄物中臭气化合物产量的影响[J].中国农业大学学报,2003,8(3):37-42.
ZENG Z Q,SUN Z J,VAN KEMPEN T,et al.Effect of cattle feces and wormcompost supplementation on odor compounds in pig slurry[J].JournalofChinaAgriculturalUniversity,2003,8(3):37-42.(in Chinese)
[24] COTILLARD A,KENNEDY S P,KONG L C,et al.Dietary intervention impact on gut microbial gene richness[J].Nature,2013,500(7464):585-588.
[25] MORAN C A,SCHOLTEN R H J,TRICARICO J M,et al.Fermentation of wheat:effects of backslopping different proportions of pre-fermented wheat on the microbialand chemical composition[J].ArchAnimNutr,2006,60(2):158-169.
