环境高温诱导巴马香猪睾丸细胞凋亡并激活Nrf2/HO-1抗氧化信号通路
2018-07-04李延森李照见贾潇潇李春梅南京农业大学动物科技学院南京210095
李延森,李照见,贾潇潇,李春梅(南京农业大学动物科技学院,南京 210095)
夏季环境高温引起的公猪热应激是困扰公猪生产的一大难题。随着全球气候变暖趋势加剧,近年来许多地区,特别是长江中下游地区相继出现夏季持续性高温高热天气,一些城市(武汉、南京、苏州、上海、杭州)夏季高温更是突破40 ℃,致使畜舍饲养环境温度大幅升高。夏季高温会引起公猪生理内分泌紊乱和公猪睾丸机能障碍,精液品质下降[1],间接导致母猪受胎率降低和胎儿不良发育[2],进而降低生猪生产能力,给畜牧业造成巨大经济损失。研究发现,高温引起的睾丸组织氧化应激以及生精上皮细胞凋亡和死亡,直接导致生精上皮损伤,精子活力和密度的降低[3-4]。核转录因子(nuclear factor erythroid 2-related factor 2, Nrf2)信号通路能够显著诱导机体内源性抗氧化应答,其缺失或激活障碍,会加剧氧化应激程度,使细胞内正常氧化还原稳态失衡,导致细胞功能障碍,引起细胞毒性,细胞凋亡或死亡,它是目前发现的细胞抗氧化应答的核心途径之一[5-6]。血红素加氧酶1(heme oxygenase 1, HO-1)能被各种引起细胞氧化应激损伤的因素所诱导,其mRNA和蛋白质在组织中的表达上调通常也被认为是氧化应激的标志,HO-1及其催化产物作为体内具有高活性的抗氧化成分,能高效清除细胞过量的活性氧,缓解细胞应激,维持细胞氧化还原平衡,发挥细胞保护作用[7]。已有研究表明,Nrf2蛋白和HO-1蛋白可以在睾丸间质细胞高水平表达,可有效缓解应激原引起的睾丸组织细胞损伤和精子生成障碍[8-10]。然而,目前与睾丸组织细胞Nrf2蛋白和HO-1蛋白表达相关研究只局限在人或鼠上,还未发现猪睾丸组织细胞中表达定位Nrf2蛋白和HO-1蛋白的报道,也没有发现测定猪睾丸组织细胞Nrf2蛋白通路或HO-1蛋白表达模式的研究报道。因此,本试验旨在通过研究高温环境对巴马香猪阴囊温度分布和睾丸组织中抗氧化和细胞凋亡相关蛋白表达的影响,揭示猪阴囊散热机制,明确猪睾丸组织细胞中Nrf2蛋白和HO-1蛋白表达定位模式,为探索从细胞抗氧化分子机制方面缓解高温环境导致的公猪精液品质下降提供参考依据。
1 材料与方法
1.1 试验动物
选取巴马香猪(泰州泰和生物科技有限公司)为试验对象。
1.2 试验设计
选取7月龄体重相近雄性巴马香猪(平均体重(17.93±0.91) kg)12头,随机分成2组,对照组和高温组,每组6头。对照组饲养环境温度保持在25 ℃,高温组饲养环境温度为24 h从25~40 ℃循环变温(变温分4个阶段:①09:00-10:00, 25 ℃→40 ℃;②10:00-15:00, 40 ℃;③ 15:00-16:00, 40 ℃→26 ℃;④16:00-09:00, 25 ℃),连续8 d。高温期间使用热成像仪(TiR27,Fluke Corporation,Washington,USA)记录动物体表温度和阴囊皮肤温度分布。测量阴囊皮肤温度数值是指单次测量时整个阴囊皮肤温度的平均值。体表温度数值是指单次测量时整个体表温度,包括动物头、耳朵、躯体、四肢和尾巴表面温度的平均值。测量的温度数值通过Fluke Smart View 3.1 图像分析软件分析所得。
1.3 样品采集与处理
第8天高温处理结束后,取猪睾丸器官,浸于4%多聚甲醛溶液,用于免疫组织化学检测抗氧化通路标志蛋白Nrf2,抗氧化蛋白HO-1和细胞凋亡标志蛋白(cleaved caspase 3,c-caspase 3)的组织表达情况。
1.4 组织切片和免疫组织化学检测
4%多聚甲醛溶液固定好的睾丸组织,依次分别通过梯度酒精脱水,二甲苯透明,石蜡包埋和切片,制作睾丸组织石蜡切片;然后,依次通过二甲苯和梯度酒精脱蜡止水后,用3% H2O2-甲醇处理1 h,消除内源性过氧化物酶活性;再用0.01 mol·L-1柠檬酸三钠(pH=6.0)微波炉抗原热修复10 min,冷却,0.01 mol·L-1PBS(pH=7.2~7.4)洗涤3次;10%上样血清封闭1 h,甩干,分别加一抗Nrf2抗体(abcam, ab53019),HO-1抗体(abcam, ab13248),c-caspase 3(cell signaling, 9661S)抗体过夜;甩去一抗,PBS摇床洗3次,甩干,加二抗,湿盒孵育2 h,PBS摇床洗3次,甩干,加SARC湿盒孵育1 h,PBS摇床洗3次,DAB显色,镜检蛋白着色表达情况;苏木素复染40 s,冲洗返蓝,常规脱水,透明,封片,最后镜检拍照。光镜下观察,棕色颗粒染色表示蛋白呈阳性。利用Image Pro Plus 6.0 软件(media cybernetics bethesda, MD, USA)分析对照组和高温组睾丸组织Nrf2和HO-1蛋白表达情况。对细胞核阳性表达c-caspase 3的细胞进行计数,分别获得细胞核阳性表达c-caspase3细胞的百分比。
1.5 数据分析
采用GraphPad Prism Version 5.0 统计软件(GraphPad Software, San Diego, CA, USA)进行数据分析,所有数据用“平均值±标准误(Mean±SEM)”表示,对照组和高温组睾丸组织蛋白表达采用t检验进行差异显著性分析,P<0.05表示差异显著。
2 结 果
2.1 环境高温对巴马香猪体表温度和阴囊皮肤温度分布的影响
由表1可知,高温组猪体表温度显著升高,升高幅度达到1.9 ℃,所测体表温度范围中最大温度点为39.7 ℃,最小温度点为34.9 ℃,对照组最大温度点为38.8℃,最小温度点为28.0 ℃;高温组猪阴囊表面平均温度显著升高,升高幅度达到3.7 ℃,所测阴囊表面温度范围中最大温度点为38.4 ℃,最小温度点为36.3 ℃,对照组分别为最大温度点为35.0 ℃,最小温度点为31.7 ℃,最大温度和最小温度分别升高3.4 ℃和4.6 ℃。高温组阴囊皮肤升高温度幅度大于体表温度升高幅度。与对照组相比,高温组猪活动减少,表现嗜睡。由图1可知,猪体体表温度升高幅度较高部分为猪头、耳朵、四肢以及背部,相比之下腹部温度升高幅度较低。发射率表示物体表面辐射出的能量与相同温度的黑体辐射能量的比率。
表1环境高温对巴马香猪体表温度和阴囊皮肤温度参数的影响
Table1EffectofhighambienttemperatureonbodyandscrotalsurfacetemperaturesinBamaminiaturepig

部位Position分组Treatment平均温度/℃Avergetemperature最小温度/℃Minimumtemperature最大温度/℃Maximumtemperature发射率Emissivity体表Bodysurface对照Thermalneutral36.6±1.14a28.038.80.95高温Heat⁃treated38.5±0.59b34.939.70.95阴囊表面Scrotalsurface对照Thermalneutral33.4±0.71∗31.735.00.95高温Heat⁃treated37.1±0.37∗36.338.40.95
同列数据上标小写字母不同表示体表温度组间差异显著(P<0.05),*.阴囊表面温度组间差异显著(P<0.05)(n=6)
Differentsmall letters in the same colum means significant difference in the body surface between the thermal neutral and the heat-treated treatments(P<0.05),* in the same colum means significant difference in the scrotal surface between the thermal neutral and the heat-treated treatments(P<0.05)(n=6)

A.对照组猪热红外分布图;B.对照组猪可见光图;C. 高温组猪热红外分布图;D. 高温组猪可见光图。T.睾丸A.The infrared images of pigs in the thermal neutral group;B.The infrared images of pigs in the thermal neutral group;C.The visible images of pigs in the heat-treated group;D.The visible images of pigs in the heat-treated group.T.Testis
图1 环境高温条件下巴马香猪体表和阴囊皮肤热红外分布图Fig.1 The infrared distribution images of body and scrotal surface in Bama miniature pig under high ambient temperature
2.2 环境高温对巴马香猪睾丸组织Nrf2蛋白表达的影响
由图2可知,Nrf2蛋白主要在睾丸间质细胞表达(图2A1,B1,C,D),在睾丸生精小管表达较低(图2A2,B2)。高温环境影响巴马香猪睾丸组织Nrf2蛋白表达,主要对睾丸间质细胞中Nrf2蛋白表达产生显著影响,与对照组相比,高温组睾丸间质细胞Nrf2蛋白表达显著升高(图2E,P<0.05)。对照组睾丸间质细胞核显示为蓝色,而高温组睾丸间质细胞核显示为明显的棕色(图2 B1),这说明细胞核Nrf2蛋白表达明显升高。高温环境影响巴马香猪睾丸生精小管上皮组织Nrf2蛋白表达,与对照组相比,高温组睾丸生精上皮组织Nrf2蛋白表达显著升高(图2E,P<0.05)
2.3 环境高温对巴马香猪睾丸组织HO-1蛋白表达的影响
由图3可知,HO-1蛋白主要在睾丸间质细胞表达(图3 A1,B1,C,D),在睾丸生精小管表达较低(图3 A2,B2),与Nrf2表达模式相似,不同的是HO-1蛋白在高温组和对照组睾丸间质细胞核的表达相似,高温组并没有出现明显的细胞核HO-1蛋白棕色染色现象,这证明了Nrf2的核转录因子作用。高温环境影响巴马香猪睾丸组织HO-1蛋白表达,主要对睾丸间质细胞中HO-1蛋白表达产生显著影响,与对照组相比,高温组睾丸间质细胞HO-1蛋白表达显著升高(图3E,P<0.05),对照组睾丸间质细胞核与高温组睾丸间质细胞核都表现蓝色(图3 B1),说明高温不改变细胞核HO-1蛋白表达,或者高温不促进HO-1蛋白在细胞核中累积。高温环境影响巴马香猪睾丸生精小管上皮组织HO-1蛋白表达,与对照组相比,高温组睾丸生精上皮组织HO-1蛋白表达显著升高(图3E,P<0.05)。
2.4 环境高温对巴马香猪睾丸组织细胞核阳性表达c-caspase 3蛋白细胞百分比的影响
由图4可知,正常情况下,睾丸间质和睾丸生精上皮细胞核都会阳性表达c-caspase 3蛋白,与对照组相比,在高温组猪睾丸间质和睾丸生精上皮细胞核阳性表达c-caspase 3蛋白细胞百分比显著升高(图4E,A1与B1,A2与B2之间差异显著,P<0.05),其中,睾丸间质细胞核阳性表达c-caspase 3蛋白细胞百分比由8.5%升高至32.5%,升高2.8倍,高温组睾丸生精上皮细胞核阳性表达c-caspase 3蛋白细胞百分比由3.5%升高至29.8%,升高7.5倍,相比间质细胞升高更为明显。

睾丸组织Nrf2蛋白免疫组织化学染色:A.对照组;A1.对照组睾丸间质细胞染色;A2.对照组睾丸生精上皮染色;B.高温组;B1.高温组睾丸间质细胞染色;B2.高温组睾丸生精上皮染色;→.Nrf2蛋白染色的睾丸间质细胞,红色长方形代表Nrf2在睾丸间质细胞表达,黄色长方形代表Nrf2在睾丸生精上皮细胞表达,棕色为蛋白阳性表达,蓝色为细胞核染色。ipp软件增强睾丸组织Nrf2蛋白免疫组织化学染色为红色:C.对照组;D.高温组;E.ipp软件分析对应睾丸不同区域A1、A2、B1和B2的Nrf2蛋白染色的平均光密度。*.A1和B1、A2和B2,P<0.05。下同Immunohistochemical detection of Nrf2 in the thermal neutral group (A) and the heat-treated group (B). The red and yellow rectangles enlarged immunohistochemical detection of Nrf2 in testicular interstitial cells of the thermal neutral group (A1) and the heat-treated group (B1),and immunohistochemical detection of Nrf2 in testicular seminiferous epithelium of the thermal neutral group (A2) and the heat-treated group (B2). The immunohistochemical signal appears brown; the counterstained background appears blue. →.Stained interstitial cells. E.The quantitative evaluation of mean density of Nrf2 immunostaining in interstitial cells and seminiferous epithelium of the thermal neutral group (C) and the heat-treated group (D),and Nrf2 immunostaining areas are highlighted in red colour. *.A1 and B1,A2and B2,P<0.05. The same as below
图2 环境高温对巴马香猪睾丸组织Nrf2蛋白表达的影响Fig.2 Effect of high ambient temperature on the testicular Nrf2 protein expression in Bama miniature pig

睾丸组织HO-1蛋白免疫组织化学染色:A.对照组;A1.对照组睾丸间质细胞染色;A2.对照组睾丸生精上皮染色;B.高温组;B1.高温组睾丸间质细胞染色;B2.高温组睾丸生精上皮染色;→.HO-1蛋白染色的睾丸间质细胞,红色长方形代表HO-1在睾丸间质细胞表达,黄色长方形代表HO-1在睾丸生精上皮细胞表达,棕色为蛋白阳性表达,蓝色为细胞核染色。ipp软件增强睾丸组织HO-1蛋白免疫组织化学染色为红色:C.对照组;D.高温组;E.ipp软件分析对应睾丸不同区域A1,A2,B1,B2的Nrf2蛋白染色的平均光密度Immunohistochemical detection of HO-1 in the thermal neutral group (A) and the heat-treated group (B). The red and yellow rectangles enlarged immunohistochemical detection of HO-1 in testicular interstitial cells of the thermal neutral group (A1) and the heat-treated group (B1),and immunohistochemical detection of HO-1 in testicular seminiferous epithelium of the thermal neutral group (A2) and the heat-treated group (B2). The immunohistochemical signal appears brown. The counterstained background appears blue. →, stained interstitial cells. E. The quantitative evaluation of mean density of HO-1 immunostaining in interstitial cells and seminiferous epithelium of the thermal neutral group (C) and the heat-treated group (D), and HO-1 immunostaining areas are highlighted in red colour
图3 环境高温对巴马香猪睾丸组织HO-1蛋白表达的影响Fig.3 Effect of high ambient temperature on the testicular HO-1 protein expression in Bama miniature pig
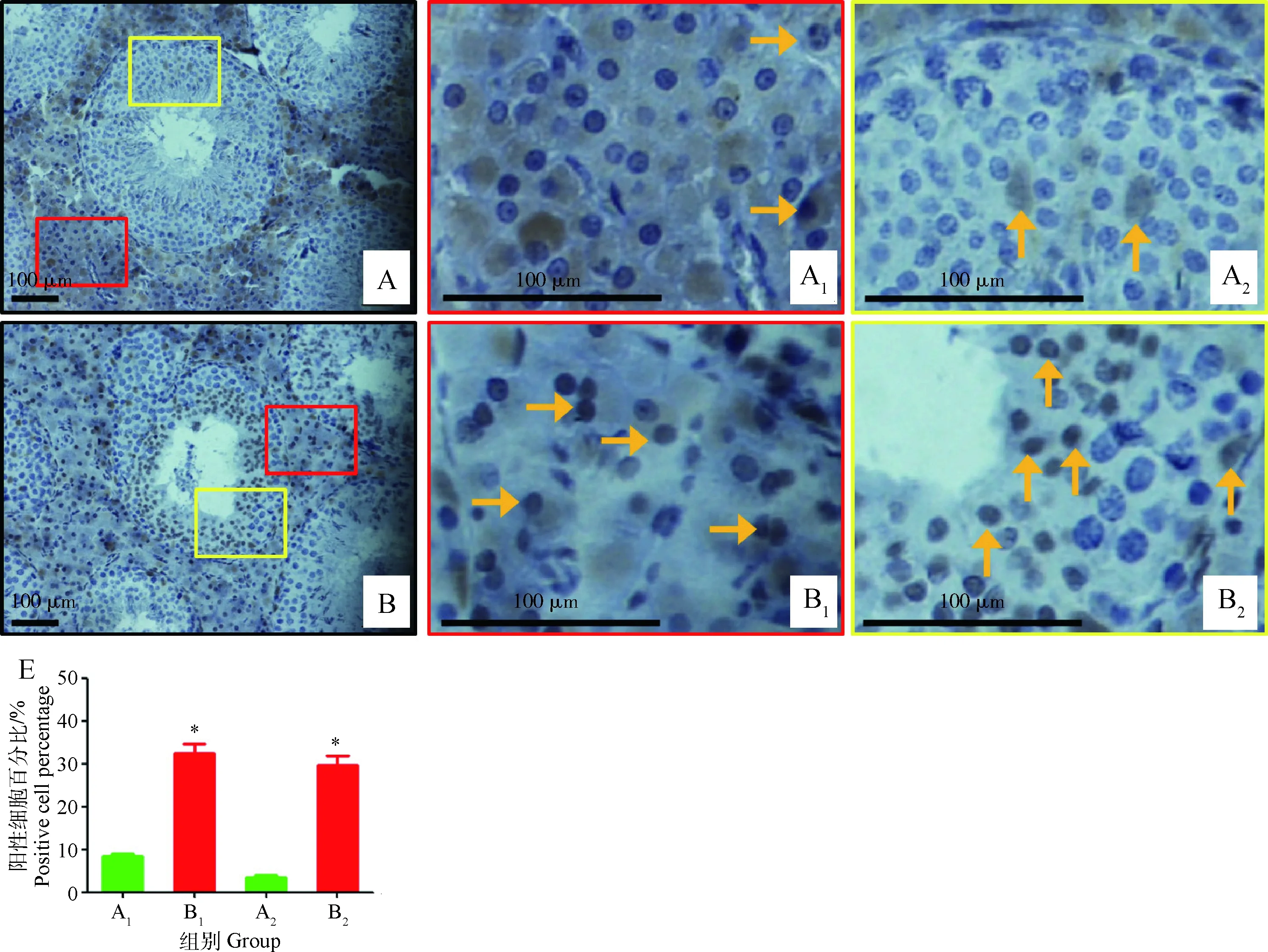
睾丸组织细胞核阳性表达c-caspase 3蛋白的细胞:A.对照组;A1.对照组睾丸间质细胞核阳性表达c-caspase 3蛋白的细胞;A2.对照组睾丸生精上皮细胞核阳性表达c-caspase 3蛋白的细胞;B.高温组;B1.高温组睾丸间质细胞核阳性表达c-caspase 3蛋白的细胞;B2.高温组睾丸生精上皮细胞核阳性表达c-caspase 3蛋白的细胞;→.睾丸间质细胞核阳性表达c-caspase 3蛋白的细胞;↑.生精上皮细胞核阳性表达c-caspase 3蛋白的细胞;红色长方形代表c-caspase 3在睾丸间质细胞表达,黄色长方形代表c-caspase 3在睾丸生精上皮细胞表达,棕色表示c-caspase 3蛋白阳性表达。E.睾丸不同区域A1,A2,B1,B2的细胞核阳性表达c-caspase 3蛋白的细胞百分比Percentage of cellswith c-caspase 3-positive nucleuses in the thermal neutral group and the heat-treated group. Sections of control (A) and heated testes (B). The red and yellow rectangles enlarged immunohistochemical detection of c-caspase 3-positive interstitial cells of the thermal neutral group (A1) and the heat-treated group (B1),and immunohistochemical detection of c-caspase 3-positive germ cells in testicular seminiferous epithelium of the thermal neutral group (A2) and the heat-treated group (B2).→.c-caspase 3-positive interstitial cells;↑.c-caspase 3-positive germ cells;The positive cells appear brown in colour. E. The percentage of positive cells in the thermal neutral group and the heat-treated group
图4 环境高温对巴马香猪睾丸组织细胞核阳性表达c-caspase 3蛋白的细胞百分比的影响Fig.4 Effect of high ambient temperature on percentage of cells with the c-caspase 3-positive nucleuses in testes of Bama miniature pig
3 讨 论
3.1 环境高温对巴马香猪体表温度和阴囊皮肤温度分布影响
猪皮肤表面温度受自身体温和外界环境的双重影响,一般距离体核较远,皮毛较少,散热面积较大部位,变化较大。如果环境温度高于体表温度,机体蒸发散热须排除体内产热和自然得热,才能维持体温正常,只有汗腺机能发达的灵长类可以通过加强蒸发散热维持体温正常,一般家畜很难维持体温恒定[11]。猪汗腺不发达,高温环境主要通过加强呼吸道蒸发散热维持体温,如果高温持续时间较久,便很难维持体温恒定。余进等[12]将中国实验用小型猪暴露于高于猪体表温度40 ℃的环境温度中,与暴露之前相比猪体表温度和直肠温度显著升高,表现呼吸急促,排尿减少,喜饮水或滚卧粪尿。Li等[13]利用FLUKE TiR27红外成像仪对高温环境中小鼠的体表温度和阴囊温度测定发现,体表温度和阴囊温度显著升高,同时直肠温度也显著升高。对夏季高温期间公猪直肠温度和阴囊皮肤温度测定发现,当环境温度处于35 ℃时,公猪直肠温度升高幅度接近1 ℃,阴囊皮肤温度升高幅度接近3.5 ℃[14]。在本试验中,高温组猪体表温度和阴囊表面平均温度显著升高,阴囊皮肤温度仍旧明显低于体表皮肤温度,但阴囊皮肤升高温度幅度>体表温度升高幅度。由于猪阴囊皮肤有丰富的汗腺,并且肉膜能在气温升高时变松弛使阴囊变薄,而猪皮肤汗腺退化,所以在高温时阴囊皮肤较体表皮肤蒸发散热更强,使得高温组阴囊皮肤温度仍低于体表温度。同时,本试验也表明当环境温度高于一定值后,阴囊的热调节功能达到极致,随着体核温度升高睾丸温度也伴随升高,阴囊皮肤温度升高幅度变大。
3.2 环境高温对巴马香猪睾丸组织Nrf2蛋白表达影响
抗氧化信号通路Nrf2/ARE (antioxidant responsive element, ARE)是机体抵抗内外环境应激的重要防御性转导通路之一。细胞正常代谢时,转录因子Nrf2在细胞质和细胞核中含量处于相对稳定状态。当细胞处于环境应激状态时,细胞质中的Nrf2转位入核,使细胞核中Nrf2含量升高,增加其与核内抗氧化应答元件上GCTGAGTCA位点结合,提高ARE调控的多种解毒酶及抗氧化酶基因表达,增强细胞对环境应激的抗性,进而维持细胞和组织器官内环境稳定[15]。小鼠高温环境热应激和小鼠阴囊水浴局部热应激都能够显著诱导睾丸间质细胞和生精上皮细胞中Nrf2蛋白表达,并促使睾丸间质细胞胞质Nrf2蛋白转位入核[13,16]。利用Western blot方法测定阴囊局部热应激小鼠睾丸细胞胞质和胞核中Nrf2蛋白表达发现,高温可促使睾丸细胞中胞质Nrf2向胞核中转移累积的现象[17]。除此,很多体内外研究也发现Nrf2蛋白不仅在睾丸间质细胞表达,而且在应对外界应激导致的损伤以及维持间质细胞睾酮分泌功能发挥重要作用[8,18]。本研究结果表明,环境高温显著增加猪睾丸间质细胞和生精上皮组织Nrf2蛋白表达,其中睾丸间质细胞中Nrf2表达更高,入核现象更明显。由此可见,猪睾丸间质细胞可高效表达Nrf2蛋白,并且猪在受到高温环境暴露时会有效激活睾丸间质细胞中Nrf2蛋白通路,这可能在一定程度上维持了睾丸间质细胞的正常功能,缓解高温诱导的睾丸温度升高对生精上皮造成的损伤。
3.3 环境高温对巴马香猪睾丸组织HO-1蛋白表达影响
HO-1即热休克蛋白32,能被各种引起细胞氧化应激损伤因素所诱导,包括高氧、缺氧、热休克、内毒素、过氧化氢、紫外线和重金属等,其mRNA和蛋白质在组织中的上调表达通常也被认为是氧化应激的标志[7]。在细胞应激发生时,HO-1作为血红素降解的起始酶和限速酶能快速催化应激诱导红细胞破坏产生的血红素,其催化产生的胆绿素、CO以及亚铁作为体内具有高活性的抗氧化成分,能高效清除细胞内由应激产生的活性氧,维持细胞氧化还原平衡和细胞内环境稳态,缓解血红素毒性和细胞应激,发挥细胞保护作用[19]。近年研究发现,睾丸间质细胞受到环境应激后,能够通过上调HO-1的mRNA和蛋白质表达,缓解柴油机纳米颗粒物等环境应激引起的细胞凋亡或死亡[20-21]。HO-1可受许多上游信号激活,其中核转录因子Nrf2是通过结合ARE序列激活HO-1启动子,启动HO-1 mRNA表达。因此,通过Nrf2/ARE信号通路上调HO-1表达也已成为近年研究者攻克细胞氧化应激难题的首要选择[22]。本研究结果表明,在睾丸组织中,环境高温主要诱导睾丸间质细胞中HO-1蛋白高水平表达,这说明猪睾丸间质细胞可高效表达HO-1蛋白,并通过启动HO-1蛋白表达,抵抗环境高温引起的睾丸组织损伤。考虑到高温同时诱导了睾丸间质细胞Nrf2蛋白入核,这表明高温可能是通过激活Nrf2/ARE/HO-1信号通路间接上调HO-1表达,进而发挥细胞保护作用。
3.4 环境高温对巴马香猪睾丸组织细胞核阳性表达cleaved caspase 3蛋白细胞百分比影响
一般情况下,有丝分裂活动旺盛的细胞,如癌细胞和生殖细胞,比体细胞更易受到热应激影响。研究发现细胞存活率和温度之间存在一定关系,当细胞温度处于或高于42.5 ℃左右,大多数细胞存活率快速下降,对于生精细胞,温度超过36.5 ℃时,会导致生精细胞凋亡,当温度超过43 ℃时,生精细胞则主要表现为坏死[23]。在体内,热诱导细胞生物学效应在不同细胞的表现也不同,精母细胞和早期精子细胞,不具有热耐受性,很容易出现细胞凋亡,而支持细胞和间质细胞具有完善的抗氧化体系和较强的热耐受性,对温度的敏感性较低[24]。免疫组织化学染色方法测定热应激大白公猪睾丸组织中c-caspase 3蛋白表达,发现热应激处理会诱导公猪睾丸支持细胞和间质细胞c-caspase 3蛋白表达,并且大量生精细胞细胞核呈c-caspase 3蛋白阳性着色[25]。本研究结果表明,环境高温诱导猪睾丸间质和睾丸生精上皮细胞核阳性表达c-caspase 3蛋白,并且睾丸生精上皮细胞核阳性表达c-caspase 3蛋白的细胞百分比升高幅度更为明显,这说明环境高温可诱导公猪睾丸组织细胞凋亡。由于生精细胞热耐受性较间质细胞弱,因此睾丸生精上皮细胞比睾丸间质细胞对高温反应更加敏感,出现凋亡的比例也更多。
4 结 论
本研究表明,猪睾丸组织间质细胞和生精上皮细胞可表达Nrf2蛋白和HO-1蛋白。环境高温可促进睾丸间质细胞Nrf2蛋白入核,并且高效表达HO-1蛋白。环境高温会诱导公猪睾丸组织细胞凋亡,其中生精上皮细胞比睾丸间质细胞对高温更加敏感,出现凋亡比例更多,这可能是由于环境温度超过了阴囊的最大热调节功能范围,随着体核温度升高睾丸温度也伴随升高,进而引起细胞应激损伤,最终导致猪睾丸组织细胞凋亡增加。同时,激活的Nrf2信号通路和高效表达的HO-1蛋白,是猪睾丸组织通过体内分子途径缓解高温环境诱导损伤的有效措施,也给体内寻找解决热应激导致公猪精液品质下降难题,提供潜在的有效分子靶点。
参考文献(References):
[1] 李延森, 曹 云, 王爱华, 等. 南通地区不同品种公猪夏季精液品质变化[J]. 畜牧与兽医, 2014, 46(10): 40-42.
LI Y S, CAO Y, WANG A H, et al. The changes in boar semen quality of different type strains in the area of Nantong during hot summer[J].AnimalHusbandry&VeterinaryMedicine, 2014, 46(10): 40-42. (in Chinese)
[2] 李延森, 沈祥星, 李春梅. 母猪发情和产仔性能与环境温度变化相关性分析[J]. 畜牧兽医学报, 2016, 47(6): 1133-1139.
LI Y S, SHEN X X, LI C M. Correlation analysis between the ambient temperatures and reproductive performance of sows[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(6): 1133-1139. (in Chinese)
[3] PAUL C, TENG S, SAUNDERS P T K. A single, mild, transient scrotal heat stress causes hypoxia and oxidative stress in mouse testes, which induces germ cell death[J].BiolReprod, 2009, 80(5): 913-919.
[4] ZHANG M Q, JIANG M, BI Y, et al. Autophagy and apoptosis act as partners to induce germ cell death after heat stress in mice[J].PLoSOne, 2012, 7(7): e41412.
[5] SPORNM B, LIBY K T. Nrf2 and cancer: The good, the bad and the importance of context[J].NatRevCancer, 2012, 12(8): 564-571.
[6] BELLK F, AL-MUBARAK B, FOWLER J H, et al. Mild oxidative stress activates Nrf2 in astrocytes, which contributes to neuroprotective ischemic preconditioning[J].ProcNatlAcadSciUSA, 2011, 108(1): E1-E2.
[7] SOARESM P, BACH F H. Heme oxygenase-1: From biology to therapeutic potential[J].TrendsMolMed, 2009, 15(2): 50-58.
[8] SHEN B, WANG W, DING L, et al. Nuclear factor erythroid 2-related factor 2 rescues the oxidative stress induced by di-N-butylphthalate in testicular Leydig cells[J].HumExpToxicol, 2015, 32(2): 145-152.
[9] SHIRAISHI K, NAITO K. Increased expression of Leydig cell haem oxygenase-1 preserves spermatogenesis in varicocele[J].HumReprod, 2005, 20(9): 2608-2613.
[10] BAE W J, HA U S, CHOI J B, et al. Protective effect of decursin extracted from Angelica gigas in male infertility via Nrf2/HO-1 signaling pathway[J].OxidMedCellLongev, 2016, 2016: 5901098.
[11] 颜培实, 李如治. 家畜环境卫生学[M]. 北京: 高等教育出版社, 2011.
YAN P S, LI R Z. Domestic animals and environmental hygiene[M]. Beijing: China Higher Education Press, 2011. (in Chinese)
[12] YU J, YIN P, LIU F H, et al. Effect of heat stress on the porcine small intestine: A morphological and gene expression study[J].CompBiochemPhysiolA, 2010, 156(1): 119-128.
[13] LI Y S, HUANG Y, PIAO Y G, et al. Protective effects of nuclear factor erythroid 2-related factor 2 on whole body heat stress-induced oxidative damage in the mouse testis[J].ReprodBiolEndocrin, 2013, 11: 23.
[14] LI Y S, WANG A H, TAYA K, et al. Declining semen quality and steadying seminal plasma ions in heat-stressed boar model[J].ReprodMedBiol, 2015, 14(4): 171-177.
[15] MAHER J, YAMAMOTO M. The rise of antioxidant signaling-the evolution and hormetic actions of Nrf2[J].ToxicolApplPharmacol, 2010, 244(1): 4-15.
[16] LI Y S, CAO Y, WANG F, et al. Scrotal heat induced the Nrf2-driven antioxidant response during oxidative stress and apoptosis in the mouse testis[J].ActaHistochem, 2014, 116(5): 883-890.
[17] LI Y S, CAO Y, WANG F, et al.Tert-butylhydroquinone attenuates scrotal heat-induced damage by regulating Nrf2-antioxidant system in the mouse testis[J].GenCompEndocrinol, 2014, 208: 12-20.
[18] CHEN H L, JIN S Y, GUO J J, et al. Knockout of the transcription factorNrf2: Effects on testosterone production by aging mouse Leydig cells[J].MolCellEndocrinol, 2015, 409: 113-120.
[19] STOCKER R. Induction of haem oxygenase as a defence against oxidative stress[J].FreeRadicResCommun, 1990, 9(2): 101-112.
[20] KOMATSU T, TABATA M, KUBO-IRIE M, et al. The effects of nanoparticles on mouse testis Leydig cellsinvitro[J].Toxicolinvitro, 2008, 22(8): 1825-1831.
[21] OZAWA N, GODA N, MAKINO N, et al. Leydig cell-derived heme oxygenase-1 regulates apoptosis of premeiotic germ cells in response to stress[J].JClinInvest, 2002, 109(4): 457-467.
[22] ALAM J, COOK J L. How many transcription factors does it take to turn on the heme oxygenase-1 gene?[J].AmJRespirCellMolBiol, 2007, 36(2): 166-174.
[23] AGARWAL A, JOHN A R, ALVAREZ J G. Studies on men’s health and fertility[M]. New Jersey: Humana Press, 2012.
[24] HARDY M P, GANJAM V K. Stress, 11β-HSD, and Leydig cell function[J].JAndrol, 1997, 18(5): 475-479.
[25] 范小瑞, 张 禛, 席华明, 等. 热应激对猪睾丸Cyt-C和Caspase-3表达的影响[J]. 中国农业科学, 2017, 50(5): 924-931.
FAN X R, ZHANG Z, XI H M, et al. Effect of heat stress on the expression of Cyt-C and Caspase-3 in boar testis[J].ScientiaAgriculturaSinica, 2017, 50(5): 924-931. (in Chinese)
