Cu2+胁迫下花斑裸鲤IL-8基因的组织表达分析
2018-07-04栗瑞红韩步鹰王玉晴王国杰王振吉李长忠
栗瑞红,韩步鹰,张 霞,王玉晴,马 睿,吴 君,王国杰,王振吉,李长忠*
(1.青海大学 生态环境工程学院,青海 西宁 810016;2 青海省渔业环境监测站,青海 西宁 810012)
花斑裸鲤(Gymnocypriseckloni)又称大嘴鱼,鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)裸鲤属(Gymnocypris)。是我国黄河上游特有的土著鱼类,在高原淡水生态系统的食物链中具有重要的地位,也是我国重要的水生野生动物种质资源。花斑裸鲤目前的研究主要集中在在系统发育和起源、遗传多样性、人工繁育和驯化养殖、胚胎发育以及生物学特性等方面[1-2]。花斑裸鲤长期生存在无污染的天然水体中,对于重金属胁迫的敏感性尚不明了,重金属污染对花斑裸鲤的潜在危害和风险需要系统评估。本试验以花斑裸鲤为研究对象,通过白细胞介素-8(interleukin 8,IL-8)对Cu2+胁迫下不同组织的应答特点来筛选重金属胁迫下生物标记物,以期对环境中水体污染进行早期预警,实现水体生态环境和土著鱼类资源的保护。IL-8是第一个在哺乳动物中发现的能够趋化中性粒细胞的细胞因子[3]。它的氨基酸序列被分为CXC,CC,C和CX3C四个亚型[4-5]。IL-8蛋白在促进细胞迁移、炎症发生和引发呼吸爆发等方面发挥着至关重要的作用[6-9]。目前,IL-8基因在褐牙鲆(Paralichthysolivaceus)[10]、七鳃鳗(Lampetrafluviatilis)[11]、虹鳟(Oncorhynchusmykiss)[12]、鲤(Cyprinuscarpio)[13]等鱼类中被克隆,而对IL-8的重金属胁迫应答方面的研究较少。铜是鱼类所必需的微量元素之一,过量时依旧会损伤鱼类的神经生理功能,破坏嗅觉器官的结构以及内分泌功能[14-15]。为了控制渔业水域水质,防止水体生物受到污染,《国家渔业水质标准》(GB11607-89)中规定水体中的铜浓度应小于等于0.01 mg/L。
本研究克隆鉴定了花斑裸鲤GeIL-8基因,分析了GeIL-8在肝脏、肾脏、脑和鳃组织中的表达分布特点,并对花斑裸鲤在0.01 mg/L Cu2+胁迫下GeIL-8基因在各个组织中mRNA水平的表达量进行检测,分析Cu2+胁迫下GeIL-8的应答模式,旨在为生物标记物的筛选、水环境污染的早期预警以及花斑裸鲤的保护等奠定基础。
1 材料与方法
1.1 材料
1.1.1 花斑裸鲤 2015年08月15日从青海省渔业环境监测站隆务河口养殖场(青海,循化)取3龄期成体花斑裸鲤20尾,平均体长为(20.3±2.5)cm,平均体质量(90.1±10.5) g。试验在青海大学生态环境工程学院细胞遗传实验室4个水族箱(480 mm×250 mm×455 mm)内进行。试验开始前,水族箱用0.5 ppm的高锰酸钾(分析纯)溶液浸泡30 min,然后用清水反复清洗确保无高锰酸钾残留。花斑裸鲤运回后,在水族箱内暂养2周并每天正常投食以避免饥饿对实验结果的影响。养殖期间用水皆为曝气2 d的自来水且每天更换1/3,试验期间用自动增氧泵增氧保证溶氧量不低于6 mg/L。
1.1.2 试剂及仪器 总RNA提取试剂盒(DP419),购自天根生物试剂公司;琼脂糖凝胶DNA回收试剂盒(D1200),购自索莱宝生物试剂公司;PrimeScriptTMⅡ1st strand cDNASynthesis Kit(6210A)、pMDTM19-T Vector Cloning Kit(6013)、3'Full RACE Core Set with PrimeScriptTM RTase试剂盒(6106)、SMARTer○RRACE 5'/3' Kit (634859)、Premix ExTaq酶,PrimeScriptTM RT reagent Kit(Perfect Real Time)(RR0370A),均购自TaKaRa公司;SYBR Green Supermix,购自伯乐生物公司;大肠杆菌DH5α感受态细胞,由上海生工生物有限公司提供,引物合成与序列测定也由该公司完成;Nano Drop 2000 RNA浓度测定仪,购自美国Thermo Scientific公司,实时荧光定量PCR仪(CFX96),购自美国BIO-RAD公司。
1.2 Cu2+胁迫
参考国家渔业水质标准对渔业水质Cu2+质量浓度小于等于0.01 mg/L的规定,本试验选取0.01 mg/L的Cu2+对花斑裸鲤进行胁迫。挑取健康无伤病和规格相近的花斑裸鲤个体20尾,随机均分为空白对照组和3个平行试验组,空白对照组正常饲养,试验组进行Cu2+胁迫。在Cu2+胁迫的0,12,24和36 h时从各组随机取样3尾,将鱼击昏后擦去表面水渍,在冰上迅速剖取肝脏、鳃、肾和脑组织,液氮中迅速冷冻后置于-80 ℃冰箱中保存,待用。
1.3 总RNA提取与cDNA合成
使用总RNA提取试剂盒提取花斑裸鲤肝脏、鳃、肾和脑组织的总RNA,用1.2%琼脂糖凝胶电泳检测RNA完整性合格后,用Nano Drop 2000测定RNA浓度。利用Prime ScriptTMⅡ1st strand cDNA Synthesis Kit进行反转录,并调整样品总cDNA质量浓度为100 ng/μL。
1.4 花斑裸鲤GeIL-8全长序列的克隆
1.4.1 引物的设计与合成 根据GenBank中虹鳟鱼(Oncorhynchus mykiss)、草鱼(Ctenopharyngodon idella)、罗非鱼(Oreochromis niloticus)等的IL-8基因保守序列(GenBank序列登录号分别为: AAP42829.1、AER38413.1、ACU30057.1),利用Primer Premier 5.0设计引物GeIL-8-F和GeIL-8-R(表1)。
1.4.2 编码区片段的扩增 以1.3中反转录的对照组花斑裸鲤鳃组织的cDNA为模板,分别利用GeIL-8-F和GeIL-8-R作为引物,进行PCR扩增获得花斑裸鲤IL-8编码区片段。PCR反应体系为25 μL,其中,Premix ExTaq 12.5 μL,引物各1 μL(10 μmol/L),cDNA模板1 μL(10 μmol/L),加ddH2O补足25 μL。扩增程序:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。取20 μL PCR产物进行1.2%琼脂糖电泳,并用BIO-RAD凝胶成像系统拍照,切下目的片段,用琼脂糖凝胶DNA回收试剂盒进行纯化回收,回收产物保存于-20 ℃。

表1 引物名称及序列Table 1 Names and sequences of primers
利用pMDTM 19-T Vector Cloning Kit将目的DNA片段与载体pMD19-T进行连接。将上述连接液转入到50 μL DH5α感受态细胞中,最终将培养液涂到含氨苄青霉素(AMP)的LB固体培养基上,利用蓝白斑试验筛选阳性克隆菌。用枪头挑取阳性白色克隆菌落,37 ℃下160 r/min震荡培养12 h,菌液PCR后测序。
1.4.3 3'-UTR和5'-UTR的扩增 用上述所获得的GeIL-8部分编码区片段,用Primer Premier 5.0设计5'RACE引物GeIL-8-5'F和3'RACE引物GeIL-8-5'R(表1)。用3'Full RACE Core Set with Prime ScriptTMRTase试剂盒反转1.3中花斑裸鲤鳃组织总RNA,获得3'-UTR cDNA模板。用SMARTer○RRACE 5'/3' Kit试剂盒反转录1.3中花斑裸鲤鳃组织总RNA获得5'-UTR cDNA模板。分别以GeIL-8-5'F和GeIL-8-5'R为引物进行3'-UTR和5'-UTR的扩增。PCR反应体系为25 μL,其中,Premix ExTaq 12.5 μL,引物 1 μL(10 μmol/L),cDNA模板1 μL(10 μmol/L),UPM 1 μL(10 μmol/L),加ddH2O补足25 μL。扩增程序:95 ℃ 4 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。按照1.4.2所述步骤进行PCR产物电泳并回收5'-UTR和3'-UTR PCR目的基因片段,转化、菌液PCR鉴定后测序。
1.4.4 GeIL-8全长cDNA的获得 将测序获得的编码区片段、3'-UTR和5'-UTR使用DNAMAN软件进行拼接,获得GeIL-8全长cDNA。根据GeIL-8全长cDNA序列,分别在GeIL-8基因的5'和3' UTR设计引物GeIL-8-CF和GeIL-8-CR(表1)进行confirm PCR。按照1.4.2所述步骤进行PCR扩增、电泳并回收扩增目的基因片段,转化、菌液PCR鉴定后测序并比对。
1.5 GeIL-8序列分析及系统进化树的构建
用ExPASY Protparam(Http://web.expasy.org/prot param/)软件在线分析GeIL-8的蛋白性质及结构;运用生物信息学软件Alignment进行不同物种IL-8序列的同源性比对;使用MEGA5软件以邻位相接法(Neighbor Joining,N-J)构建不同物种的IL-8基因序列系统进化树。
1.6 GeIL-8在花斑裸鲤肝、肾、脑和鳃组织中的表达分布
按照GeIL-8基因全长cDNA序列设计Real-time引物(表1)。利用PrimeScriptTMRT reagent Kit(Perfect Real Time)反转1.3提取的花斑裸鲤各组织RNA作为模板,利用Real-time PCR检测正常水平及Cu2+胁迫下GeIL-8在花斑裸鲤肝脏、肾脏、脑和鳃的表达情况。反应体系为20 μL:包括SYBR Green Supermix 10 μL,上下游引物各0.5 μL(10 μmol/L),模板cDNA 1 μL(10 μmol/L),ddH2O 8 μL。反应在实时荧光定量PCR仪(CFX96)上进行(购自美国BIO-RAD公司),扩增条件为95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 30 s,40个循环。被检测组织的样品分别来自3尾鱼,每个样品的IL-8基因和β-actin分别进行3次重复,每尾鱼的每个样品分别检测后取平均值。
1.7 数据统计分析
Real-time PCR所得的数据应用2-△△Ct方法进行相对定量分析,基因的相对表达水平用Excel、SPSS20.0和OriginPro 8.0软件进行统计分析,差异性检验采用单因素方差分析(Analysis of variance, ANOVA),多重比较采用Student-Newman-Keuls。结果均以P<0.05作为显著性判断的标准。
2 结果与分析
2.1 花斑裸鲤GeIL-8全长cDNA的克隆
根据GenBank中已知IL-8基因保守序列,通过PCR扩增获得花斑裸鲤的IL-8的部分编码区片段186 bp(图1-A),然后在此片段序列的基础上,设计5'RACE和3'RACE的引物,分别扩增获得GeIL-8的5'-UTR片段198 bp(图1-B)和3'-UTR片段380 bp(图1-C)。分别在该基因的5'和3' UTR设计引物,通过confirm PCR扩增获得GeIL-8全长cDNA序列582 bp。扩增获得的编码区片段、非编码区序列和confirm PCR扩增获得的全长cDNA序列,经过测序、比对而确认为GeIL-8基因序列。
2.2 GeIL-8序列特征分析
花斑裸鲤GeIL-8的全长cDNA序列共582 bp,由45 bp的5'-UTR、240 bp的3'-UTR和297 bp的编码区构成,编码98个氨基酸。用ExPASY Protparam软件进行在线分析,结果表明GeIL-8分子质量为8.5 kDa,等电点(Isoelectric point,PI)为8.8,该蛋白包含4个保守的半胱氨酸,分别位于第34、36、60和77位氨基酸处,第34和36的半胱氨酸间存在一个精氨酸(Arg,R),由此形成了CXC型趋化因子的特征结构。3' UTR含有3个mRNA不稳定信号(ATTTA)(图2)。
2.3 花斑裸鲤GeIL-8的进化分析
利用Alignment软件进行以下不同物种的IL-8序列的同源性比对。结果表明,花斑裸鲤GeIL-8基因序列与鲫鱼(AGG11027.1)、草鱼(AER38413.1)、虹鳟鱼(AAP42829.1)、罗非鱼(ACU30057.1)、牛(AEO13897.1)、绵羊(AGS44976.1)、家鸽(ABD49206.1)、原鸡(ABD49203.2)、灰雁(ABD49205.1)的同源性分别为:87%、81%、 68%、51%、35%、34%、34%、31%、30%。经分析表明本试验克隆的GeIL-8基因与其他物种的IL-8基因同源性较高,具有很高的保守性。
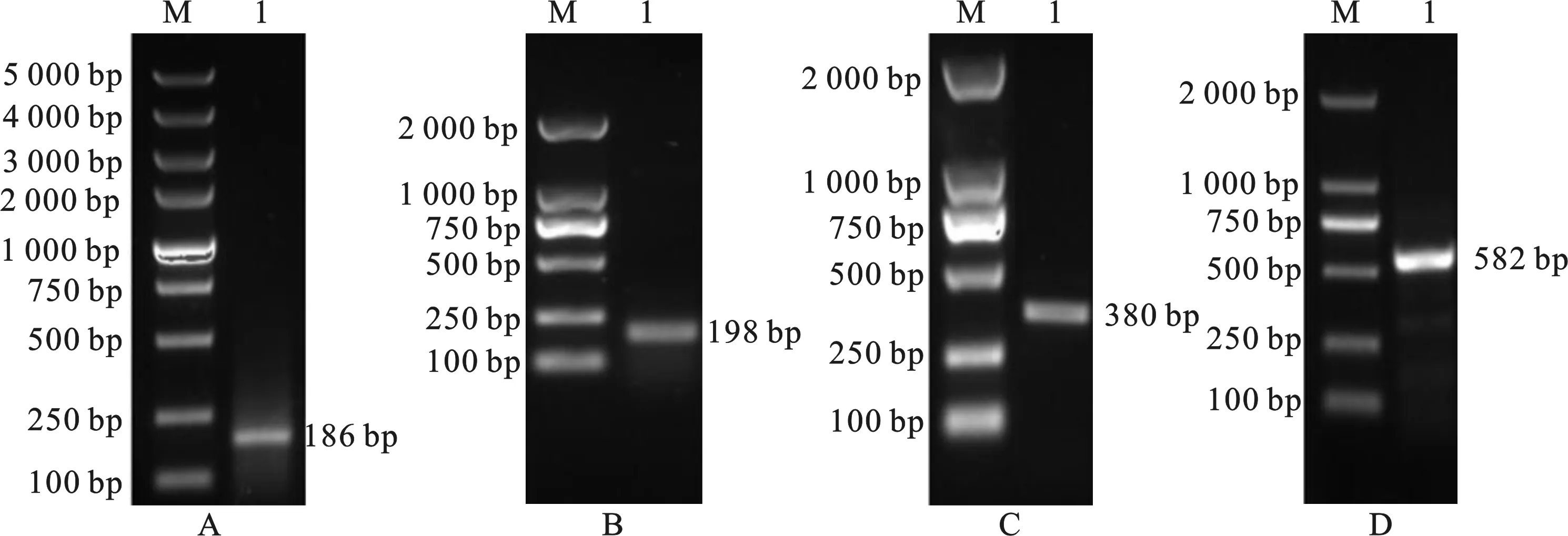
图1 花斑裸鲤GeIL-8克隆结果Fig.1 The cloning result of Gymnocypris eckloni GeIL-8

图2 GeIL-8 cDNA序列及其编码的氨基酸序列Fig.2 The complete cDNA sequences and amino acid sequences of GeIL-8
使用MEGA5软件以邻位相接法(Neighbor Joining,N-J)构建不同物种的IL-8基因序列系统进化树,结果如图3所示。由图3可知,硬骨鱼类独立聚成一支,其中花斑裸鲤与鲫鱼遗传距离最近,随后是草鱼、虹鳟鱼等硬骨鱼类,与灰雁的遗传距离最远。符合物种传统的形态学和生化特征分类进化地位。
2.4 GeIL-8在花斑裸鲤各组织的表达分布特征
通过Real-time PCR检测正常状态下花斑裸鲤GeIL-8在各个组织的表达量。结果(图4)表明,GeIL-8基因在花斑裸鲤肝脏、肾脏、脑和鳃中均有表达,在肝中表达量最高,显著高于其他组织(P<0.05);其次是鳃,显著高于肾和脑(P<0.05);而在肾和脑中表达水平较低。花斑裸鲤在重金属Cu2+胁迫下各组织中的mRNA水平在不同时间段间的表达模式(图5),结果显示:在36 h内花斑裸鲤各组织中GeIL-8 mRNA水平的表达总体表现为先升后降的趋势,在12 h时即达到最大值,表达显著(P<0.05),随后随着胁迫时间的持续表达量逐渐下降。
3 讨 论
本试验克隆得到的花斑裸鲤GeIL-8基因经过氨基酸序列分析发现,包含4个保守的半胱氨酸,第34和36的半胱氨酸间存在一个精氨酸,由此形成了CXC型趋化因子的特征结构[16]。同源性分析表明,花斑裸鲤GeIL-8与其他鱼类的相似性达到80%以上,其中与鲫鱼的相似性最高(87%)。花斑裸鲤GeIL-8系统进化树分析将花斑裸鲤与硬骨鱼类的鲫鱼、草鱼、虹鳟鱼、罗非鱼聚在一个鱼类的分支上,这与条石鲷[17]、斑马鱼[18]和牙鲆[19]的分类结果一致,也与传统分类学分类结果一致。
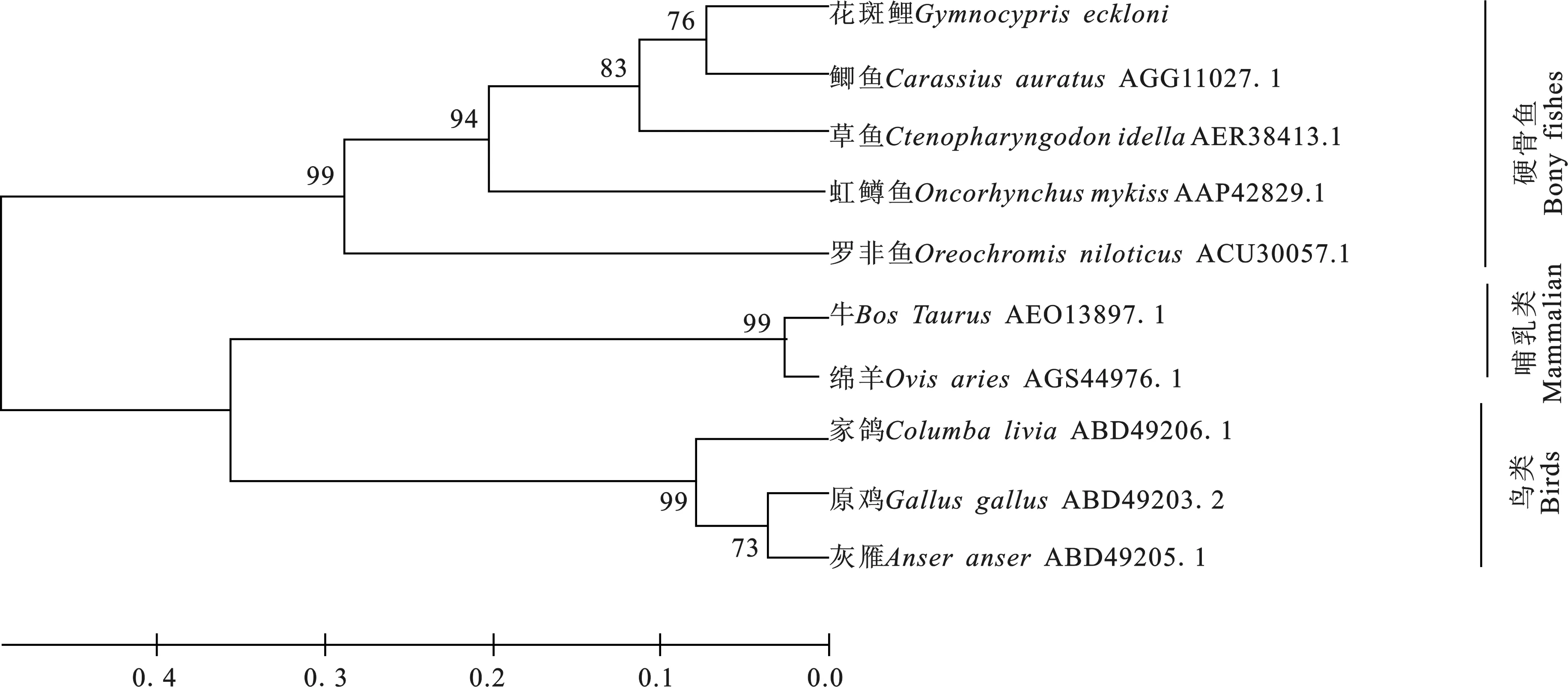
图3 基于IL-8基因的相关物种进化分析Fig. 3 Evolutionary analysis of related species based on IL-8
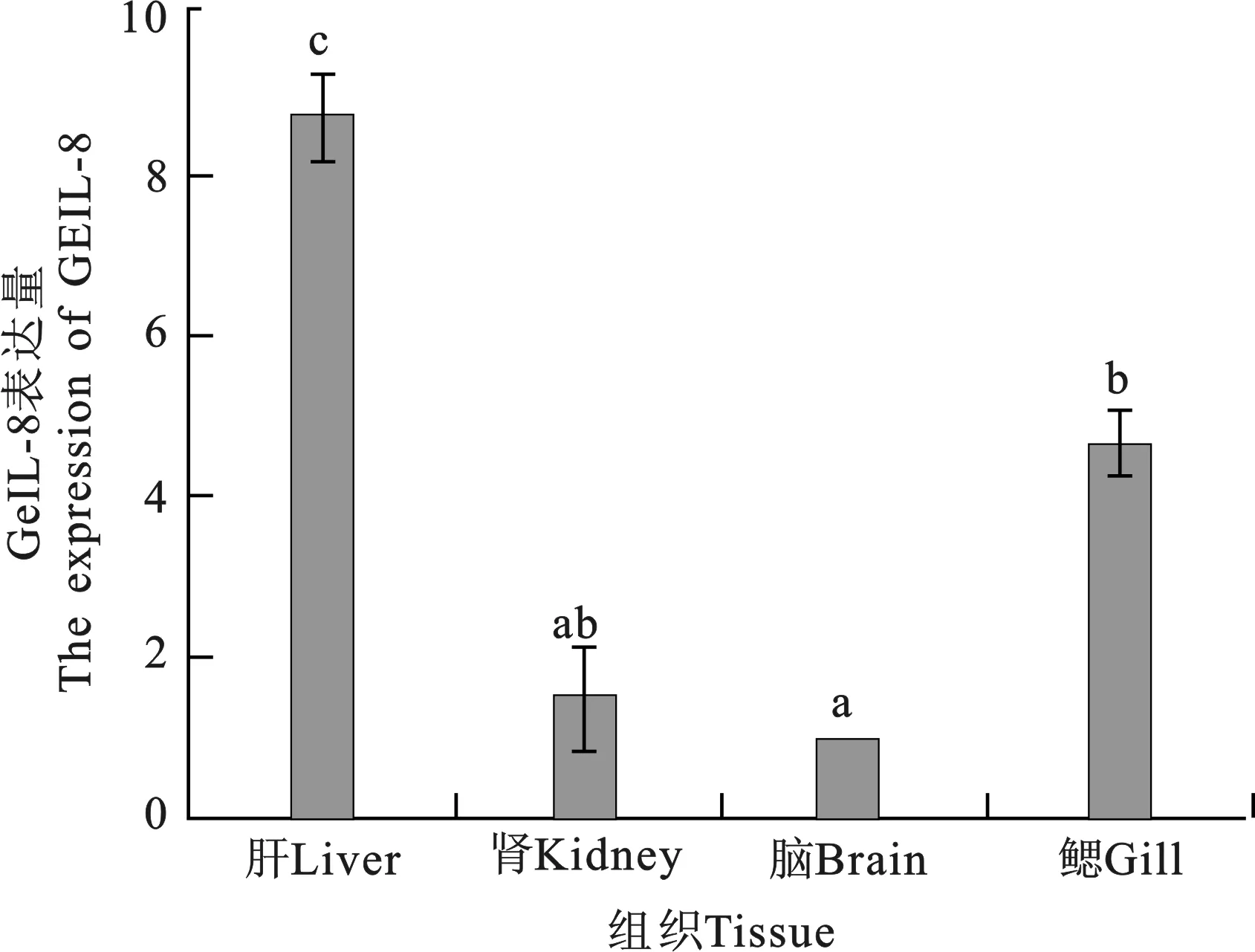
图4 GeIL-8在花斑裸鲤不同组织的mRNA表达分析Fig.4 Analysis of mRNA expression level of GeIL-8 in Gymnocypris eckloni different tissues
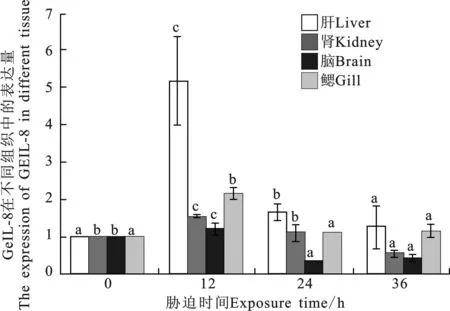
图5 0.01mg/L Cu2+胁迫下GeIL-8在花斑裸鲤不同组织的mRNA水平表达分析Fig.5 Expression of GeIL-8 mRNA in Gymnocypris eckloni
Real-time PCR检测发现,GeIL-8基因在肝脏、肾脏、脑和鳃组织中均有表达,尤其在肝中表达量显著高于其他组织(P<0.05),其次是鳃,在肾脏和脑中表达水平较低。这与草鱼[20]、虹鳟鱼[21]研究的IL-8表达模式相似,进一步表明IL-8在鱼类组织中CXC型的表达特点[22]。
对Cu2+胁迫下不同时间段花斑裸鲤GeIL-8在肝脏、鳃、肾和脑组织中的mRNA表达水平的结果显示:在36 h内花斑裸鲤各组织中GeIL-8 mRNA的表达水平总体表现为先升后降的趋势,在12 h时达到最大值,差异显著(P<0.05),随着胁迫时间的持续,表达量逐渐下降。Kim[23]的研究显示,在重金属胁迫下鱼类肝脏的表达量显著升高,本研究结果与之相似,说明肝脏作为鱼类最主要的代谢器官和最大的消化腺,参与体内的消化、代谢、解毒及免疫等多种功能,而鱼类的鳃作为粘膜淋巴组织之一,在鱼类自身免疫中起重要作用。Kim等[23]研究表明,将虹鳟浸泡免疫后,鳃中会检测到颗粒物质的吸收。对硬骨鱼免疫的研究显示,在鱼类免疫细胞发生时,胸腺中最先检测到T淋巴细胞,T淋巴细胞在胸腺中发育成熟后被运送到肝脏、头、肾等外周免疫器官对抗原刺激产生应答[24]。
Cu2+胁迫最初时期花斑裸鲤体内IL-8表达量的升高,表明鱼体对外界刺激产生炎性反应而诱导细胞产生大量IL-8,趋化外周血中的中性粒细胞到达受刺激部位,而IL-8又激活中性粒细胞表面的CXCR1和CXCR2刺激细胞产生转录因子,促使中性粒细胞增殖,通过这种信号通路的级联放大效应逐步延伸到后续反应,到了12 h,各组织表达量明显升高,进一步证明了IL-8的促炎功能[25];24 h后又有降低趋势,说明经过一系列炎症细胞的免疫应激后,释放治愈性的因子[26],抑制了外界刺激的进一步危害,到达恢复期。
花斑裸鲤在重金属Cu2+胁迫下各个组织中GeIL-8 mRNA的表达水平表现出一定的规律性,表明IL-8参与了炎症反应,具有免疫调节功能。但其应答模式的调控机理还需进一步研究。本研究获得花斑裸鲤GeIL-8 cDNA全长序列、生物信息学特征、正常水平以及Cu2+胁迫下各个组织中GeIL-8的mRNA水平的应答模式,有助于更加深入的理解GeIL-8的应激应答模式,为天然水体环境污染的早期预警、生物标记物的筛选、应激应答模式研究及花斑裸鲤的保护等方面提供一定的理论依据。
参考文献:
[1] 申志兴,王国杰,杨成,等.青海省花斑裸鲤现状及保护对策[J].青海畜牧业,2011(2):17-19.
[2] 韩永. 黄河上游花斑裸鲤Gymnocyprisecklonieckloni年龄、生长和种群遗传特性分析[D].上海:上海海洋大学, 2016.
[3] SANMAMED M F, PEREZGRACIA J L, Schalper K A, et al. Changes in serum interleukin-8 (IL-8) levels reflect and predict response to anti-PD-1 treatment in melanoma and non-small cell lung cancer patients[J]. Annals of Oncology Official Journal of the European Society for Medical Oncology,2017,28(8):1 988-1 995.
[4] ALEJO A, TAFALLA C. Chemokines in teleost fish species[J]. Developmental and Comparative Immunology,2011,35(12):1 215-1 222.
[5] PAPIRIS S A, TOMOS I P, KARAKATSANI A, et al. High levels of IL-6 and IL-8 characterize early-on idiopathic pulmonary fibrosis acute exacerbations[J]. Cytokine,2017,10(2):115-118.
[6] CAI Z H, GAO C P, ZHANG Y, et al. Functional characterization of the ELR motif in piscine ELR+ CXC-like chemokine[J].Marine Biotechnology,2009,11(4):505-512.
[7] SUN J S, ZHAO L, SUN L. Interleukin-8 of Cynoglossus semilaevis is a chemoattractant with immunoregulatory property[J].Fish & Shellfish Immunology, 2011, 30(6):1 362-1 367.
[8] HU Y H, CHEN L, SUN L. CXCL8 of Scophthalmus maximus: expression, biological activity and immunoregulatory effect[J]. Developmental & Comparative Immunology, 2011,35(10):1 032-1 039.
[9] VANDER L M, CHADZINSKA M, GOLBACH L A, et al. Proinflammatory functions of carp CXCL8-like and CXCb chemokines[J].Developmental & Comparative Immunology, 2012,36(4):741-750.
[10] LEE E Y, PARK H H, KIM Y T, et al. Cloning and sequence analysis of the interleukin 8 gene from flounder (Paralichthysolivaceous)[J].Gene,2001,274(1-2):237-243.
[11] NAJKSH A M, MECHETINA L V, ALABYEV B Y, et al. Identification of an IL 8 homologin lamprey (Lampetrafluviatilis):early evolutionary divergence of chemokines[J].European journal of immunology,1999,29:375-382.
[12] LAING K J, ZOU J, WANG T, et al. Identification and analysis of an interleukin 8 like molecule in rainbow trout Oncorhynchus mykiss[J].Developmental & Comparative Immunology, 2002,26(5):433 - 444.
[13] 孙晓义,卢强,谭业平,等.鲤白细胞介素-8基因组DNA的克隆及序列分析[J].大连水产学院学报,2008,23(2):157-160.
[14] 刘迪秋,葛锋,陈朝银,等.重金属铜、镉对鲫肝脏基因表达的影响[J].水产科学,2010,17(6):227-230.
[15] 刘福军,张饮江,王明学.铜对鱼类慢性毒性研究进展[J].水生生物学报,2003,27(3):302-307.
[16] ALEJO A, TAFALLA C. Chemokines in teleost fish species[J]. Developmental and Comparative Immunology,2011,35(12):1 215-1 222.
[17] SAHIBZADA H A, KHURSHID Z, KHAN R S, et al. Salivary IL-8, IL-6 and TNF-α as Potential Diagnostic Biomarkers for Oral Cancer[J]. Diagnostics,2017,7(2):71-72.
[18] NOMIYAMA H, HIESHIMA K, OSADA N, et al. Extensive expansion and diversification of the chemokine gene family in zebrafish:Identification of a novel chemokine subfamily CX[J]. BMC Genomics,2008,9(1):222-223.
[19] OEHLERS S H, FLORES M V, HALL C J,et al. Expression of zebrafish cxcl8 (interleukin-8) and its receptors during development and in response to immune stimulation[J].Developmental & Comparative Immunology,2010,34(3):352-354.
[20] WANG T T, SONG X H, BAO G M, et al. Molecular characterization, expression analysis, and biological effects of interleukin-8 in grass carp Ctenopharyngodon idellus[J].Fish & Shellfish Immunology,2013,35(5):1 421-1 432.
[21] CAI Z H, GAO C P, Z Y,et al. Cloning and bioactivity analysis of a CXC ligand in black seabream Acanthopagrus schlegeli: the evolutionary clues of ELR+CXC chemokines[J]. BMC Immunology,2008,9(1):66-67.
[22] CORRIPIO M Y, BIRD S, TSAMOPOULOS K, et al. Cloning and expression analysis of two pro-inflammatory cytokines, IL-1β and IL-8, in haddock (Melanogrammusaeglefinus)[J]. Molecular Immunology,2007,44(6):1 361-1 373.
[23] KIM C H, JOHNSON M C, DRENNAN J D, et a1. DNA Vaccine sen code viral glycoproteins induce nonspecific immunity and Mxprotein synthesis in fish[J].Journal of Virology,2000,74(15):7 048-7 054.
[24] PRESS C L, EVENSEN O. The morphology of the immune system in teleost fishes[J].Fish & Shellfish Immunology,1999,9(4):309-318.
[25] FEGHALI C A, WRIGHT TM. Cytokines in acute and chronic inflammation[J].Frontiers in Bioscience,1997,1(2):12-26.
[26] DAS A, SAHOO P K, MOHANTY B R, et al. Pathophysiology of experimental Aeromonas hydrophila infection in Puntius sarana: Early changes in blood and aspects of the innate immune-related gene expression in survivors[J]. Veterinary Immunology and Immunopathology,2011,142(3-4):207-218.
