双孢菇多糖的提取及抗氧化活性研究
2018-07-03刘杨赵立蒋长兴陈军白青云毕艳红陈文
刘杨,赵立,蒋长兴,陈军,白青云,毕艳红,陈文
(淮阴工学院生命科学与食品工程学院,江苏淮安223003)
食用菌是已知最早的、人类实践中发现并利用的一类微生物,其医学价值在我国东汉时期已有记录。食用菌素有“植物肉”之称,蛋白质含量丰富,有18种L-氨基酸,氨基酸组成合理。双孢菇(Agaricus bisporus),是一种常见的食用菌,又称白色蘑菇、洋蘑菇、圆蘑菇、银白色菌丝菇,是中低温性真菌,生长速度快,不容易结菌被,实体多单生,形状圆正,呈白色、外周没有鳞片,菌盖较厚,菇体肉质肥厚。在双孢菇的担子上面,一般都会有两个担孢子长在上面,得名双孢菇[1,2]。
真菌多糖是多数食用菌含有的一种非常重要的活性成分,具有广阔的发展前景,近年来受到国内外学者的广泛关注[3-5]。真菌多糖具有很好的抗氧化性,是一款天然存在的大众消费品,方便易得。作为天然绿色防腐剂,在食品中的应用已被大众所接受和认可[6-9]。目前也被应用到化妆品的开发与成分添加中,本文应用真菌多糖来优化双孢菇多糖的提取工艺,并分析了它的抗氧化活性,为双孢菇多糖的充分应用,发挥多糖的医药价值提供参考。
1 材料与设备
1.1 试验材料
新鲜双孢菇选自淮安市城南市场,市售。菌体肉质饱满,没有划痕,颜色白净,无褐色或黑色斑点,菌体上的菌杆未脱落。
1.2 试剂
苯酚、浓硫酸、无水乙醇、氯化铁、三氯乙酸、铁氰化钾、EDTA、VC、Ferrozine(菲洛嗪)等,均为分析纯。BHT(2,6-二叔丁基-4-甲基苯酚)为食品级。
1.3 设备
PHS-3C型pH计,上海仪电科学仪器股份有限公司;HH-4型数显恒温水浴锅,国华电器有限公司;723-UV-5800型紫外可见分光光度计,上海菁华科技仪器有限公司。
2 试验方法
2.1 操作流程及主要步骤

2.1.1 粉碎、浸提、浓缩
将双孢菇切片置于粉碎机中粉碎后,置于匀浆机中加水匀浆,采用热水浸提。过滤,得浸提液。将浸提液在8000r/min条件下离心15min,得到上层清液。将得到的上层清液用旋转蒸发器浓缩,减压浓缩至原体积的1/3~1/2。
2.1.2 醇沉、离心、干燥
将浓缩液加3倍体积乙醇,搅拌,放置一夜,然后8000r/min离心15min,得沉淀物。将沉淀物置于烘箱中,(105±2)℃条件下烘至恒重,捣成粉末备用。
2.2 双孢菇多糖提取优化工艺试验
2.2.1 单因素试验
(1)提取温度对多糖提取率的影响
选择不同温度(50、60、70、80、90℃)作为变量,液料比30:1,提取时间180min,提取1次,研究提取温度对多糖提取率的影响。
(2)提取时间对多糖提取率的影响
选择不同的时间(60、90、120、150、180min) 作为变量,液料比30:1,提取温度70℃,提取 1次,研究提取时间对多糖提取率的影响。
(3)液料比对多糖提取率的影响
选择不同的液料比(10:1、20:1、30:1、40:1、50:1)作为变量,提取时间180min,提取温度70℃,提取 1次,研究液料比对多糖提取率的影响。
2.2.2 多糖提取率的计算

式中,质量的单位均为g。
2.3 多糖抗氧化活性的测定
2.3.1 还原力
在试管中加入一定体积0.1mg/mL的样品,用磷酸盐缓冲溶液(0.2mol/L、pH 6.6)定容到 2.5mL,加质量分数为1%的铁氰化钾溶液5mL,随后将试管放入50℃水浴锅中加热20min,反应后取出试管,随即加入10%的三氯乙酸溶液5mL,将试液充分摇匀后静置5min。取上清液2.5mL,添加2.5mL的蒸馏水和0.5mL1%的氯化铁溶液。将摇匀后得到的试液置于700nm条件下测定吸光度值。同时采用相同体积质量分数为0.1mg/mL的BHT为阳性对照。
2.3.2 对Fe2+离子螯合能力
加入一定体积的浓度为0.1mg/mL样品于试管中,然后依次添加2mol/L的氯化铁溶液0.1mL,5mmol/L的Ferrozine溶液0.2mL,充分摇匀,之后加入蒸馏水定容到5mL,于室温放置20min,在560nm波长下测定吸光度,根据吸光度计算螯合率。该试验中的阳性对照是0.1mg/mL的EDTA。
2.3.3 对DPPH自由基的清除能力
在试管中添加少量的样品,浓度为0.1mg/mL,然后添加6.5×10-5mol/L DPPH 2.5mL,充分摇匀后,用70%的乙醇溶液定容到4mL,再次摇匀,在避光处放置20min,之后将溶液摇匀,避光20min后在500nm测量吸光度,并由此计算自由基的清除率。在该试验中的对照样品是0.1mg/mL的BHT。
2.3.4 对羟基自由基的清除能力
取两个干净的试管,并标号1、2。两个试管中分别加入少量的0.1mg/mL的样品,然后分别再加入9mmol/L的四氯化铁EDTA溶液1mL,在1号试管中再加入9mmol/L的水杨酸乙醇溶液1mL,2号试管不加,然后将浓度为8.8mmol/L过氧化氢溶液1mL加入试管中,并将1、2号试管用蒸馏水定容到5mL。充分将两个试管摇匀后,于500nm下测定吸光度,计算出清除率,判断清除羟基自由基的能力。本次试验用等体积的抗坏血酸作为对照组。
3 结果与分析
3.1 双孢菇多糖提取的优化试验
3.1.1 多糖提取的单因素试验
(1)提取温度对多糖提取率的影响
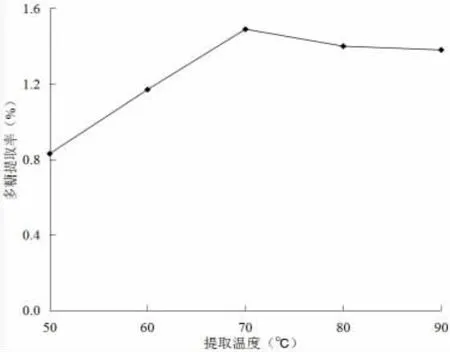
图1 不同提取温度下的多糖提取率Fig.1 Extraction rate of polysaccharide with different temperature
从图1可知,温度在50~70℃之间时,双孢菇多糖的提取率随着温度的升高逐渐增加,但温度超过70℃以后,多糖的提取率呈现略下降趋势。因此,选择70℃为双孢菇多糖提取的最佳温度。
(2)提取时间对多糖提取率的影响
从图2可知,提取时间为60~120min时,双孢菇多糖的提取率随着时间延长存在明显的上升趋势(P<0.05)。当提取时间达到120min以上时,双孢菇多糖提取率上升非常缓慢(P>0.05)。因此,120min为提取双孢菇多糖的最佳温度。

图2 不同提取时间下的多糖提取率Fig.2 Extraction rate of polysaccharide with different time
(3)液料比对多糖提取率的影响
由图3可见,多糖的提取率随着液料比的增加呈现先增加后下降的趋势,在液料比为30:1时的多糖提取率较20:1时显著增加(P<0.05),随着液料比的持续增加,多糖提取率并未有显著上升(P>0.05)。因此,30:1时为提取双孢菇多糖的最佳液料比。

图3 不同液料比下的多糖提取率Fig.3 Extraction rate of polysaccharide with different ratio of liquid to material
3.1.2 双孢菇多糖提取的正交试验
在单因素的基础上,选取对结果影响显著的单因素设计正交试验,试验设计见表1,结果见表2。

表1 双孢菇多糖提取正交试验设计Table 1 Orthogonal test design of polysaccharide extraction fromAgaricus bisporus

表2 双孢菇多糖提取正交试验结果Table 2 Orthogonal test result of polysaccharide from Agaricus bisporus
从表2可以看出,RC>RA>RB,所以各因素对多糖提取率影响由大到小依次为:液料比>提取温度>提取时间。多糖最佳提取方案为A3B2C3,即提取温度为80℃,提取时间为120min,液料比为40:1。经验证最优方案多糖提取率为1.53%,均优于其他试验组。
3.2 多糖抗氧化活性分析
3.2.1 多糖的还原力
物质还原力的大小和抗氧化活性有一定关系,因此,可通过测定还原力的大小来判断物质抗氧化性的高低[10]。由图4可以看出,双孢菇多糖的还原力与BHT的还原能力相当(P>0.05),可见,双孢菇多糖具有很好的还原力,并在一定的范围内与浓度呈正比。

图4 双孢菇多糖的还原力Fig.4 Reducing capacity of polysaccharides from Agaricus bisporus
3.2.2 多糖对Fe2+的螯合能力
生物体内·OH可由H2O2与金属离子反应产生,两者具有相同的作用趋势,推测多糖能够通过螯合金属离子(如Fe2+等)来降低机体产生·OH的速度,两者的存在是呈正比关系,螯合力大的抗氧化剂,抗氧化性也较强[11]。图5表明,双孢菇多糖的螯合能力一直高于EDTA,在溶液浓度为0.4mg/mL之前,差异显著(P<0.05),随着浓度的增加,两者的螯合能力差异变小(P>0.05)。
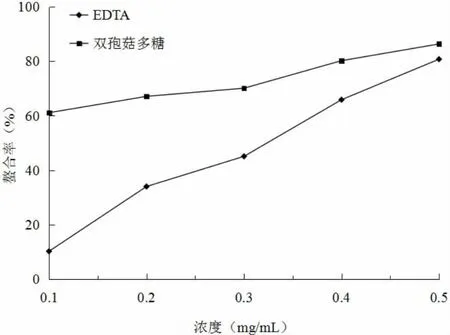
图5 双孢菇多糖对Fe2+的螯合能力Fig.5 The chelation ability of polysaccharides with Fe2+fromAgaricus bisporus
3.2.3 多糖对DPPH自由基的清除能力
由图6可见,双孢菇多糖对DPPH自由基的清除能力稍高于BHT,二者变化趋势大致相近,这表明双孢菇多糖对DPPH自由基的清除能力较强。

图6 双孢菇多糖对DPPH自由基的清除能力Fig.6 Scavenging ability on DPPH free radicals of polysaccharides fromAgaricus bisporus
3.2.4 双孢菇多糖对羟基自由基的清除作用
由图7可见,双孢菇多糖的清除羟基自由基的能力明显要比VC强(P<0.05),随着浓度的增加,清除率趋于平缓,接近最大值80%左右。

图7 双孢菇多糖对羟基自由基的清除作用Fig.7 Scavenging ability on Hydroxyl radical of polysaccharides fromAgaricus bisporus
4 结论
本试验采用新鲜双孢菇作为材料,优化双孢菇多糖的提取工艺参数为:提取温度80℃,提取时间120min,液料比40:1,在此条件下双孢菇多糖的提取率可达1.53%,烘干后双孢菇多糖含量可达10.2%。双孢菇的含水率约在90%左右,提取率与松乳菇多糖的提取[12]、海鲜菇多糖的提取[13]等的结果相近。
双孢菇多糖对金属离子具有较强的螯合能力和还原力,它能够清除羟基自由基和DPPH自由基,是一种纯天然的抗氧化剂,可以应用于多种领域,具有很好的发展潜力,开发前景非常广阔。
参考文献:
[1]熊泽,邵伟,黄艺.双孢磨菇多糖提取工艺优化研究 [J].三峡大学学报:自然科学版,2007,29(4):367-340.
[2]危贵茂,付桂荣,袁诚,等.菌类食品的功能特性及开发前景[J].食品研究与开发,2006,27(2):94-95,98.
[3]韦保耀,余小影,黄丽,等.双孢蘑菇多糖抗菌活性及对食品腐败抑制的研究[J].食品科技,2007,(4):93-95.
[4]李万德,何利华,施金山.对发展双孢蘑菇产业的几点思考[J].湖北生态工程职业技术学院学报,2008,6(2):14-16.
[5]班立桐,吴疆,杨红澎.双孢菇中活性成分与保鲜技术的研究进展[J].食品研究与开发,2010,31(4):185-186.
[6]王鸿磊,王红艳,丁强,等.响应面法优化双孢菇菇柄多糖的提取工艺研究[J].北方园艺,2010,(22):163-166.
[7]乔德亮,陈乃富,张莉,等.双孢蘑菇子实体多糖提取条件优化及部分特性研究 [J].食品与发酵工业,2011,37(2):195-199.
[8]李明元.真菌粗多糖测定方法的研究 [J].食品研究与开发,2007,28(5):118-120.
[9]吴素玲,孙晓明,王波,等.双孢蘑菇子实体营养成分分析[J].中国野生植物资源,2006,25(2):52.
[10]刘科梅,聂挺,潘栋梁,等.量子化学计算研究4种黄酮类天然抗氧化物清除自由基活性的构效关系[J].南昌大学学报(理科版),2016,40(3):250-256.
[11]徐静珠,吴彩娥,应瑞峰,等.青钱柳叶多糖不同组分体外降血糖及抗氧化活性研究[J].南京林业大学学报(自然科学版),2017,41(4):6-12.
[12]应瑞峰,黄梅桂,王耀松,等.超声波微波协同提取青钱柳超微粉多糖及活性研究[J].食品研究与开发,2017,38(23):32-37.
[13]廖国会,龙家寰,秦立新,等.松乳菇多糖提取工艺优化及抗氧化活性评价[J].食品工业科技,2018,39(4):123-130.
[14]李淑荣,王丽,唐选民,等.响应面法优化海鲜菇中多糖提取工艺[J].食品工业科技,2018,39(1):172-176.
