非瓣膜性心房颤动患者中性粒细胞/淋巴细胞比值与CHA2DS2-VASc评分的相关性分析
2018-07-03徐加林田香明毛慧娟
徐加林 田香明 毛慧娟
近些年随着我国人群老龄化趋势的加快,心房颤动的患病率逐年增加,成为危害人类身体健康的最常见的心律失常之一。相关研究显示,心房颤动中缺血性脑卒中的发生风险是普通人群的4~8倍,致残率和致死率均较高[1]。CHA2DS2-VASc评分是在CHA2DS2基础上经过补充完善而来的用以评价心房颤动患者卒中发生风险、预后转归的重要工具,其临床价值已经受到普遍认可[2-3]。近年的研究显示,炎症反应参与了心房颤动的发生、发展,并且与患者预后转归密切相关[4]。中性粒细胞/淋巴细胞比值(英文,NLR)是反映机体炎症反应、氧化应激反应的新型标志物,且是预测心脑血管疾病(冠心病、脑梗死)预后不良的独立危险因子[5]。本研究通过检测非瓣膜性心房颤动患者NLR水平,探讨其与CHA2DS2-VASc评分的相关性,为临床评价此类患者卒中发生风险提供一个更加丰富的评估辅助手段。
1 对象和方法
1.1 研究对象 选择2014年5月至2017年5月我院收治的165例非瓣膜性心房颤动患者为研究对象,其中男110 例,女 55 例,年龄 46~78(61.46±10.61)岁。纳入标准:(1)诊断符合欧洲心脏学会(ESC)在2016年制定的《心房颤动管理指南》相关标准[6];(2)左心房内径(LAD)<50mm,左心室舒张末期内径(LVEDD)<60mm;排除标准:心脏瓣膜病,先天性心脏病,风湿性心脏病,严重心、肝、肾功能障碍,恶性肿瘤,严重感染性疾病,甲状腺疾病,造血系统疾病和自身免疫系统疾病,痛风。按照纳入时NLR的中位数(2.54)分为低NLR组(NLR<2.54,84例)和高NRL组(NLR≥2.54,81例)。
1.2 方法
1.2.1 收集患者一般临床资料、超声心动图检查和实验室检查指标 一般资料包括性别、年龄,心房颤动病程,吸烟史,合并基础病(高血压、糖尿病、高脂血症、冠心病、心肌病)、服用药物如他汀类药物、血管紧张素酶抑制剂/血管紧张素酶抑制剂(ACEI/ARB)、β受体阻滞剂。采用深圳迈瑞6900全自动血细胞分析仪检测血细胞分类相关指标包括Hb、PLT、WBC、中性粒细胞计数(NEU)、淋巴细胞计数(LYM)。采用美国贝克曼5800型自动生化分析仪检测血清(Cr)、BUN、ALT、AST、FPG、TG、TC、LDL-C、HDL-C、CRP。采用美国GE公司VIVID E9型彩色多普勒超声诊断仪检测左心室射血分数(LVEF)、LVEDD、左心房内径(LAD)、室间隔厚度(IVST)、左心室后壁厚度(LVPWT)。
1.2.2 测量CHA2DS2-VASc评分[2-3]该评分范围0~9分,评分0为低危险人群,评分1分为中危险人群,评分≥2分为高危险人群,比较低NLR组和高NLR组之间各个危险分级的比例。
1.3 统计学处理 应用SPSS19.0统计软件,正态分布的计量资料以 表示,组间比较采用两独立样本的成组t检验。计数资料以百分比表示,两组比较采用χ2检验;等级资料采用秩和检验(Wilcoxon检验法)、相关性分析采用Spearman秩相关分析;CHA2DS2-VASc高评分(≥2分)采用预测因素分析采用多元logistic回归,并采用ROC曲线评价NLR预测CHA2DS2-VASc高评分(≥2分)的效能,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料和实验室检查指标的比较经检测,NRL的中位数为2.54。由此,低NLR组(NLR<2.54)84例,高NRL组(NLR≥2.54)81例。见表1。
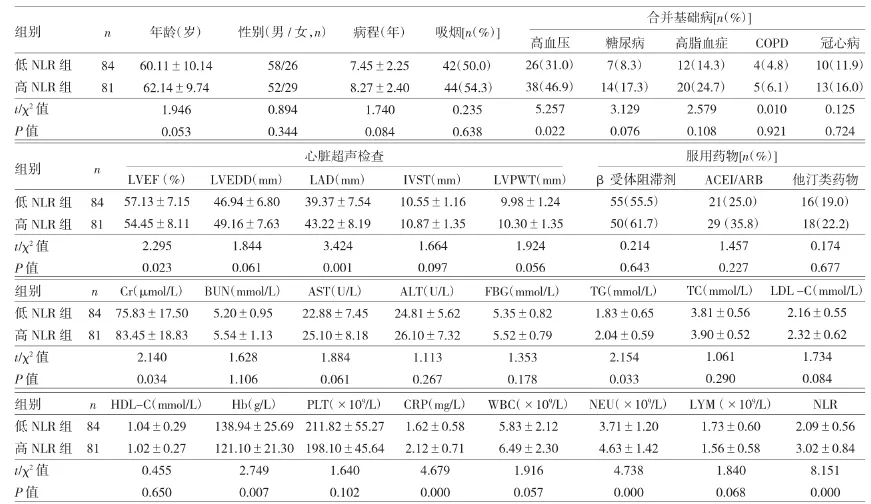
表1 两组患者一般临床资料和实验室检查指标的比较
由表1可见,高NLR组合并高血压比例、LAD、Cr、TG、CRP、NEU、NRL均高于低 NLR 组,而 LVEF、Hb低于低NLR组,两组比较差异均有统计学意义(均P<0.05)。
2.2 两组患者一般CHA2DS2-VASc评分分级和分值的比较见表2。
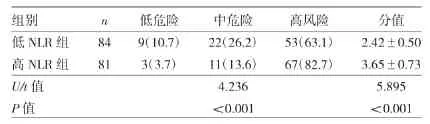
表2 两组患者一般CHA2DS2-VASc评分分级和分值的比较
由表2可见,在两组合计165例患者中,低危险患者12例(7.3%)、中危险患者33例(20.0%)、高危险患者120例(72.7%)。高NLR组CHA2DS2-VASc评分分级及分值与低NLR组比较,差异均有统计学意义(均P<0.01)。
2.3 NLR与心脏超声检查指标、炎性指标、CHA2DS2-VASc评分的相关性分析见表3。
由表3可见,Spearman秩相关分析显示,NLR与CHA2DS2-VASc评分、LAD、CRP均呈正相关,与LVEF呈负相关(均P<0.05)。
2.4 非瓣膜性心房颤动患者CHA2DS2-VASc高评分(≥2分)的预测因素分析见表4。
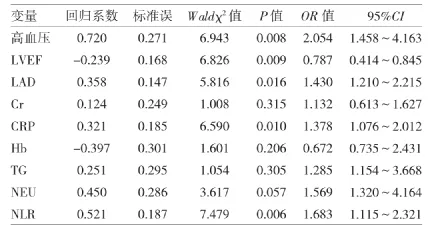
表4 非瓣膜性心房颤动患者CHA2DS2-VASc高评分(≥2分)的分析
由表4可见,以CHA2DS2-VASc评分为因变量(赋值方法:0=<2分,1=≥2分),以表1中差异具有统计学意义的指标为自变量,进行多元logistic回归分析,显示NLR是CHA2DS2-VASc高评分的独立预测因素(OR=1.683,95%CI∶1.115~2.321,P<0.05)。其余指标如合并高血压、CRP亦是独立预测因素。
2.5 NLR预测非瓣膜性心房颤动患者CHA2DS2-VASc高评分(≥2分)的效能分析见图1。
由图1可见,NLR预测CHA2DS2-VASc高评分的ROC曲线 AUC为 0.796,灵敏度 0.825,特异度0.734,最佳诊断截点值(Cut-off)为 2.68。
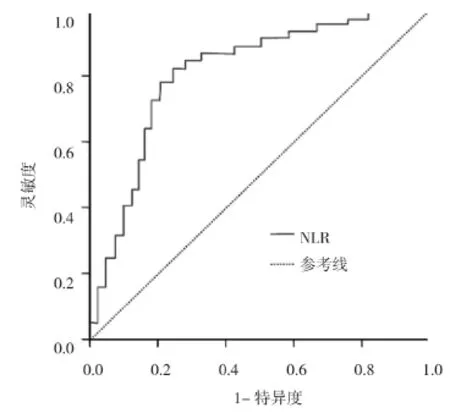
图1 NLR预测非瓣膜性心房颤动患者CHA2DS2-VASc高评分(≥2分)的ROC分析
3 讨论
心房颤动在我国30~85岁居民中患病率为0.77%,且随着年龄的增加其患病率逐渐增高[7]。且随着年龄的增加其患病率逐渐增高。Framingham研究结果发现,在瓣膜性心房颤动中,脑卒中发生风险是普通人群的16倍,而在非瓣膜性心房颤动中,脑卒中发生率是普通人群的的4~8倍[8]。目前,评价心房颤动患者发生血栓栓塞事件的手段有多种,包括生化指标、心脏超声、影像学检查等[9],但临床指南仍然推荐采用CHA2DS2-VASc评分对心房颤动患者进行血栓栓塞事件的危险分层、预后转归评价,从而为临床抗凝治疗提供必要的决策处理[10]。
近些年的相关研究表明,白细胞及其分类和计数与各类心血管疾病(冠心病、心力衰竭、高血压)的预后密切相关[11-12]。中性粒细胞和淋巴细胞是白细胞重要的2种亚型,前者与机体非特异性炎症反应状态有关,后者则与机体免疫反应,氧化应激有关。NLR则被认为是一种新型的反映机体炎症反应和氧化应激的指标[5,13],包含了中性粒细胞和淋巴细胞2种白细胞亚型的信息,反映了两者之间的平衡状态,能够较单一指标更好的反映机体炎性状态。该指标已经成为心血管系统疾病研究的一个热点问题。Yan等[13]报道显示,NLR与心力衰竭患者心功能状态、心室结构的恶化密切相关,是患者发生心血管不良事件的独立危险因素(HR=1.425,P=0.006);Ay a等[14]报道,在急性心肌梗死患者中机体高NLR水平预示着血栓事件(如支架内血栓)和死亡的风险率高,应当引起临床的关注。作为整合了中性粒细胞和淋巴细胞信息的NLR是否与心房颤动的发病机制以及反映卒中风险的CHA2DS2-VASc评分具有特殊的关联性目前还鲜有报道。
本研究结果显示,非瓣膜性心房颤动患者NRL与CHA2DS2-VASc评分呈正相关,且是其高评分的独立预测因素,且具有较高的预测价值。两者相关的机制推测如下:(1)相关研究显示,炎症反应参与了房室重构,表现为左心房扩大和(或)左心室肥厚,引起双重构(电重构和结构功能重构),为心房颤动以及血栓事件的发生提供了病理生理基础[15]。而新近的临床研究显示,心房颤动患者外周血白细胞计数和分类存在显著异常,表现为中性粒细胞计数升高,淋巴细胞计数降低。白细胞介导的炎症反应引起房室功能和结构异常在心房颤动的发生、发展中发挥了重要作用[16-17]。由此推测高水平NLR增加了心房颤动以及血栓事件的发生风险。(2)有研究显示,炎性反应能够诱发机体凝血-纤溶系统激活,引发高凝状态及血液流变学异常,因此,炎症标志物含量增高则常常预示着心房颤动的脑卒中事件发生风险较高[18-19]。因此,NLR作为一种新型的炎性反应标志物可能参与了其病理过程。(3)氧化应激中释放的大量氧自由基参与了心房颤动的心房结构重构,引起LAD增大,还能够损伤血管内皮细胞,引发黏附分子和炎性细胞因子释放,增加血栓事件发生风险[20-21]。NLR作为一种反映机体氧化应激状态的指标,亦可能间接参与了其病理机制。
综上所述,NLR与非瓣膜性心房颤动患者CHA2DS2-VASc评分呈正相关,且是预测高CHA2DS2-VASc评分的独立因素,高水平NLR发生缺血性脑卒中风险较高,应当引起临床的关注。但本研究是一种横断面研究,未能进一步随访,仅是通过探讨NLR与CHA2DS2-VASc评分的相关性及其预测价值,间接反映高水平NLR能预示卒中发生的高风险。尽管如此,由于获得NLR简单方便,费用低廉,因此,NLR有望今后作为一种评价心房颤动发生缺血性脑卒中的预测指标。
[1]Huisman MV,Rothman KJ,Paquette M,et al.Antithrombotic treatment patterns in patients with newly diagnosed nonvalvular atrial fibrillation:the GLORIA-AF Registry,Phase II[J].Am J Med,2015,128(12):1306-1313.doi:10.1016/j.amjmed.2015.07.013.
[2]Xiong Q,Chen S,Senoo K,etal.The CHADS2 and CHA2DS2-VASc scores for predicting ischemic stroke among East Asian patients with atrial fibrillation:A systemic review and meta-analysis[J].Int J Cardiol.2015,195(16):237-42.doi:10.1016/j.ijcard.2015.05.115.
[3]王紫晨,李耘,魏占云,等.CHA2DS2-VASc评分与非瓣膜性心房颤动并缺血性脑卒中患者预后的关系[J].心血管康复医学杂志,2016,25(2):136-141.doi:10.3969/j.issn.1008-0074.2016.02.07.
[4]Hu YF,Chen YJ,Lin YJ,et al.Inflammation and the pathogenesis of atrial fibrillation [J].NatRev Cardiol,2015,12(4):230-243.doi:10.1038/nrcardio.2015.2.
[5]Afari ME,Bhat T.Neutrophil to lymphocyte ratio (NLR) and cardiovascular diseases:an update[J].Expert Rev Cardiovasc Ther,2016,14(5):573-577.doi:10.1586/14779072.2016.1154788.
[6]Kirchh of P,Benussi S,Kotecha D,et al.2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS[J]. Kardiol Pol, 2016,74 (12):1359-1469. doi: 10.5603/KP.2016.0172.
[7]中华医学会心血管病学分会,心律失常联盟.心房颤动抗凝治疗中国专家共识[J].中华内科杂志,2012,51(11):916-921.doi:10.3760/cma.j.issn.0578-1426.2012.11.026.
[8]Schnabel R B,Yin X,Gona P,et al.50 year trends in atrial fibrillation prevalence,incidence,risk factors,and mortality in the Framingham Heart Study:a cohort study[J].Lancet,2015,386(9989):154-162.doi:10.1016/S0140-6736(14):61774-8.
[9]Ahlehoff O,Gislason G,Lamberts M,et al.Risk ofthromboembolism and fatal stroke in patients with psoriasis and nonvalvular atrial fibrillation:a Danish nationwide cohort study[J].J Intern Med,2015,277(4):447-455.doi:10.1111/joim.12272.
[10]Philippart R,Brunet-bernard A,Clementy N,et al.Prognostic value of CHA2DS2-VASc score in patients with'non-valvular atrial fibrillation' and valvular heart disease:the Loire Valley Atrial Fibrillation Project[J]. Eur Heart J, 2015, 36 (28):1822-1830.doi:10.1093/eurheartj/ehv163.
[11]Kounis NG,Soufras GD,Tsigkas G,et al.White blood cell counts,leukocyte ratios,and eosinophils as inflammatory markers in patients with coronary artery disease[J].Clin Appl Thromb Hemost,2015,21(2):139-143.doi:10.1177/1076029614531449.
[12]郗璐,郝永臣,刘静,等.全血白细胞计数水平与高血压风险的关系[J].中华心血管病杂志,2015,43(4):100-100.doi:10.3760/cma.j.issn.0253-3758.2015.04.007.
[13]Yan W,Liu C,Li R,et al.Usefulness of the neutrophil-tolymphocyte ratio in predicting adverse events in elderly patients with chronic heart failure [J].Int Heart J,2016,57(5):615-621.doi:10.1536/ihj.16-049.
[14]AyaB,AknF,CelikO,etal.Neutrophilto Lymphocyte Ratiois Related to Stent Thrombosis and High Mortality in Patients With Acute Myocardial Infarction [J].Angiology,2015,66(6):545-552.doi:10.1177/0003319714542997.
[15]Nigam A,Talajic M,Roy D,et al.Fish oil for the reduction of atrial fibrillation recurrence,inflammation,and oxidative stress[J].JAmColl Cardiol,2014,64(14):1441-1448.doi:10.1016/j.jacc.2014.07.956.
[16]Misialek JR,Bekwelem W,Chen LY,et al.Association of white blood cell count and differential with the incidence of atrial fibrillation:the atherosclerosis risk in communities(ARIC)study[J].Plos One,2015,10(8):484-493.doi:10.1371/journal.pone.0136219.e Collection 2015.
[17]Sonmez O,Ertem FU,Vatankulu MA,et al.Novel fibro-inflammation markers in assessing left atrial remodeling in non-valvular atrial fibrillation[J].Med Sci Monit,2014,20(15):463-470.doi:10.12659/MSM.890635.
[18]Mitrofanova LB,Orshanskaya V,Ho SY,et al.Histological evidence of inflammatory reaction associated with fibrosis in the atrial and ventricular walls in a case-control study of patients with history of atrial fibrillation [J].Europace,2016,18 (suppl4):156-162.doi:10.1093/europace/euw361.
[19]Harada M,Wagoner DRV,Nattel S.Role of inflammation in atrial fibrillation pathophysiology and management[J].Circ J,2015,79(3):495-502.doi:10.1253/circj.CJ-15-0138.
[20]易茜,蹇朝,李勇,等.氧化应激标志物在房颤患者心房结构重构中的变化及意义[J].第三军医大学学报,2015,37(1):55-59.doi:10.16016/j.1000-5404.201407101.
[21]YangKC, JrDS.Oxidative stress and atrial fibrillation: finding amissing piece to the puzzle[J]. Circulation, 2013, 128(16):1724-1726.doi:10.1161/CIRCULATIONAHA.113. 005837.
