硬化性肺细胞瘤的CT表现特征分析
2018-07-03贺伟周新华李芳吕岩周震李成海陈步东
贺伟 周新华 李芳 吕岩 周震 李成海 陈步东
硬化性肺细胞瘤(pulmonary sclerosing pneumocytoma, PSP)是肺内少见的良性肿瘤,是一种肺泡来源的肿瘤,由类似于Ⅱ型肺泡细胞的立方形表面细胞和基质圆形细胞的双分子层表面细胞组成。1980年WHO 将其命名为肺硬化性血管瘤,2015年WHO适时将其归类为“腺瘤”,重新命名为硬化性肺细胞瘤[1]。手术切除为确诊和治疗PSP的主要方法,术前准确诊断可避免扩大手术范围和淋巴结清扫[2]。发现及诊断本病主要依靠影像学检查,但术前影像误诊率较高[2-4], 可误诊为结核球、错构瘤、肺癌及曲霉菌病等。本研究收集 2012—2017年经手术病理证实的33例PSP患者的CT资料,结合病理回顾性分析其影像学征象,提高对该病的CT表现特点的认识,为提高早期正确诊断率,提高与结核球等病变的鉴别诊断能力,指导正确的治疗方案提供帮助。
资料和方法
一、研究对象
收集2012—2017年在首都医科大学附属北京胸科医院经手术病理证实的33例PSP患者, 女30例(90.9%),男3例(9.1%)。中位年龄54岁,年龄范围24~84岁,其中40~60岁女性占大多数,有24例(72.7%)。20例(60.6%)患者无明显症状;2例有肩背部疼痛或胸痛,2例胸闷气短,4例有痰中带血或咯血,5例有咳嗽、咳痰。
术前CT诊断:4例(12.1%)诊断为恶性病变;29例(87.9%)诊断为良性病变,其中有7例考虑有硬化性肺细胞瘤的可能,5例诊断为错构瘤,3例诊断为巨淋巴结增生症,2例诊断为结核球可能性大,12例未能确定为何种良性病变,其中尚有8例考虑不除外恶性病变。
二、检查方法
使用美国GE LightSpeed 64排VCT仪及64排Optima CT680仪,患者吸气状态下常规从肺尖至横膈水平进行扫描,层厚5 mm,层间距5 mm;螺距1.375∶1,重建视野33 cm,管电压120 kV,自动管电流(LightSpeed 64层VCT仪80~350 mA或Optima CT680仪100~300 mA),噪声指数 11.57。所有患者均行CT平扫并重建为层厚1.25 mm的薄层肺窗图像,采用肺重建算法。其中29例患者行CT增强扫描,使用非离子型对比剂(碘海醇或碘普胺,350 mg I/ml)100 ml, 用高压注射器以2.5/s~3.0 ml/s的流率静脉推注后30 s及60 s行动脉期、延时双期扫描。所有图像均在图像存储与传输系统 (PACS)上观察。
三、CT扫描评价内容
由2位工作10年以上的放射科医师一起读片,逐一记录患者CT扫描所见的病变数目、大小、发病部位、边缘及形态,以及CT平扫的密度、增强扫描的强化方式和最大强化净值及伴随征象,有分歧意见经讨论达成共识,以诊断意见一致的结果为标准来判定每例患者的CT表现。患者表现为多发病灶者以最大病灶作为记录;密度均匀与不均匀的判断,以不包括钙化以外的部分判断;最大强化净值定义为增强扫描的CT值与平扫CT值的差值;伴随征象定义如下:“血管贴边征”为增强扫描时病灶周围呈现明显强化的曲线样血管影或断面血管影;“空气新月征”定义为病灶周围新月形或半月形的无肺纹理区域;“晕征”定义为病灶周围环形或半环形的磨玻璃样密度区域;“尾征”定义为病灶边缘尾状突起,多位于病灶靠近肺门一侧。
四、统计学处理

结 果
一、CT平扫表现
1.病灶数目、大小:30例(90.9%)患者为单发病灶(图1~4), 3例(9.1%)为多发病灶(图5~8)。所有病灶平均大小(最大长径)约(2.73±1.32) cm,范围在0.8~6.5 cm。病灶≤3 cm者有20例(60.6%),>3 cm者有13例(39.4%)。
2.边缘和形态:30例(90.9%)患者病灶表现为类圆形(图1~4),3例(9.1%)患者病灶表现为不规则形(图5)。病灶边缘光整者有27例(81.8%),边缘欠规则者有2例(6.1%),病灶可见分叶者有4例(12.1%)。
3.发病部位:按照六分叶,病灶位于右上叶、右中叶、右下叶、左上叶、左上叶舌段、左肺下叶、跨叶者分别有5例(15.2%)、3例(9.1%)、6例(18.2%)、2例(6.1%)、5例(15.2%)、10例(30.3%)、2例(6.1%)。病灶位于双肺下叶者最多,共计有16例(48.5%);病灶位于近肺门的中心型有11例(33.3%),周围型有22例(66.7%)(外周胸膜下4例、叶间胸膜附近6例、纵隔胸膜旁7例、肺野中部5例)。
4.平扫密度:平扫密度为(33.72±14.87) HU,范围在10~62 HU。密度均匀16例(48.5%),不均匀17例(51.5%)。内部见钙化10例(30.3%)(图8),囊变5例(15.2%)(图8)。
5.纵隔及肺门淋巴结肿大:29例(87.9%)患者未见淋巴结肿大;4例(12.1%)患者见淋巴结肿大。
二、CT增强扫描表现
29例患者中,以不均匀强化多见,有19例(65.5%)(图3,7),均匀强化者有10例(34.5%);动脉期、延时扫描平均CT值分别为(60.4±14.5) HU、(80.9±28.6) HU,最高CT值可达151 HU。病灶明显强化者(最大强化净值超过20 HU)有26例(89.7%),平均最大强化净值为(48.9±26.5) HU。典型病例见图1~4。
与平扫相比,增强扫描动脉期最大强化净值>30 HU者有15例(45.5%),<30 HU者有14例(42.4%)。延时扫描26例(78.8%)见持续性强化,且病灶趋于更加均匀(图4);与平扫相比,延时期最大强化净值>40 HU者有15例(45.5%)[其中超过60 HU者8例(24.2%)],<40 HU者14例(42.4%),仅3例(9.1%)患者延时扫描未见继续强化。
将病灶长径以2 cm、2.5 cm及3 cm为界限,分别比较三组(≤2 cm组与>2 cm组,≤2.5 cm组与>2.5 cm组,≤3 cm组与>3 cm组)病灶平扫密度、CT增强扫描的强化方式、动脉期及延时扫描的最大强化净值、延时扫描强化的发生率,结果显示,≤2 cm组及>2 cm组动脉期最大强化净值比较,差异有统计学意义(表1)。
三、CT扫描发现的伴随征象
33例平扫患者,PSP尚见一些伴随征象:见尾征者5例(15.2%)(图9);见晕征者8例(24.2%);见空气新月征者5例(15.2%);其中4例(12.1%)为空气新月征和晕征同时存在(图10)。而29例行CT增强扫描的患者中,伴随血管贴边征21例(72.4%)(图11);假包膜征1例(3.0%)。
四、CT表现与病理改变对照分析
所有患者的病理结果均符合特征性的2种细胞(圆形细胞与表面细胞)和4种组织结构(乳头状结构、出血区、实性区、硬化性结构),30例患者病理改变以2种以上病理组织结构为主,仅3例患者见4种组织结构,所有患者淋巴结均未见受累。其中1例患者同时并发肺内不典型增生。免疫组织化学检查显示,圆形细胞表达甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、上皮膜抗原 (epithelial membrane antigen,EMA)、波形蛋白(vimen-tin),基本不表达肌酸激酶(creatine kinase,CK);表面细胞表达TTF-1、EMA、vimentin和CK。
选取10例患者(动脉期最大强化净值≥30 HU及<30 HU者各5例)与病理改变行对照分析,动脉期最大强化净值≥30 HU者主要以出血区(图12)及乳头状区结构为主;<30 HU者病灶较大,病理结构多样,硬化区及实性区成分较多。
讨 论
一、硬化性肺细胞瘤的临床及CT表现特点
本研究显示,PSP好发于中老年女性,且年龄在40~60岁;约60.6%的患者无临床症状。这些临床特点与文献[2-3,5]报道相似,尽管性别、年龄及患者临床症状的出现率等数据不完全一致,但总趋势一致。本组中9例患者见咯血、咳嗽等呼吸道症状,需要与结核病等其他疾病进行鉴别。PSP病理冰冻切片诊断准确率低,易误诊为腺癌和类癌。因此,肺结节性病变冰冻切片检查时,应该尽量地进行多部位取材,尤其在肿瘤与肺组织交界处,能看到更多的肿瘤结构,可以减少误诊。借助免疫组织化学检查,常可确诊[6]。尽管被认为是良性肿瘤,但已有少量文献报道PSP伴胸膜[7]、胃播散[8]和淋巴结转移[9-10]。PSP可同时伴发其他恶性肿瘤[11],本研究中有1例伴有非典型腺瘤样增生。
二、硬化性肺细胞瘤的CT表现特点分析
PSP大多数为单发、境界清楚、光整的软组织密度结节;66.7%的患者为周围型,其中邻近胸膜周围者为51.5%;发病部位最多见于双肺下叶(48.5%),其次为左肺上叶舌叶及右肺上叶(15.2%),与文献 [2,11,12]等研究相似。
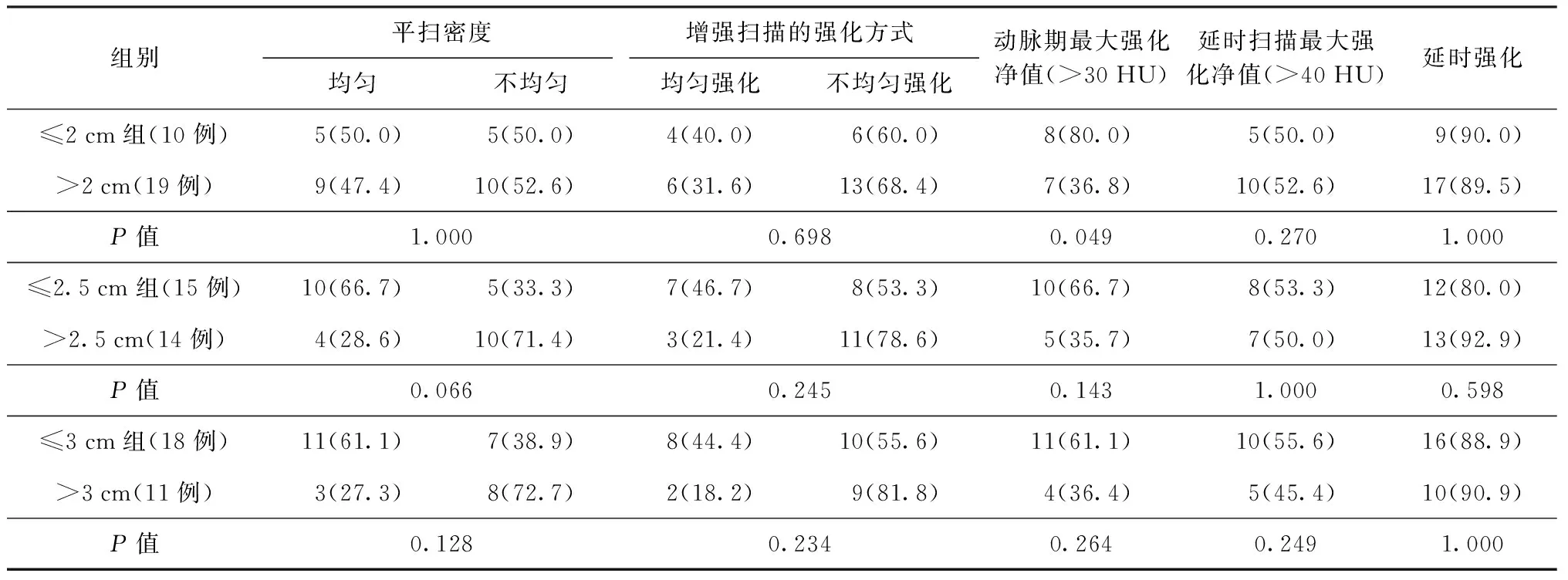
表1 不同病灶长径组的CT扫描结果分析 [例数(构成比,%)]
注统计学检验采用Fisher精确概率法
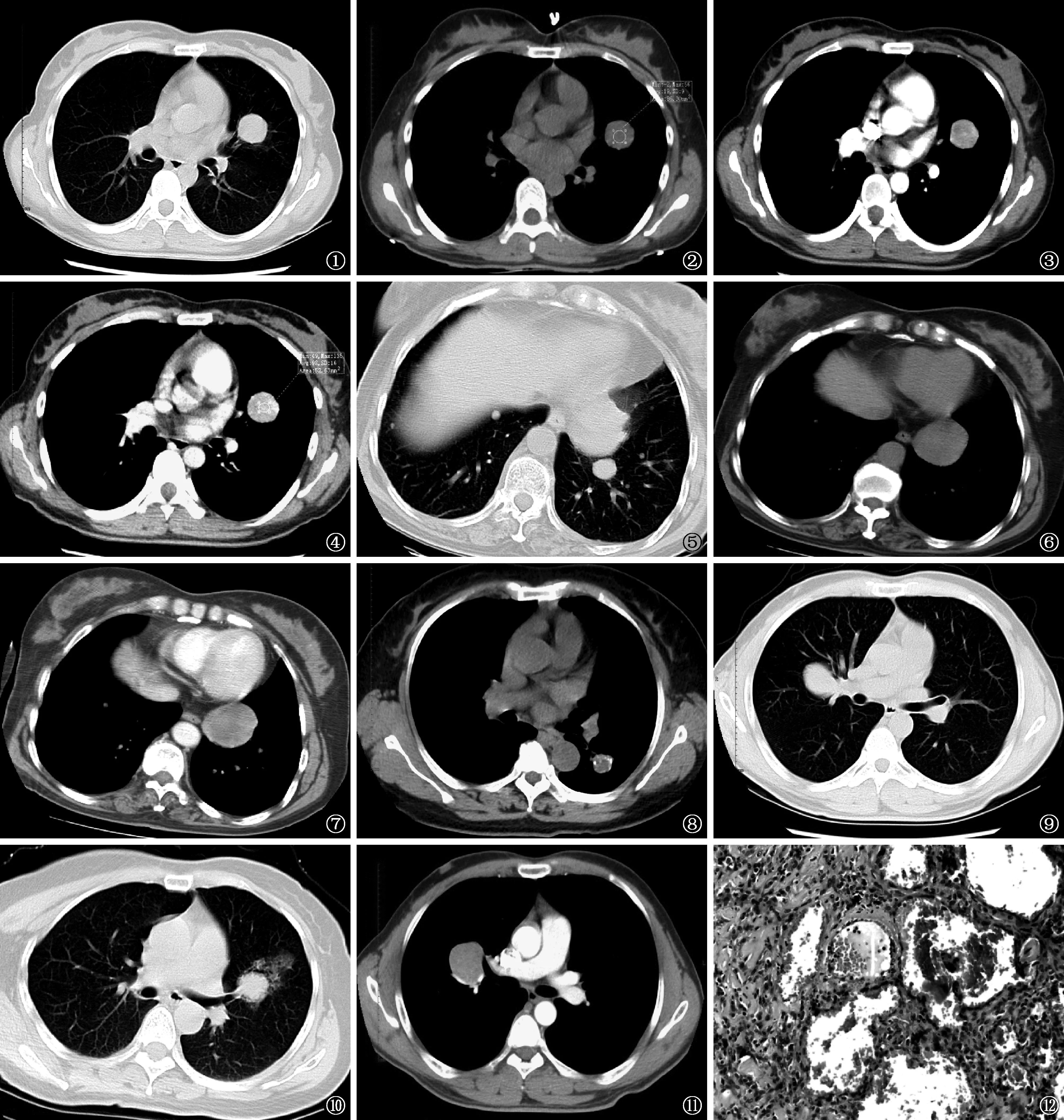
图1~4 患者,女,53岁。图1为肺窗,显示左肺上叶舌段长径3 cm的类圆形结节,境界清楚,光滑;图2为纵隔窗,显示结节平扫密度较均匀,CT值为19 HU;图3为增强扫描,显示动脉期病灶明显强化,密度不均匀,平均CT值为82 HU,动脉期最大强化净值为63 HU;图4为延时扫描,显示病灶呈持续性强化,CT值为93 HU,且病灶密度更加均匀,静脉期最大强化净值为74 HU 图5~7 患者,女,52岁。图5为肺窗,显示左肺下叶基底段心缘旁肿块,大小约5 cm×4 cm,边缘局部不规则,双肺尚见多发的、境界清楚较光滑的结节影。图6为平扫纵隔窗,显示左下肺肿块影密度不均匀,平扫CT值约34 HU。图7为增强扫描动脉期,显示左下肺肿块不均匀强化,CT值平均约60 HU,最大强化净值为26 HU(<30 HU) 图8 患者,女,38岁。左肺下叶背段结节,境界清楚、欠光滑,内见钙化及囊变 图9 患者,男,29岁。肺窗,显示右肺上叶肿块影,靠近肺门侧见“尾征” 图10 患者,女,47岁。肺窗,显示左上肺舌段支气管远端见一长径约2.6 cm的结节影,境界清楚,边缘欠光滑,病灶外上方见空气新月征,病灶下方及远侧见磨玻璃样密度影 图11 患者,男,29岁。右肺上叶近肺门部见4 cm×3 cm的肿块影,境界清楚,光滑,增强扫描见“血管贴边征” 图12 图1~4患者的病理切片图(HE ×40),显示其病理出血区结构,见肿瘤组织出血,大量红细胞堆积在残存肺泡腔内,形成血管瘤样结构
通过本组患者观察CT扫描所见病灶的密度及强化特点为:平扫密度不均匀略多于密度均匀者,增强扫描不均匀强化者较均匀强化者常见;显著强化为增强扫描的特点,与文献[13-14]报道的结果一致。本组患者CT扫描显示,明显强化患者可达89.7%,延时扫描60 s最大强化净值可大于40 HU甚至超过60 HU,大多数病灶延时扫描呈持续性强化,最高CT值可达151 HU,呈血管样强化,故延迟强化也是PSP的增强扫描的特点[15]。
有研究显示,病理组织结构成分的差异可能是病灶CT增强扫描特点差异的原因,PSP的主要结构—出血区(海绵状血管瘤样)和乳头状区可能是动脉期强化明显的组织病理学基础,而实性区及硬化区是可能延时强化和不均匀强化的病理学基础[14-15]。研究认为长径<3 cm的病灶多以血管瘤样及乳头样结构为主,动脉期呈较均匀强化,静脉期少量实性区及硬化区进一步强化可呈渐进性强化。而随着病灶的增大,实性区及硬化区增多且分布不均,使病灶呈不均匀花斑样强化;静脉期时,实性区及硬化区亦逐渐强化,整体强化趋向均匀,呈渐进性强化。表1可以看出,随着病灶的增大,平扫密度不均匀及增强扫描不均匀强化的发生率越高;无论病灶大小,大多数患者均呈现延时强化,与文献[14-15]的研究结果相似。但分别比较三组不同大小的患者的强化方式,延时扫描的最大强化净值、延时强化的发生率,差异均未见统计学意义;不过病灶长径≤2 cm组动脉期强化净值大于30 HU者发生率明显多于>2 cm组,差异有统计学意义(P<0.05),说明以病灶长径2 cm为界可能是动脉期明显强化的一个界限值,有待于今后扩大样本并与病理一一对照分析做进一步研究。
血管贴边征、尾征、晕征、空气新月征均是PSP的特异性征象[12-13, 15-16],但发生率各文献报道有一定差异。本研究显示,血管贴边征是最常见的伴随征象,达72.4%,为PSP良性生长、推挤、压迫周围血管所致[11],该征象在中央型PSP较常见,但要注意在其他良性肿瘤亦可见到。而尾征、晕征、空气新月征的发生率均低于30%,尾征均见于中心型患者,其发生与PSP对肺门血管有生长趋向性有关[17]。“晕征”目前认为为病灶周缘出血有关[15];空气新月征其病理基础目前尚有争议,有文献认为是支气管周围的肺泡间质细胞的增生和透明样变导致远端空气间隙的扩张所致[11]。本研究中尚见4例“晕征”及空气新月征同时出现,该征象较具特征性[16],但十分少见。上述这些征象对PSP诊断的提示均有重要的意义。
本研究中有3例(9.1%)的患者为多发性病灶,与文献[12]所报道的多发病灶的发病率基本一致(8.9%),至于多发病灶的产生机理未见相关文献报道,亦见一些文献把多发病灶看作是最大病灶的转移。Shin等[18]报道1例位于右肺中叶的多发簇集样排列结节周围伴有磨玻璃样密度影,该征象较罕见,本研究中未见此表现,笔者认为这种表现亦需要与继发性肺结核进行鉴别。
三、硬化性肺细胞瘤与良性病变的鉴别诊断
本组患者显示,尽管多数病灶术前诊断为良性病变(87,9%,29/33),但是正确诊断率不高,完全正确诊断率仅为21.2%(7/33)。根据其CT表现,可误诊为肺结核、错构瘤、巨淋巴结增生症、淋巴结结核、肺曲霉菌感染等良性病变。关于PSP与其他疾病的CT鉴别诊断的研究,文献报道少见。
本组患者显示,PSP病灶多境界清楚、光滑,最常见部位为下叶,30.3%的患者出现钙化,与姚红霞[15]的报道相似,并且可出现囊变(图8),所以可能误诊为结核瘤和错构瘤。胡新如和谭利华[19]的研究显示,该病显微镜下钙化发生率达65%,但CT检查仅有30%发现钙化。提示其钙化并不少见,其钙化可能是一渐进性过程,CT的钙化发现率可能与病灶检出时肿瘤的生长时间、大小等有关。结核球以年轻人多见,是结核分枝杆菌感染所致,临床症状多见咳嗽、发热及结核中毒症状,病灶好发于下叶背段及上叶尖后段,病灶周围常常伴有卫星灶及索条影,增强扫描及延时扫描多表现为无强化或边缘强化;而PSP以40~60岁的中年女性多见,是少见的良性肿瘤,多数无呼吸道症状而被偶然发现,病灶周围一般没有卫星灶,大多数患者CT增强扫描呈显著强化且见延时强化,两者有明显差别。而错构瘤,除爆米花样钙化外,内部出现脂肪亦是其典型特点,其强化程度常常低于PSP,且PSP中囊变的密度高于脂肪密度,强化多较错构瘤明显,这是两者的鉴别点。由此可见,伴有钙化的、境界清楚光滑的球形结节,除了考虑错构瘤和结核球以外,PSP也是需要考虑的鉴别诊断。
本组患者中3例PSP表现为肺门部肿块,由于其明显强化,密度不均匀,可伴有钙化及坏死,可能误诊为淋巴结结核及巨淋巴增殖症。感染症状、增强扫描病灶内见大片状或分房样无强化的坏死区、较大肿块且多为多发淋巴结肿大融合而成、境界多模糊、常同时伴有多发的淋巴结肿大、肺内及其他部位的结核,有助于淋巴结结核的诊断;而李多等[20]的研究提示,肺门部的巨淋巴增生症的影像表现与PSP相似,可伴有斑点状钙化,增强扫描强化明显,可发生于任何年龄,单中心型20岁多见,故两者的鉴别需要病理学的检查。正确地认识PSP的CT特点、扩大鉴别诊断的思维是影像科医师需要做到的。
病灶周围伴磨玻璃样密度影及空气新月征,且可以出现咯血,容易误诊为曲霉菌感染。但曲霉菌感染临床多伴有呼吸道症状,并可见发热等感染征象,实验室检查可能提示为真菌感染,CT扫描结节强化值没有PSP高,病灶周围的磨玻璃样密度影多完全环绕于结节周围;如果出现曲菌球,可出现空气新月征,空气新月征位于病灶内,其内结节不强化;而PSP病灶周围的磨玻璃样密度影多位于结节周围的一侧,很少完全环绕于结节周围,空气新月征位于病灶外,未见发热等感染症状等能够帮助鉴别。
综上所述, PSP好发于40~60岁中年女性,CT上常表现为单发的边缘规整的周围型软组织密度结节,大多数增强扫描表现为明显强化及延迟强化,多伴有血管贴边征,患者很少伴有淋巴结肿大,内部可见钙化,可伴有尾征、晕征、空气新月征,这些CT表现特征有一定的特异性,对诊断的提示有着重要的意义,并且有助于与结核球等疾病进行鉴别诊断。
[1] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol,2015,10(9):1243-1260.
[2] 冯飞跃,程贵余,高树庚,等.肺硬化性血管瘤的诊断和手术治疗.中华医学杂志,2012,92(17):1190-1193.
[3] 刘芬,方向军,曾晔,等.肺硬化性血管瘤MSCT诊断及误诊分析.中国CT和MRI杂志, 2015,13(10):37-39.
[4] 谢冬, 姜格宁, 陈晓峰, 等. 肺硬化性血管瘤165例外科治疗. 中华外科杂志, 2012, 50(2): 120-123.
[5] Chen BJ, Gao J, Chen H. Pulmonary sclerosing hemangioma:a unique epithelial neoplasm of the lung(report of 26 cases). World J Sung Oncol, 2013, 11(1): 85.
[6] 张小丽,赵强,马昕,等.15例硬化性肺细胞瘤冰冻切片与临床病理特征分析.临床与病理杂志,2016,36(12):1965-1970.
[7] Suzuki H,Saitoh Y,Koh E.Pulmonary sclerosing hemangioma with pleural dissemination:report of a case.Surg Today,2011,41(2):258-261.
[8] Bae YS,Ro JY,Shim HS,et al.Pulmonary sclerosing haemangioma with metastatic spread to stomach.Histopathology,2012,60(7):1162-1164.
[9] Low SY,Teo F,Eng P,et al.Pulmonary sclerosing hemangioma:pitfalls in management.Asian Cardiovasc Thorac Ann,2011,19(2):139-142.
[10] Soo IX, Sittampalam K, Lim CH. Pulmonary sclerosing pneumocytoma with mediastinal lymph node metastasis. Asian Cardiovasc Thorac Ann,2017,25(7-8):547-549.
[11] Shin SY,Kim MY,Oh SY,et al. Pulmonary sclerosing pneumocytoma of the lung: CT characteristics in a large series of a tertiary referral center.Medicine (Baltimore),2015,94(4):e498.
[12] 梁波,蔡培坤.肺硬化性血管瘤的MSCT特征与病理分析.罕少疾病杂志,2015,22(1):35-38.
[13] 李正军,董宝明,蔡定萍,等.硬化性肺泡细胞瘤的CT表现与病理对照研究.实用放射学杂志,2016,32(10):1525-1528.
[14] 付东,李兴付,陈真平,等.肺硬化型血管瘤CT表现与病理对照.临床肺科杂志,2016,21(2):338-339,343.
[15] 姚红霞.硬化性肺泡细胞瘤 MSCT 征象与病理的相关性分析.实用放射学杂志,2017,33(2):206-209.
[16] Baysak A, Oz AT, Mogˇulkoç N, et al. A rare tumor of the lung: pulmonary sclerosing hemangioma (pneumocytoma). Respir Med,2013,107(3):448-450.
[17] Nam JE, Ryu YH, Cho SH, et al. Air-trapping zone surrounding sclerosing hemangioma of the lung. J Comput Assist Tomogr,2002,26(3):358-361.
[18] Shin SY, Kim MY, Lee HJ, et al. Clustered pulmonary sclerosing pneumocytoma in a young man: a case report. Clin Imaging,2014,38(4):532-535.
[19] 胡新如,谭利华.肺硬化性血管瘤的CT征象与临床病理研究.实用医学影像杂志, 2015, 16(2):114-116.
[20] 李多,薛云龙,吕平欣.胸部单中心型巨淋巴结增生症3例18F-FDG 符合线路显像表现及文献复习.医学影像学杂志,2015,25(7):1174-1177.
