间插治疗模式在EGFR-TKI一线治疗继发性耐药后的晚期NSCLC中疗效观察
2018-07-02金时代李俊高雯郭人花卢凯华刘平束永前何靓
金时代,李俊,高雯,郭人花,卢凯华,刘平,束永前,何靓
(南京医科大学第一附属医院肿瘤科,江苏 南京 210029)
表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)是治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)的有效靶向药物。然而第一代EGFR-TKI治疗的中位PFS仅为9~13个月[1],几乎所有初始治疗有效的患者最终都会出现EGFR-TKI获得性耐药。因此,NSCLC在EGFR-TKI产生获得性耐药之后的后续治疗,一直是肿瘤学领域研究的热点和难点。近年来研究[2-3]表明,肺癌EGFR-TKI获得性耐药的分子机制包括EGFR第20外显子T790M继发性突变、以MET和HER2基因等为代表的旁路基因激活、磷脂酰肌醇-3-激酶催化亚单位α(PIK3CA)突变[4]、上皮细胞向间质转化(EMT)[5]及肿瘤病理类型向小细胞肺癌转化等,但仍有15%~30%的病人耐药机制不明。对于有明确的驱动基因突变的患者,目前的策略是给予相对应的靶向药物治疗,例如对合并有T790M继发性突变的患者,以奥希替尼为代表第3代EGFR-TKI已经证实有确定的疗效[6]。但针对一些已经发现的少见耐药突变,目前还没有成熟的靶向药物可以使用。对于EGFR-TKI获得性耐药后未能行二次病理活检或者液态活检的患者,以及活检结果没有发现特定的耐药机制的患者,目前尚无广泛适用的二线治疗方法,可能采用包括继续EGFR-TKI治疗[7-8]、在EGFR-TKI基础上加用化疗[9]以及单纯化疗[10-11]等。本研究旨在通过回顾性分析,探讨晚期NSCLC一线EGFR-TKI治疗后,培美曲塞间插TKI治疗模式对其疗效及生存期的影响。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月至2017年4月在南京医科大学第一附属医院接受EGFR-TKI治疗后出现获得性耐药的晚期NSCLC患者103例。所有患者在治疗前临床分期为Ⅲb或Ⅳ期,均通过扩增阻滞突变系统(ARMS)方法检测EGFR 基因突变,均包含EGFR敏感突变(其中19外显子缺失突变57例,21外显子L858R点突变43例,罕见突变2例,复合突变1例)。全组患者初次EGFR-TKI治疗的客观缓解率(ORR)66.0%,中位PFS为8个月。初次EGFR-TKI进展时年龄≥18岁,中位年龄57岁(35~84岁),女性54.4%(56/103),腺癌患者96.1%(99/103),不吸烟者77.7%(80/103),初次EGFR-TKI进展时美国东部协作肿瘤组体能状况(PS)评分0~1分89.3%(92/103)。所有患者在疾病进展时均符合Jackman等[12]制定的EGFR-TKI获得性耐药的定义,按EGFR-TKI进展后首次治疗策略分为:培美曲塞化疗间插TKI治疗组52例,单纯化疗组51例 (其中培美曲塞+顺铂方案18例,培美曲塞+卡铂方案33例)。103例患者均可评价二线治疗的近期有效率及PFS、OS。不同治疗组的临床特征见表1。

表1 入组患者的临床特征
1.2 方法
103例EGFR-TKIs获得性耐药的NSCLC患者在进展前接受第一代TKI药物治疗,其中65例接受吉非替尼治疗,5例接受厄洛替尼治疗,33例接受埃克替尼治疗。每种药物均采用常规剂量,即吉非替尼250 mg,每日1次;厄罗替尼150 mg,每日1次;埃克替尼125 mg,每日3次。EGFR-TKI进展后的二线治疗策略分为:培美曲塞化疗间插TKI治疗和单纯化疗(培美曲塞联合顺铂或卡铂方案)。间插治疗组52例患者,采用培美曲塞500 mg/m2,第1天静脉滴注,同时在第6-19天间插口服第一代TKI治疗,21 d为1个周期。单纯化疗组51例患者,其中培美曲塞+顺铂方案18例,采用培美曲塞500 mg/m2,第1天静脉滴注联合顺铂40 mg/m2,第1~3天静脉滴注;培美曲塞+卡铂方案33例,采用培美曲塞500 mg/m2,第1天静脉滴注联合卡铂AUC=5,第1天静脉滴注,21 d为1个周期。对于EGFR-TKI疗效的评价,服药后第4周进行影像学检查评价疗效,之后每8周复查1次;化疗及培美曲塞间插TKI治疗的患者,每2个周期进行影像学检查评价疗效。
1.3 疗效评价
采用实体瘤疗效评价标准1.1版,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。评价指标包括疾病控制率(DCR)、无进展生存期(PFS)和总生存期(OS)。初次EGFR-TKI治疗的PFS定义为患者接受第一代EGFR-TKI治疗开始至出现进展的时间,EGFR-TKI治疗进展后的PFS定义为二线治疗开始至再次进展或死亡的时间。OS定义为二线治疗开始至患者死亡的时间。随访的方式包括门诊随诊和电话随访,末次随访时间截止至2017年12月31日。
1.4 统计学分析
所有数据经统计软件SPSS 22.0进行统计学分析。计数资料应用χ2检验,疗效相关因素分析应用多因素Logistic回归法。应用Kaplan-Meier方法分析PFS和OS,用Log-rank检验比较各因素与PFS及OS的相关性,预后相关因素分析采用Cox多因素回归模型。在多因素分析中,所有临床因素均纳入模型。以P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 EGFR-TKI进展后两种治疗策略的近期疗效
103例患者二线治疗PR 26例(25.2%),SD 41例(39.8%),PD 36例(35.0%),ORR为25.2%,DCR为65.0%。其中间插治疗组ORR为30.8%,化疗组ORR为19.6%,两组差异无统计学意义(P=0.192)。间插治疗组和化疗组DCR分别为76.9%和52.9%,间插治疗组显著高于化疗组(P=0.011)。Logistic多因素分析提示T790M阴性(HR=0.033,95%CI 0.006~0.181,P=0.001)、培美曲塞间插TKI治疗(HR=0.200,95%CI 0.066~0.605,P=0.004)是提高疗效的独立预测因素。
在T790M突变阴性的患者中,间插治疗与化疗组的ORR分别为42.9%和10.0%,两组差异无统计学意义(P=0.051);间插治疗与化疗组的DCR分别为100.0%和50.0%,间插治疗组显著高于化疗组(P<0.001)
2.2 EGFR-TKI进展后两种治疗策略的PFS
103例患者EGFR-TKI治疗进展后接受二线治疗的中位PFS为7个月,至末次随诊,3例患者未进展。间插治疗组和化疗组中位PFS分别为8个月(95%CI 6.281~9.719)和6个月(95%CI 5.005—6.995),差异有统计学意义(P=0.003)(图1,表2)。Cox多因素生存分析提示间插治疗组的PFS显著优于化疗组(HR=0.380,95%CI 0.222~0.651,P=0.001)(表3)。Cox多因素分析显示年龄≤65岁(HR=0.320,95%CI 0.169~0.603,P=0.001)、腺癌(HR=0.176,95%CI 0.039~0.801,P=0.025)、培美曲塞间插TKI治疗(HR=0.380,95%CI 0.222~0.651,P=0.001)是降低疾病进展风险的独立预后因素。
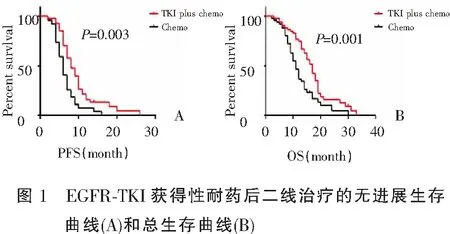
2.3 EGFR-TKI进展后两种治疗策略的OS
103例患者中位OS为14个月,至末次随诊,19例患者存活。间插治疗和化疗组的中位OS分别为17个月(95%CI 14.934~19.066个月)和11个月(95%CI 9.427~12.573个月),差异有统计学意义(P=0.001)(图1,表2)。Cox多因素生存分析提示间插治疗组的OS显著优于化疗组(HR=0.319,95%CI 0.189~0.537,P=0.001)(表3)。Cox多因素分析同时提示年龄≤65岁(HR=0.405,95%CI 0.227~0.722,P=0.002)、ECOG 0~1分(HR=0.237,95%CI 0.108~0.521,P=0.001)、一线TKI治疗的PFS>8个月(HR=0.326,95%CI 0.196~0.544,P=0.001)、T790M阴性(HR=0.216,95%CI 0.104~0.450,P=0.001)、培美曲塞间插TKI治疗(HR=0.319,95%CI 0.189~0.537,P=0.001)是降低死亡风险的独立预后因素。
在T790M突变阴性的患者中,间插治疗与化疗组的OS分别是19个月(95%CI 15.951~22.049个月)和11个月(95%CI 8.215~13.785个月),间插治疗组显著优于化疗组(P=0.020)。

表2 EGFR-TKI获得性耐药后二线治疗的PFS和OS的单因素分析
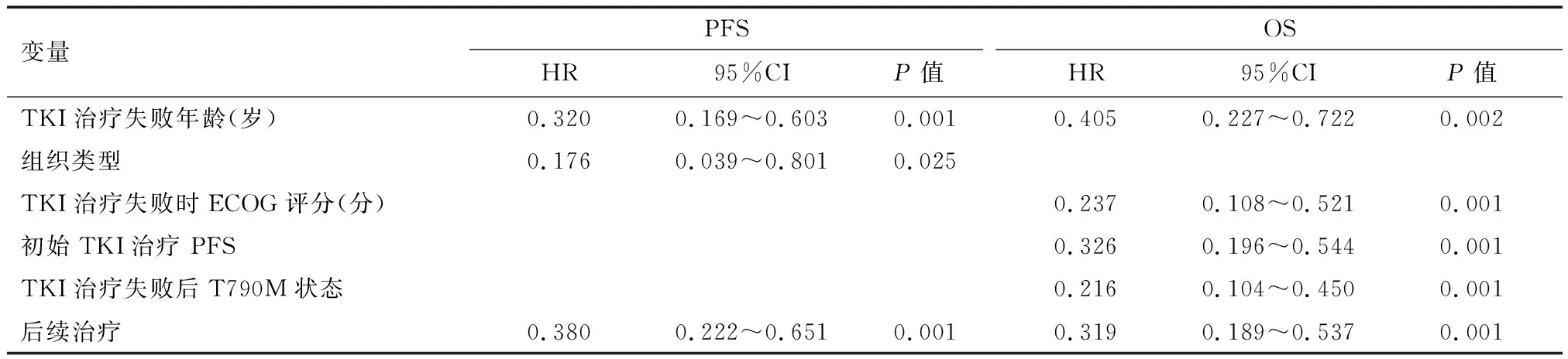
表3 EGFR-TKI获得性耐药后二线治疗的PFS和OS的多因素分析
3 讨论
随着分子靶向药物研究的不断深入,晚期NSCLC的治疗已经取得了突飞猛进的进展。其中最早发现、也是目前应用最为广泛的就是EGFR-TKI用于EGFR突变阳性的晚期NSCLC患者的全身治疗。然而对于晚期NSCLC来说,由于原发灶内以及原发灶与转移病灶之间病理类型的异质性、驱动基因突变状态和表达的异质性,治疗过程中驱动基因的动态变化以及病理类型的转化等现象的存在,使得第一代EGFR-TKI在治疗过程中会不可避免的出现获得性耐药。
对于EGFR-TKI治疗后继发性耐药的患者,目前提倡进行二次病理活检或者液态活检,寻找具体的耐药机制。但现有的临床实践中,EGFR-TKI获得性耐药后能够行二次病理活检或者液态活检寻找耐药机制的NSCLC患者比例还不高。对于未能行二次活检以及活检后没有发现特定的耐药机制的患者,目前主要的治疗策略有化疗间插TKI治疗、继续TKI治疗加用局部治疗、二线化疗以及参加临床试验等。本研究对EGFR-TKI一线治疗后进展的病例进行了回顾性分析,结果显示对于EGFR-TKI获得性耐药的晚期NSCLC患者,培美曲塞间插TKI治疗的DCR、中位PFS和OS比二线化疗更优,间插治疗可以使部分EGFR-TKI耐药的患者获益并可能逆转EGFR-TKI获得性耐药。亚组分析显示,尤其是对于T790M突变阴性、没有发现特定耐药机制的患者,这个策略更加有效。
培美曲塞是一种抗叶酸类多靶点化疗药物,主要使细胞周期阻滞在S期,并促进肿瘤细胞的凋亡。Wu等[13]研究了吉非替尼联合培美曲塞对EGFR-TKI获得性耐药细胞株PC9/GR的作用,结果提示吉非替尼与培美曲塞具有协同作用,可以降低磷酸化AKT、磷酸化细胞外信号调节激酶和B细胞淋巴瘤因子2的水平,从而可能克服EGFR-TKI获得性耐药。因此,联合培美曲塞化疗和TKI靶向治疗在理论上可以增加两者的协同作用。Yoshimura等[9]报告了一项单臂的Ⅱ期临床研究,结果显示在27例吉非替尼或厄洛替尼治疗获得性耐药后的EGFR突变型NSCLC患者中,采用培美曲塞化疗并继续TKI治疗,可以使部分患者临床缓解并可能逆转EGFR-TKI获得性耐药。Goldberg等[14]报告了另一项回顾性研究,对78例EGFR-TKI获得性耐药的NSCLC患者的后续治疗分析显示,采用静脉化疗并继续EGFR-TKI治疗的有效率优于单独化疗,PFS和OS无显著差异。本研究显示,晚期NSCLC患者在EGFR-TKI治疗获得性耐药后采用培美曲塞化疗间插TKI靶向治疗的DCR为76.9%,中位PFS为8个月,中位OS为17个月,疗效优于其他回顾性研究结果,可能与研究入选人群偏倚有关。同时,间插治疗组的DCR、中位PFS和中位OS均显著优于单纯化疗组。
IMPRESS研究是一项随机、对照的Ⅲ期多中心临床研究[15],结果显示对于EGFR突变阳性的NSCLC患者在一线EGFR-TKI治疗失败后,与改用单独化疗相比,继续应用吉非替尼联合化疗并未显著改善PFS、ORR和DCR。该结果与既往的回顾性研究[9,14]结果不一致,可能的原因包括该研究设计上存在不足,以及该研究的初步结果没有区分EGFR-TKI获得性耐药后具体分子机制。在后续研究中Mok等[16]又报告了基于入组时T790M突变分型的IMPRESS研究亚组分析,结果显示对于EGFR突变阳性的NSCLC患者在一线TKI治疗失败后,其中T790M阴性的患者继续应用TKI并联合化疗,可能有临床获益并可能逆转TKI的获得性耐药。本研究显示在一线EGFR-TKI治疗进展后接受外周血T790M突变检测结果为阴性患者中,间插治疗组和化疗组的DCR分别为100.0%和50.0%(P<0.001),中位OS分别为19个月和11个月(P=0.020),间插治疗组DCR和OS显著优于化疗组,与IMPRESS研究亚组分析结果相似。
总之,EGFR-TKI获得性耐药后的治疗策略尚在不断探索中。EGFR-TKI获得性耐药后的NSCLC不是单一疾病,而是多种多样,采用相同的治疗方法进行处理显然是不合适的。本研究结果为EGFR-TKI获得性耐药且未发现特定的耐药机制的NSCLC患者,采用培美曲塞化疗间插TKI治疗的模式来逆转TKI耐药提供了临床依据。
[1] Kobayashi S,Boggon TJ,Dayaram T,etal.EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2005,352(8):786-792.
[2] Engelman JA,Zejnullahu K,Mitsudomi T,etal.MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling[J].Science,2007,316(5827):1039-1043.
[3] Yano S,Wang W,Li Q,etal.Hepatocyte growth factor induces gefitinib resistance of lung adenocarcinoma with epidermal growth factor receptor-activating mutations[J].Cancer Res,2008,68(22):9479-9487.
[4] Ludovini V,Bianconi F,Pistola L,etal.Phosphoinositide-3-kinase catalytic alpha and KRAS mutations are important predictors of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in patients with advanced non-small cell lung cancer[J].J Thorac Oncol,2011,6(4):707-715.
[5] Suda K,Tomizawa K,Fujii M,etal.Epithelial to mesenchymal transition in an epidermal growth factor receptor-mutant lung cancer cell line with acquired resistance to erlotinib[J].J Thorac Oncol,2011,6(7):1152-1161.
[6] Mok TS,Wu YL,Ahn MJ,etal.Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer[J].N Engl J Med,2017,376(7):629-640.
[7] Asami K,Okuma T,Hirashima T,etal.Continued treatment with gefitinib beyond progressive disease benefits patients with activating EGFR mutations[J].Lung Cancer,2013,79(3):276-282.
[8] Cho BC,Im CK,Park MS,etal.Phase II study of erlotinib in advanced non-small-cell lung cancer after failure of gefitinib[J].J Clin Oncol,2007,25(18):2528-2533.
[9] Yoshimura N,Okishio K,Mitsuoka S,etal.Prospective assessment of continuation of erlotinib or gefitinib in patients with acquired resistance to erlotinib or gefitinib followed by the addition of pemetrexed[J].J Thorac Oncol,2013,8(1):96-101.
[10] Chang MH,Ahn JS,Lee J,etal.The efficacy of pemetrexed as a third-or fourth-line therapy and the significance of thymidylate synthase expression in patients with advanced non-small cell lung cancer[J].Lung Cancer,2010,69(3):323-329.
[11] Kuo CH,Lin SM,Lee KY,etal.Subsequent chemotherapy improves survival outcome in advanced non-small-cell lung cancer with acquired tyrosine kinase inhibitor resistance[J].Clin Lung Cancer,2010,11(1):51-56.
[12] Jackman D,Pao W,Riely GJ,etal.Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].J Clin Oncol,2010,28(2):357-360.
[13] Wu M,Yuan Y,Pan YY,etal.Combined gefitinib and pemetrexed overcome the acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer[J].Mol Med Rep,2014,10(2):931-938.
[14] Goldberg SB,Oxnard GR,Digumarthy S,etal.Chemotherapy with Erlotinib or chemotherapy alone in advanced non-small cell lung cancer with acquired resistance to EGFR tyrosine kinase inhibitors[J].Oncologist,2013,18(11):1214-1220.
[15] Soria JC,Wu YL,Nakagawa K,etal.Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS):a phase 3 randomised trial[J].Lancet Oncol,2015,16(8):990-998.
[16] Mok TS,Kim SW,Wu YL,etal.Gefitinib Plus Chemotherapy Versus Chemotherapy in Epidermal Growth Factor Receptor Mutation-Positive Non-Small-Cell Lung Cancer Resistant to First-Line Gefitinib (IMPRESS):Overall Survival and Biomarker Analyses[J].J Clin Oncol,2017,35(36):4027-4034.
