异甘草酸镁对四氯化碳肝纤维化大鼠肝组织病理改变的影响
2018-07-02王川林杨霞崔秋林刘全明袁东梅小平彭彬
王川林,杨霞,崔秋林,刘全明,袁东,梅小平,彭彬
(1.川北医学院附属医院感染科;2.川北医学院临床医学系;3.川北医学院电镜结构研究室,四川 南充 637000)
肝纤维化(hepatic fibrosis,HF)是肝脏对各种慢性损伤的修复反应,其中肝星状细胞(hepatic stellate cells,HSC)的活化、增殖从而导致的胶原合成增加是HF发生、发展和转归的关键因素[1-2]。目前研究认为去除病因或给予药物治疗可在组织水平逆转HF的程度,但是迄今尚未发现能明确阻断或逆转肝纤维化进展的药物。异甘草酸镁(magnesium isoglycyrrhizinate,MgIG)是我国第一个利用天然药物甘草中的有效成份提取研制的国家Ⅰ类抗肝炎药物,具有抗炎、抗氧化、保护肝细胞膜及改善肝功能的作用,临床上多用于各种肝炎的治疗[3-4]。虽然有动物实验表明MgIG也一定的抗HF的作用[5-6],但极少应用于临床,也缺乏病理学证据支持。为了证实CCl4大鼠HF的发生发展与HSC的关系,以及MgIG能否通过抑制HSC的活化而改善HF的病理进展,本研究拟建立CCl4HF模型,并在建模之初以及建模达HFⅡ期后分别给予MgIG干预,采用光镜和电镜定性观察并评价MgIG对CCl4HF大鼠肝组织病理结构、胶原纤维增生程度以及HSC数量、形状的影响。
1 材料与方法
1.1 材料与仪器
MgIG购自江苏正大天晴药业有限公司,CCl4(分析纯)与橄榄油(化学纯)均购自国药集团化学试剂有限公司,Masson三色染色试剂盒购自福州迈新生物技术公司,无水乙醇购自成都市科隆化学品有限公司,多聚甲醛(分析纯,使用时用双蒸水配制成4%多聚甲醛溶液)购自成都市科龙化工试剂厂,半自动石蜡切片机(LEICA RM2145,德国)修片机(LEICA EM TRIM2,德国),超薄切片机(LEICA EM UC7,德国),HT7700透射电子显微镜(JEM-1400PLUS,日本)。
1.2 实验动物及分组
清洁级3月龄健康SD雄性大鼠32只,体质量160~180 g,购自川北医学院动物实验中心,大鼠适应性饲养1周后,按随机数字表法分为随机分为4组:对照组(10只)、HF模型组(10只)、MgIG早期干预组(6只)、MgIG晚期干预组(6只)。
1.3 动物模型建立
HF模型制备:将CCl4与橄榄油按体积比2∶3配成40 % CCl4-橄榄油混悬液,按3 mL/kg剂量在大鼠背部皮下注射,每周两次,建立大鼠HF动物模型[7-8]。
MgIG早期干预模型制备:从CCl4造模开始同时给予腹腔注射30 mL/kg的MgIG,连续注射10周后取材。
MgIG晚期干预模型制备:从CCl4造模开始同时给予腹腔注射等量生理盐水,从第6周开始,改为腹腔注射30 mL/Kg的MgIG,连续注射5周后取材。
对照组同时皮下、腹腔注射等量的溶剂,连续注射10周后取材。
MgIG晚期干预时间确定方法:自建立模型第2周起,每周在对照组与HF模型组各随机抽选1只大鼠取肝脏作石蜡包埋切片并行HE染色后按Metavir评分标准观察大鼠肝组织纤维化评分是否达Ⅱ期。
1.4 组织处理与切片制备
大鼠称重,腹腔注射3%戊巴比妥(50 mg/kg)麻醉后内眦静脉取血,全自动生化仪检测大鼠肝功能相关指标。首先剪取一小块肝组织切成1 mm3大小的组织块放入2.5%戊二醛固定,制作电镜超薄切片。其余全部肝组织放入4%的多聚甲醛浸润固定48 h后制备石蜡包埋切片。
电镜超薄切片制备: 2.5%戊二醛固定2 h后,0.1M PBS冲洗3次,每只大鼠随机抽选5个组织块制作电镜超薄切片:1%四氧化锇(OsO4)中4 ℃固定2 h后,乙醇和丙酮梯度脱水,环氧树脂812渗透、包埋。利用超薄切片机从每个组织块切取70 nm厚的连续超薄切片,用乙酸双氧铀和柠檬酸铅染色后在透射电子显微镜下观察。
石蜡切片制备:4%的多聚甲醛浸润固定48 h后,换入70%乙醇保存,称重。从每只大鼠肝脏随机抽选4个2 mm厚的组织块行石蜡包埋,每个组织块用半自动石蜡切片机切取2张14 μm厚的石蜡切片,分别采用HE染色(肝组织一般结构观察)和Masson染色(显示肝组织内的胶原纤维)。
Masson染色步骤:按照Masson三色染色试剂盒(福州迈新生物技术公司)说明书进行。(1)切片脱蜡处理至水,试剂 A染色5 min,PBS液冲洗,再滴加1滴试剂C(磷钼酸)5 min,甩干后滴加1滴试剂D(苯胺蓝)染色5 min,PBS液冲洗,滴加1滴(100 μL)分化液(试剂 B)分化30 s;(2)甲苯胺蓝复染细胞核5~10 s。3.70%酒精、无水酒精脱水,透明,封片。
1.5 统计学分析
2 结果
2.1 MgIG对大鼠门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)和碱性磷酸酶(ALP)的影响
与对照组比较,HF模型组、MgIG早期、晚期干预组的AST、ALP值均显著升高,HF模型组、MgIG晚期干预组的ALT值均显著升高,MgIG早期干预组的ALT值无显著变化;与HF模型组比较,MgIG早期和晚期干预组的AST、ALT、ALP值无显著变化;与MgIG早期干预组比较,MgIG晚期干预组的AST、ALT、ALP值无显著变化(表1)。
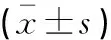
表1 各组大鼠肝功AST、ALT、ALP比较
*P﹤0.05,与对照组比较。
2.2 MgIG对CCl4大鼠肝小叶/假小叶直径及小叶内肝细胞结构的影响
HF模型组、MgIG早期和晚期干预组纤维组织增生破坏正常肝小叶结构形成了假小叶。与对照组比较,HF模型组、MgIG晚期干预组的假小叶直径显著降低,MgIG早期干预组假小叶直径无显著变化;模型组、MgIG早期干预组和晚期干预组之间假小叶的直径无显著性差异(表2,图1)。
光镜观察结果显示,与对照组比较,HF模型组肝细胞体积显著性增大,大量肝细胞出现了脂肪变性、空泡样变性等病理改变。肝组织内可见大小不一的肝细胞再生结节,再生的肝细胞胞质强嗜酸性;MgIG早期和晚期干预组肝细胞光镜结构改变与HF模型组大鼠间没有显著性差异。电镜观察结果显示,与对照组比较,HF模型组大鼠肝细胞直径显著增加,部分肝细胞质内出现大量脂滴;部分肝细胞质内出现大量的溶酶体,线粒体肿胀明显;同时,在肝细胞之间的窦周隙内出现较多前体细胞,该细胞的特征是以椭圆形的细胞核为主,核周只有极少量的胞质;MgIG早期和晚期干预组大鼠肝脏的超微病理改变与模型组无显著性差异(图2)。
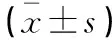
表2 MgIG对大鼠肝组织肝小叶或假小叶直径的比较
*P﹤0.05,与对照组比较。
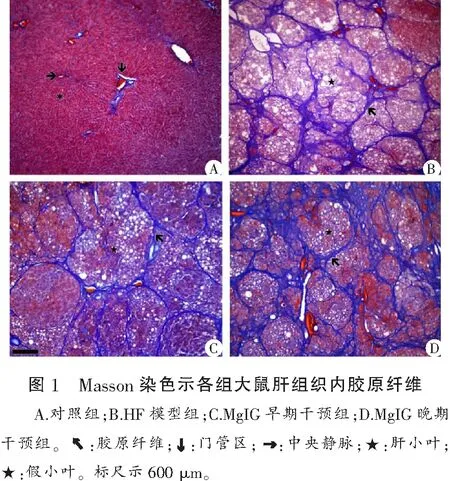
2.3 MgIG对CCl4大鼠肝组织内胶原纤维分布及体积的影响
正常组大鼠肝组织内的胶原纤维主要分布在门管区,个别大鼠窦周隙和中央静脉周围可见极少量的胶原纤维细丝。HF模型组大鼠肝组织内胶原纤维显著增生,窦周隙和中央静脉周围可见明显增厚的胶原纤维束,且随着病程进展,胶原纤维束逐渐增厚,并将正常肝小叶分割成了小而圆的假小叶。电镜下可见窦周隙增宽,其内几乎充满胶原纤维,血窦腔明显变窄甚至塌陷、消失。与HF模型组比较,MgIG早期干预组和晚期干预组大鼠肝组织胶原纤维的分布及纤维化程度均无显著性改善。
2.4 MgIG对CCl4大鼠肝组织内HSC的影响
在放大2 000倍的电镜下观察,对照组窦周隙1个视野内平均可见1~2个HSC,呈梭形,胞质内含数个大小不一的脂滴;HF模型组窦周隙1个视野内平均可见5~7个HSC聚集,且HSC胞体明显增大,由梭形变为椭圆形,胞质内脂滴数量减少或消失;与HF模型组比较,MgIG早期干预组与MgIG晚期干预组窦周隙内肝星状细胞的数量和形状均无显著性差异(图2)。
3 讨论
CCl4皮下注射是建立HF动物模型的经典方法,其机制可能与肝细胞色素P450氧化酶激活后CCl4进入体内,生成活泼的氯甲基自由基和三氯甲基自由基,启动脂质过氧化作用,导致肝细胞损伤、坏死,反复刺激形成HF有关[9]。本研究采用40%CCl4橄榄油溶液3 mL/kg皮下注射(2次/周)诱导SD大鼠HF模型,发现CCl4注射导致大鼠与肝功能相关的AST、ALT、ALP值均极显著升高,光镜和电镜观察结果显示:CCl4注射10周后窦周隙内胶原纤维显著性增加,分割正常肝小叶结构形成了假小叶,其直径较正常肝小叶显著性下降,小叶内肝细胞交替出现大量脂肪变性、坏死,继而肝细胞再生等病理改变,肝组织内未见明显的炎症反应。该结果提示,本研究采用CCl4连续注射10周建立的SD大鼠HF模型是成功的,其形成的肝组织病理学改变与HF肝硬化的病理改变一致。同时,本研究还发现HSC的数量明显增加,体积增大,形态由梭形变成了椭圆形,胞质内脂滴减少等病理改变。已有大量研究表明,HSC的激活、增殖是HF发生、发展的关键环节[10-11]。正常状态下HSC处于静止状态,当肝脏受到各种病原刺激时,被激活的HSC一方面通过增生和分泌细胞外基质参与HF的形成和肝内结构的重建,另一方面通过细胞收缩使肝窦内压升高,这两类变化最终奠定了HF、门静脉高压症发病的病理学基础[12]。因此,我们的研究结果提示CCl4连续注射可以诱导窦周隙内的HSC活化,由此我们推测CCl4所致的HF、肝硬化等病理改变,可能与HSC的活化和增殖有关。
传统观点认为肝组织纤维化是不可逆转的,直到上世纪70年代,Okazaki等[13]首次在HF动物模型体内发现肝组织纤维化可逆转的证据。近年来肝纤维药物防治的研究取得了初步成效,仍缺乏理想的特异性抗纤维化药物,中医中药在HF防治方面具有巨大潜力。MgIG是我国第一个利用天然药物甘草中的有效成份提取研制的国家Ⅰ类抗肝炎药物,有学者研究发现应用不同剂量的异甘草酸镁干预CCl4诱导的大鼠HF,发现与模型组比较,异甘草酸镁各剂量组HF大鼠血清中透明质酸、层黏连蛋白、III 型前胶原、IV 型胶原水平显著下降,而上述指标是目前公认的HF血清学指标[5]。为了证实MgIG能否通过抑制HSC的活化而改善HF的发展,本研究在CCl4建模之初和建模5周(HF评分达Ⅱ期)后采用腹腔注射30 mL/kg的MgIG,分别建立了早期和晚期MgIG干预HF模型,以探讨MgIG有无预防或逆转HF的作用。本实验通过文献检索,使用了多数研究的认为的有效剂量(30 mg/kg)对HF进行干预[5,14],我们的结果显示MgIG早期干预,对CCl4大鼠的肝功能指标有一定的改善作用,对假小叶的形成有一定的缓解作用,但是对肝细胞的病理改变、HSC的增生、活化以及胶原纤维的增生无明显的干预作用。在HF已经形成达Ⅱ期后再进行MgIG干预,对CCl4大鼠的肝功能指标、光镜和超微病理结构改变进程则均无明显的改善或逆转作用,对HSC的活化和增殖也没有明显阻断或抑制的作用。
MgIG的主要作用机制主要是抗炎和保护肝细胞膜,对肝功能有一定的保护作用[15]。本研究提示,MgIG早期预防性用药,可以保护CCl4大鼠的肝功能,但是对肝组织纤维化的进程并没有明显的抑制作用。本研究只是通过定性观察判断MgIG对HSC数量和肝组织结构的病理改变,尚需进行进一步的定量研究进行验证。同时,本研究只用了一个剂量进行研究,更高或更低剂量的MgIG是否能改善HF化的进程尚需进一步的研究。
[1] Weiskirchen R,Tacke F.Liver Fibrosis:From Pathogenesis to Novel Therapies[J].Dig Dis,2016,34(4):410-422.
[2] Okazaki I,Maruyama K.Collagenase activity in experimental hepatic fibrosis[J].Nature,1974,252(5478):49-50.
[3] 黄剑锋.异甘草酸镁的药理作用与临床评价[J].中文健康文摘, 2007,10(4):103-104.
[4] 吴建明.异甘草酸镁注射液治疗慢性乙型肝炎疗效观察[J].浙江临床医学,2017,19(6):1076-1077.
[5] 彭忠田,李佳,王培,等.异甘草酸镁对纤维化大鼠肝脏 TGF-β1 及 Smad 蛋白表达的影响[J].现代生物医学进展,2011,11(2):240-242.
[6] 蒋丽,张桂英.异甘草酸镁对大鼠酒精,肝纤维化的疗效及作用机制[J].中国现代医药杂志,2016 ,18(6):35-38.
[7] 蔡瑜,沈锡中,王吉耀.甘草酸对大鼠肝纤维化过程中肝组织基因表达的影响[J].中华医学杂志,2003,83(3):1122-1125.
[8] 黄谦,石翠翠,林兰意.血管紧张素转换酶2在四氯化碳诱导的大鼠肝纤维化中的表达及其相关性[J].中华肝脏病杂志,2013,21(1):47-52.
[9] Starkel P,Professor C,Leclercq IA,etal.Animal models for the study of hepatic fibrosis[J].Best Practice & Research Clinical Gastroenterology,2011,25(2):319-333.
[10] Lei XF,Fu W,Kim-Kaneyama JR,etal.Hic-5 deficiency attenuates the activation of hepatic stellate cells and liver fibrosis through upregulation of Smad7 in mice[J].Hepatol,2016,64(1):110-117.
[11] Wake K.“Sternzellen” in the liver:perisinusoidal cells with special reference to storage of vitamin A[J].Am J Anat,1971,132(4):429-462.
[12] Tomoko F,Shuh N.Roles of hepatic stellate cells in liver inflammation:a new perspective[J].Inflammation and Regeneration,2016,36(1):1-6.
[13] Okazaki I,Maruyama K.Collagenase activity in experimental hepatic fibrosis[J].Nature,1974,252(5478):49-50.
[14] 魏娟.异甘草酸镁对肝纤维化大鼠氧化应激反应的影响研究[J].现代中西医结合杂志,2017,26(12):1276-1279.
[15] Liang B,Guo XL,Jin J,etal.Glycyrrhizic acid inhibits apoptosis and fibrosis in carbon-tetrachloride-induced rat liver injury[J].World J Gastroenterol,2015,21( 17):5271-5280.
