淫羊藿苷对前列腺癌原位移植瘤SCID小鼠脂肪酸合成酶和LNCaP细胞生物学行为的影响
2018-06-29武福云何华琼
饶 红,武福云,何华琼*
0 引言
前列腺癌(Prostatic cancer,CaP)是男性生殖系统最常见的恶性肿瘤[1],好发于中老年男性,发病率及死亡率仅次于肺癌,严重危害男性生命健康[2]。淫羊藿苷(Icariin,ICA)是从小檗科植物心叶淫羊藿和淫羊藿枝叶中提取的黄酮类生物碱,具有抗氧化、抗肿瘤、增强机体免疫力及生殖能力等多种生物学活性,还可促进间充质干细胞增殖及迁移[3-4]。研究发现,其在Transwell小室迁移实验中可通过干扰细胞周期而发挥抑制前列腺癌细胞株的生长、迁移和侵袭[5]。因其对活体前列腺癌原位移植瘤是否有相同的作用还鲜有研究,故本实验首先通过原位接种建立严重联合免疫缺陷小鼠(SCID小鼠)LNCaP前列腺癌原位移植瘤模型并在成模后用ICA进行干预性治疗,以观察ICA是否会影响到活体动物前列腺肿瘤组织中脂肪酸合成酶(Fatty acid synthase,FAS)和LNCaP细胞生物学行为,为临床可能用于治疗CaP提供实验数据和理论依据。
1 材料与方法
1.1 实验动物 SCID小鼠40只,雄性,6周龄,体重(20.0±0.5)g,购自湖北医药学院实验动物中心,实验室恒湿、恒温,小鼠无菌隔离饲养器内单独饲养,许可证号:[SYXK(鄂)2017-0031] 。
1.2 仪器和试剂 淫羊藿苷标准品购自北京索莱宝科技有限公司;乙醚购自广州钱盛化工有限公司;人LNCaP前列腺癌细胞株、FAS ELISA试剂盒、FAS mRNA RT-PCR试剂盒均购自南京森贝伽生物科技有限公司;乙二胺四乙酸(EDTA)、RPMI-1640细胞培养基和胎牛血清(FBS)均购于赛默飞公司。
1.3 方法
1.3.1 瘤源复苏和培养 先将冻存于液氮罐的人LNCaP前列腺癌细胞株冷冻管取出,37 ℃速融,倒入10 mL含体积分数为10% FBS的RPMI-1640培养液中,放入培养箱(5% CO2、37 ℃)复苏24 h,然后更换以上培养液培养3 d,用0.25%的EDTA消化,注入离心管1 000 r/min离心5 min,弃去上清液,收集底部LNCaP前列腺癌细胞株,再用RPMI-1640培养液将细胞数密度调制成2×107个/mL的细胞悬液备用。
1.3.2 SCID小鼠前列腺癌原位移植瘤模型建模方法 将SCID小鼠移入到超净台,用乙醚吸入麻醉后仰卧位固定,在下腹相当于髂前上棘处延腹白线正中切口,分离腹膜,显露腹腔内膀胱,用医用无菌棉签将膀胱背侧壁和顶壁向尾端翻转,然后将生殖腺向两侧推开,找到膀胱颈处的叶状前列腺(分左右2叶,颜色较周围组织深)。用微量注射器抽取调制好的人LNCaP前列腺癌细胞株50 μL,左、右前列腺背外侧叶包膜内各注射25 μL,注射后以叶包膜向上鼓起并轻微脱离前列腺腺体表面为满意标准[6]。然后分层恢复脏器解剖位置后缝合,动物清醒后放回隔离器内。按上述步骤制作原位模型小鼠30只。动物术后单笼饲养,每天消毒1次,共3 d。要求动物房自然光照、恒温恒湿(20~22 ℃,60%~70%),小鼠自由饮纯净水,高压灭菌饲料喂养。
1.3.3 实验分组和治疗 2周后,将上述30只建模SCID小鼠采用随机数字表编号,随机均分为前列腺癌组(CaP组)、淫羊藿苷高剂量组(80 mg/kg,高剂量组)和淫羊藿苷低剂量组(40 mg/kg,低剂量组),每组10只,另取健康5周龄雄性SCID小鼠10只设为空白对照组(CON组)。高剂量组和低剂量组分别按80 mg/kg和40 mg/kg剂量共灌胃给药干预性治疗35 d。CaP组和CON组灌等量注射生理盐水35 d。
1.4 指标检测
1.4.1 LNCaP细胞肿瘤细胞生长和细胞周期检测 治疗35 d后脱臼处死小鼠,摘取双侧前列腺瘤体,分离背外侧叶包膜,用吸湿绵吸干后称重,并测量前列腺瘤体长、短径,每个瘤体均测量3次,以其均值为准。瘤体积计算方法:瘤体积=A×B×B/2,其中A=肿瘤长径,B=肿瘤短径。抑瘤率=[CaP组平均瘤重-高剂量组(或低剂量组平均瘤重)] /CaP组平均瘤重×100%。瘤体积测量完成后分别编号,取部分前列腺瘤体制成组织匀浆液,流式细胞学(Flow cytometry,FCM)检测LNCaP细胞周期,计算各周期比值。
1.4.2 FAS蛋白表达 取编号后保存的前列腺病理组织,用4%甲醛固定,石蜡包埋,以厚度为4 μm连续切片,采用SP法检测FAS阳性蛋白表达率。判定标准以染色后细胞质中见清晰黄至棕黄色为FAS阳性表达。
1.4.3 半定量RT-PCR检测FAS mRNA 半定量RT-PCR检测前列腺病理组织中FAS基因表达。用Pfimer5软件设计PCR扩增引物序列(见表1)。采用RNA抽提试剂盒一步法提取总RNA,GAPDH为内参,PCR扩增并对目的基因的mRNA含量进行半定量分析。PCR反应条件为:95 ℃,2 min预变性,95、52、72 ℃各30 s,扩增35个循环。以目的基因灰度值/GAPDH灰度值之比值表示FAS基因的相对值(OD值)。

表1 引物序列表
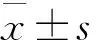
2 结果
2.1 淫羊藿苷对FAS蛋白及基因表达的影响 CON组鼠前列腺病理组织中有少量FAS阳性蛋白及FAS mRNA表达。而CaP组FAS及FAS mRNA在前列腺广泛表达,与CON组比较差异有统计学意义(F=67.014、79.296,P<0.05)。治疗后,高剂量组和低剂量组均明显降低,与CaP组比较差异有统计学意义(F=79.817、93.011,P<0.05);但两组组内比较差异无统计学意义(t=0.170、0.239,P>0.05)。见表2。

表2 淫羊藿苷对FAS蛋白及基因表达的影响(n=10)
注:与CON组比较,*P<0.05;与CaP组比较,#P<0.05
2.2 淫羊藿苷对肿瘤细胞生长的影响 治疗后,与CaP组比较,高剂量组和低剂量组瘤重量、瘤体积均低于CaP组,抑瘤率高于CaP组,差异有统计学意义(F=76.394、103.471,P<0.05);但两组组内比较差异无统计学意义(t=0.094、0.193,P>0.05)。见表3。
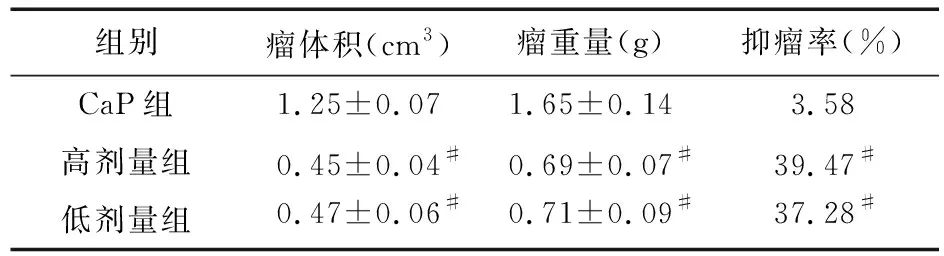
表3 淫羊藿苷对肿瘤细胞生长的影响(n=10)
注:与CaP组比较,#P<0.05
2.3 淫羊藿苷对细胞周期的影响 FCM检测显示,CaP组G0/G1明显高于CON组,而S期明显低于CON组(F=91.257、112.653,P<0.05)。治疗后,高剂量组和低剂量组前列腺癌LNCaP细胞阻滞于S期,其G0/G1比值明显降低,S期明显提高,与CaP组比较差异有统计学意义(F=47.269、97.304,P<0.05);但两组组内比较差异无统计学意义(t=0.412、0.107,P>0.05)。见表4。
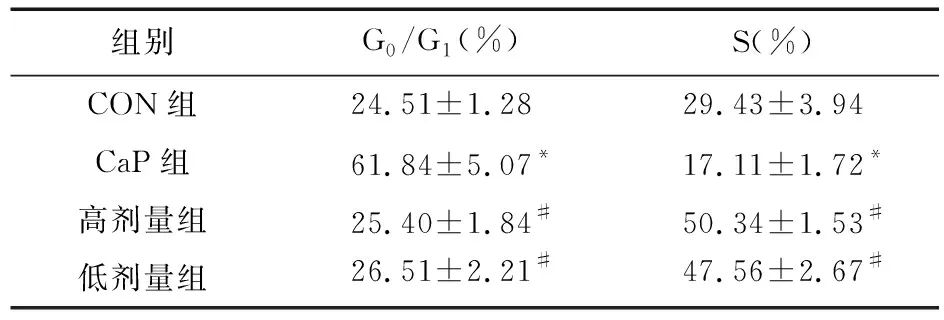
表4 淫羊藿苷对细胞周期的影响(n=10)
注:与CON组比较,*P<0.05;与CaP组比较,#P<0.05
3 讨论
FAS是内源性脂肪酸合成的关键酶,研究显示,FAS在多种恶性肿瘤中表达增强,患者多出现脂肪酸代谢紊乱现象。目前,FAS已被证实在CaP肿瘤组织中高表达,因其验出率及特异度高,目前已成为CaP的恶性程度、是否转移及不良预后的重要参考指标[7]。目前,对CaP的治疗以去势、抗癌药、化疗为主,中医中药治疗为辅,有研究表明,中药可通过调节雄激素受体信号通路而达到治疗目的[8-9]。淫羊藿是补益类中草药,具有强筋祛湿补肾的作用,主治虚冷不育、阳痿遗精、肾虚喘咳、尿频失禁、风湿痹痛、半身不遂、腰膝酸软等病症。现代药理学研究发现,淫羊藿提取物ICA具有抗肿瘤、抗动脉粥样硬化、调节机体免疫系统提高免疫力、抑制破骨细胞活性和促进成骨细胞生长等作用[10-11]。另外,淫羊藿苷还用于治疗性功能障碍,在治疗肿瘤时还具有抗细胞凋亡、增强肿瘤细胞对放化疗的敏感性的作用[12-13]。
在本研究中,笔者预实验显示,LNCaP前列腺癌原位移植瘤模型SCID小鼠前列腺均有移植瘤生长,且肿瘤广泛浸润小鼠精囊、膀胱等周围盆腔组织和脏器,形成固定的实质性团块,说明造模成功。在正式实验中,结果表明,ICA可降低FAS蛋白及其基因表达。FASE具有多种催化功能,是合成脂肪酸的功能酶,在恶性肿瘤组织中FASE异常高表达,高表达的FAS会催化内源性脂肪酸的大量合成,而内源性脂肪酸是肿瘤细胞生长必需的脂肪酸,因此,FASE高表达是肿瘤细胞为适应其恶性生长的需求[14]。笔者认为,ICA可通过抑制FAS合成,降低内源性脂肪酸的合成,间接降低肿瘤细胞生长所必需的脂肪酸供给,使生长速度减缓。现代医学研究表明,恶性肿瘤的发生涉及多个基因和蛋白,如Rb、p21、p53、p16、BRCA1、p15等调控基因在肿瘤的发生过程中发生基因改变、失活,并由此造成细胞周期监测功能缺陷[14-15]。另外,恶性肿瘤生长的最基本生物学特征就是肿瘤细胞失控性增殖,即细胞周期调控紊乱,目前使用的抗癌药主要作用于G2/M期和S期,可使失控性增殖的肿瘤细胞阻滞在G2/M期和S期[16]。研究表明,药用植物及其提取物甾醇、单体等能够诱导非正常细胞周期细胞发生细胞周期停滞现象,促使肿瘤细胞脱噬而发挥抗癌作用[17]。从本实验结果来看,高剂量组和低剂量组S期细胞比值升高、G0/G1期细胞比例降低,与CaP组比较差异有统计学意义,说明ICA可将接种的LNCaP 前列腺癌细胞阻滞在S期。另外,高剂量组和低剂量组瘤体积和瘤重量明显低于CaP组,FCM检测显示抑瘤率分别为39.47%和37.28%,表明ICA对前列腺癌细胞的生长具有明显的抑制作用。
总之,本研究表明,ICA可明显抑制前列腺癌原位移植瘤的生长,推测淫羊藿苷可能通过抑制FAS来降低肿瘤细胞生长必需的内源性脂肪酸的合成,并使失控性增殖的肿瘤细胞阻滞在S期,调节LNCaP细胞生物学行为,明显抑制其生长、迁移与侵袭能力,诱导肿瘤细胞凋亡和生长抑制,为ICA开发后可能应用于临床治疗CaP提供了理论参考。
参考文献:
[1] 王贻兵,刘丹,王佳贺.JAK2/STAT3信号转导通路在岩大戟内酯B诱导的前列腺癌细胞PC-3凋亡中的作用[J] .实用药物与临床,2016,19(9):1065-1068.
[2] 李汉忠,张玉石.2016年前列腺癌诊治热点回顾[J] .中华外科杂志,2017,55(1):59-62.
[3] 李钊,王雄彪.淫羊藿苷的研究进展[J] .现代中西医结合杂志,2015,24(8):908-910.
[4] 张黎声,韩小晶,罗志荣,等.淫羊藿苷对大鼠骨髓间充质干细胞迁移作用的影响[J] .中国中医药信息杂志,2017,24(2):44-48.
[5] 张温花,张文超,于远东.淫羊藿苷对前列腺癌细胞株活力、迁移与侵袭的作用[J] .中国病理生理杂志,2017,33(6):1017-1020.
[6] 王金秋,李志,何丹,等.SCID小鼠原位接种LNCaP前列腺癌模型的建立[J] .北京农业职业学院学报,2012,26(5):19-22.
[7] 王科峰,陈小楠,詹运洪,等.脂肪酸合成酶与ECT骨显像对前列腺癌骨转移的诊断价值[J] .现代肿瘤医学,2013,21(4):802-804.
[8] 曹爱娇,邵瑞,王彧.中药通过调节雄激素受体信号通路治疗前列腺癌的研究进展[J] .中国临床药理学杂志,2017,33(13):1263-1266.
[9] 朱华宇,李玉洁,吴元胜.脱水淫羊藿素与金雀异黄酮对MCF-7、MDA-MB231细胞株增殖的影响研究[J] .现代中西医结合杂志,2017,26(7):685-697.
[10] 张淑琴,贠向阳,郑倩,等.淫羊藿素对3种人肿瘤细胞增殖抑制作用的比较[J] .中华实验外科杂志,2015,32(8):1919-1921.
[11] 纪昕,王崇,李洁,等.淫羊藿苷通过增强 Fas-FasL 表达活性诱导裸鼠食管癌细胞凋亡[J] .重庆医学,2016,45(12):1608-1611.
[12] Xu SF,Jin T,Lu YF,et al.Effect of icariin on UDP-glucuronosyl-transferase in mouse liver[J] .Pianta Medica,2014,80(5):387-392.
[13] 黄榕芳,何诚,朱伟峰,等.p16、GATA3表达及人乳头状瘤病毒分型检测在宫颈癌累犯膀胱病理诊断中的价值[J] .中华病理学杂志,2017,46(6):388-392.
[14] 李欣.脂肪酸合酶在肿瘤中的研究进展[J] .肿瘤研究与临床,2015,27(10):717-720.
[15] 张嘉穗,陈惠,魏国清,等.脂肪酸合酶——抑制肿瘤的新靶点[J] .华西药学杂志,2014,29(5):599-601.
[16] 詹启敏,陈杰.细胞周期与肿瘤转化医学[J] .中国肿瘤临床,2014,41(1):1-7.
[17] 曹玫,欧阳露.植物甾醇的抗肿瘤作用及其机制研究进展[J] .实用药物与临床,2015,18(9):1104-1107.
