五味子乙素调控PI3K/Akt信号通路介导大肠癌细胞SW116凋亡
2018-06-29王金桥
王金桥,李 靖
0 引言
五味子属植物中的一个活性单体成分五味子乙素(Schisandrin B),具有较强的生物活性[1]。目前对其药理作用进行了大量的研究,证实五味子乙素可以抑制肝细胞转氨酶活性、抗炎、降低脂质过氧化,表现出抗氧化应激、护肝等生物活性[2-5]。近期研究表明,五味子乙素还表现出一定的抑制肿瘤功效,可以阻滞上皮间质转化达到降低乳腺癌细胞侵袭和迁移的目的,阻断胆囊癌细胞的分裂周期来抑制该细胞的增殖,诱导其凋亡,抑制cyclin D1 mRNA的水平,诱导胃癌细胞的凋亡[6-10]。大肠癌是癌症死亡的主要原因之一,其术后生存率较低[11],找到新的治疗方法一直是大肠癌治疗的研究热点。早期研究发现,五味子乙素能够逆转人结肠癌细胞多药耐药性[12],抑制结肠癌SW480细胞增殖、诱导其凋亡[13],但其对大肠癌细胞的作用机制报道甚少。因此,本文探讨了五味子乙素对大肠癌SW116细胞凋亡的作用及PI3K/Akt信号通路的影响,阐明其抑制肿瘤作用的关键靶点,为进一步研究五味子乙素抗肿瘤作用提供实验和理论依据。
1 材料及方法
1.1 材料和仪器 大肠癌SW116细胞株来源于美国ATCC细胞库;五味子乙素(杭州临安天鸿生物科技有限公司,批号:5521-65-6,纯度≥98%);CCK8试剂盒(美国Sigma公司,批号:WH1199);Annexin-FITC凋亡试剂盒(广州碧云天生物试剂公司,批号:P0012S-07);Bax、Bcl-2、PI3K、p-Akt、Akt及β-actin抗体购自美国Sigma公司;Victor3 1420 Multilable Counter酶标仪(DX540,美国);SDS-PAGE凝胶电泳(北京六一仪器厂,型号:DYCZ-24DN);双色红外激光成像系统(BIO-RAD,美国)。
1.2 细胞培养及分组 人大肠癌细胞SW116培养于10%小牛血清、1 000 U/mL青霉素、80 mg/mL链霉素、pH 7.2的PRMI1640培养基中,培养条件为5% CO2、37 ℃,SW116细胞为上皮型贴壁生长,每隔2~3 d进行传代培养,接种后24 h取对数生长期的细胞用于后续实验。SW116细胞分为空白对照组(A组)、10 μg/mL五味子乙素组(B组)、20 μg/mL五味子乙素组(C组)及40 μg/mL五味子乙素组(D组)。其中A组细胞加入相同体积的培养基,细胞接种24 h后加入不同浓度的五味子乙素,继续处理细胞24~72 h,消化收集细胞,检测各项指标。
1.3 CCK8实验 将生长良好的SW116细胞用0.25%胰蛋白酶和0.02% EDTA混合液消化、收集、制备成细胞悬液,尽量吹打均匀,接种于96孔板,平行设置5个复孔。当药物干预细胞24 h后,吸去旧培养基,每孔加入10 μL CCK8试剂,于5% CO2、37 ℃培养箱中继续培养1 h,用酶联免疫分析仪于450 nm处测定各孔的吸光度值。
1.4 细胞凋亡率检测 将生长良好的SW116细胞用0.25%胰蛋白酶和0.02% EDTA混合液消化、收集,制备成细胞悬液,尽量吹打均匀,接种于6孔板。收集经不同浓度五味子乙素处理后的SW116细胞,用无菌的PBS清洗细胞2次,2 000 r/min离心5 min后收集细胞,加入1 μL Annexin-FITC,混匀后加入5 μL Propidium Iodide混匀;避光反应5 min,上流式细胞仪进行细胞凋亡率检测。
1.5 细胞蛋白浓度检测 将生长良好的SW116细胞用0.25%胰蛋白酶和0.02% EDTA混合液消化、收集,制备成细胞悬液,尽量吹打均匀,接种于6孔板。细胞经不同浓度药物处理24 h后,消化收集细胞,提取蛋白并检测蛋白浓度。每孔上样30 μg,进行SDS-PAGE垂直电泳,然后电转至NC膜,脱脂奶粉封闭1 h;进行一抗孵育,用TBST洗膜,每10 min清洗1次,共3次,将NC膜放入稀释好的Bax、Bcl-2、PI3K、p-Akt及Akt抗体(1∶1 000稀释)中,4 ℃摇动过夜;TBST洗膜后将NC膜放入辣根过氧化物酶标记的二抗中(1∶3 000),室温孵育1.5 h;TBST细胞后进行蛋白表达量分析。
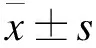
2 结果
2.1 细胞增殖抑制实验 CCK8法结果表明,与A组相比,不同剂量五味子乙素干预的SW116细胞生长明显受到抑制。加入五味子乙素24 h后,不同剂量药物干预的细胞增殖抑制率显著升高,与A组比较差异有统计学意义(P<0.05);加入五味子乙素处理细胞48、72 h后,不同浓度药物干预后的细胞增殖受到明显抑制,表现出时间依赖性。五味子乙素浓度越高,细胞增殖抑制率越显著,并且各浓度组之间的抑制作用差异均有统计学意义(P<0.05),表现出剂量依赖性。见表1。

表1 五味子乙素对SW116细胞增殖抑制率的影响(%)
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,&P<0.05;与24 h时比较,△P<0.05;与48 h时比较,▲P<0.05
2.2 细胞凋亡检测实验 五味子乙素未干预时,4.7%的SW116细胞发生凋亡。加入五味子乙素处理后,SW116细胞凋亡明显上升,不同剂量五味子乙素均能诱导细胞的凋亡,随着药物浓度的升高,细胞的凋亡率也逐渐增加,表现出浓度依赖性。五味子乙素可以明显抑制大肠癌SW116细胞株的增殖。见图1、表2。

图1 五味子乙素对SW116细胞凋亡的影响

表2 五味子乙素对SW116细胞凋亡率的影响
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,&P<0.05
2.3 五味子乙素对凋亡蛋白表达的影响 不同剂量五味子乙素对SW116细胞处理干预24 h后,采用免疫印迹技术对细胞中凋亡相关蛋白Bax、Bcl-2表达水平检测,结果如图2所示。结果表明,五味子乙素可以明显诱导促凋亡蛋白Bax的表达,随着五味子乙素剂量的升高,Bax表达水平也随之升高,与A组比较差异有统计学意义(P<0.05);而五味子乙素可以明显抑制抗凋亡蛋白Bcl-2的表达,随着药物浓度升高,Bcl-2表达水平降低,与A组比较差异有统计学意义(P<0.05)。

图2 五味子乙素对Bax、Bcl-2蛋白表达水平的影响
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,&P<0.05
2.4 五味子乙素对PI3K/Akt通路蛋白表达的影响 不同剂量五味子乙素对SW116细胞处理干预24 h后,采用免疫印迹技术对细胞中PI3K/Akt信号通路活化情况进行检测,结果如图3所示。结果表明,五味子乙素可以明显抑制PI3K、p-Akt蛋白水平,随着五味子乙素剂量升高,PI3K、p-Akt蛋白表达水平降低,与A组比较差异有统计学意义(P<0.05);而Akt蛋白表达水平则没有发生明显的变化。说明五味子乙素可以通过抑制PI3K/Akt信号通路活化达到诱导SW116细胞凋亡的效果。

图3 五味子乙素对PI3K/Akt信号通路的影响
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,&P<0.05
3 讨论
大肠癌在肿瘤死亡率中占据较高的比例,其治疗方法主要为手术、放疗及靶向治疗等,然而该疾病的临床治疗效果并不明显,术后5年生存率为60%,而出现转移灶后患者的5年生存率仅为10%[14]。因此,找到一种新的治疗大肠癌的方法至关重要。前期较多文献报道,中药具有改善疾病症状、提高免疫力、结合放化疗增敏减毒、减少复发转移等功效;并且中药在大肠癌的治疗中也表现出较好的临床效果[15]。中药单体五味子乙素是从五味子中提取得到的活性成分,并且其具有较好的抗癌活性,尤其对膀胱癌、胃癌及乳腺癌等肿瘤的抑制效果较为显著。但五味子乙素对大肠癌SW116细胞的增殖、凋亡等作用及其作用的有关机制尚未得到很好的证实。本研究结果表明,五味子乙素能够明显抑制SW116细胞的增殖,诱导其凋亡。
PI3K信号通路活化介导肿瘤的发生,并且研究证实,PI3K/Akt信号传导通路在细胞增殖、分化、肿瘤的血管形成等方面发挥着重要作用[16]。还有报道提出,PI3K/Akt信号传导与肿瘤的多药耐药关系密切[17]。在PI3K信号传导过程中,当上游信号作用细胞膜表面时,会引起酪氨酸激酶自身磷酸化或磷酸化其他作用底物,可在细胞膜内表面产生PI3K结合位点,激活下游的Akt磷酸化,进而活化或抑制其下游靶基因介导细胞增殖、分化、凋亡、迁移及侵袭的调控。本研究结果显示,五味子乙素能明显抑制PI3K/Akt信号通路的活化,主要通过抑制PI3K和p-Akt蛋白的表达,说明五味子乙素可以通过调控PI3K/Akt信号通路介导SW116细胞的凋亡。Bcl-2、Bax在细胞凋亡调控过程中起着十分重要的作用。Bax是一种促凋亡蛋白,而Bcl-2是一种抗凋亡蛋白。本研究发现,五味子乙素可以明显诱导Bax表达,抑制Bcl-2表达,进一步诱导SW116细胞凋亡。
综上所述,五味子乙素能够明显抑制大肠癌SW116细胞的增殖,促使其凋亡,其机制可能与五味子乙素下调PI3K/Akt信号通路活化有关,继而启动细胞凋亡。
参考文献:
[1] 潘瑶,林剑霞.五味子乙素的药理作用研究概况[J] .吉林医药学院学报,2015,36(1):60-62.
[2] Zhu N,Cai C,Zhou A,et al.Schisandrin B prevents hind limb from ischemia-reperfusion-induced oxidative stress and inflammation via MAPK/NF-κB pathways in rats[J] .Biomed Res Int,2017,2017:4237973.
[3] Giridharan VV,Thandavarayan RA,Arumugam S,et al.Schisandrin B ameliorates ICV-infused amyloid β induced oxidative stress and neuronal dysfunction through inhibiting RAGE/NF-κB/MAPK and up-regulating HSP/Beclin expression[J] .PLoS One,2015,10(11):e0142483.
[4] Thandavarayan RA,Giridharan VV,Arumugam S,et al.Schisandrin B prevents doxorubicin induced cardiac dysfunction by modulation of DNA damage,oxidative stress and inflammation through inhibition of MAPK/p53 signaling[J] .PLoS One,2015,10(3):e0119214.
[5] Giridharan VV,Thandavarayan RA,Bhilwade HN,et al.Schisandrin B,attenuates cisplatin-induced oxidative stress,genotoxicity and neurotoxicity through modulating NF-κB pathway in mice[J] .Free Radic Res,2012,46(1):50-60.
[6] Xiang SS,Wang XA,Li HF,et al.Schisandrin B induces apoptosis and cell cycle arrest of gallbladder cancer cells[J] .Molecules,2014,19(9):13235-13250.
[7] Liu Z,Zhang B,Liu K,et al.Schisandrin B attenuates cancer invasion and metastasis via inhibiting epithelial-mesenchymal transition[J] .PLoS One,2012,7(7):e40480.
[8] Liu XN,Zhang CY,Jin XD,et al.Inhibitory effect of schisandrin B on gastric cancer cells in vitro[J] .World J Gastroenterol,2007,13(48):6506-6511.
[9] Li L,Lu Q,Shen Y,et al.Schisandrin B enhances doxorubicin-induced apoptosis of cancer cells but not normal cells[J] .Biochem Pharmacol,2006,71(5):584-595.
[10] 徐秋玲,金秀东,郭冉,等.五味子乙素逆转人结肠癌细胞多药耐药性[J] .中国食物与营养,2011,17(12):64-66.
[11] Storli KE,Søndenaa K,Bukholm IR,et al.Overall survival after resection for colon cancer in a national cohort study was adversely affected by TNM stage,lymph node ratio,gender,and old age[J] .Int J Colorectal Dis,2011,26(10):1299-1307.
[12] 徐秋玲,金秀东,郭冉,等.五味子乙素逆转人结肠癌细胞多药耐药性[J] .中国食物与营养,2011,17(12):64-66.
[13] 姜恩平,李贺,于春艳,等.五味子乙素通过p38MAPK信号通路对结肠癌SW480细胞凋亡和侵袭的影响[J] .吉林大学学报(医学版),2015,41(4):675-679,885.
[14] Lin FX,Tian LF,Lei CY,et al.Chinese medicine for outcomes in colorectal cancer patients:a retrospective clinical study[J] .Chin J Integr Med,2017,23(9):648-653.
[15] Davies JM,Goldberg RM.Treatment of metastatic colorectal cancer[J] .Semin Oncol,2011,38(4):552-560.
[16] 郭崇勇,柯卫锋,宋科瑛,等.PI3K/AKT通路参与调控乳腺癌多药耐药和侵袭转移的研究[J] .现代生物医学进展,2012,12(25):4809-4812.
[17] Abdul R,Serra V,Gyorffy B,et al.The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1[J] .Oncogene,2006,25(12):1743-1752.
