IGF-1对多发性抽动症模型大鼠纹状体神经元氨基酸递质水平及细胞凋亡的影响
2018-06-28伍俊伊曾晓云
伍俊伊,曾晓云
(武汉市普爱医院 神经内科,湖北 武汉 430030)
小儿多发性抽动症(tourette syndrome,TS)是以发音异常和多种运动为特征的人类神经障碍性疾病。临床表现为不自主的、无目的的单一或多部肌群的收缩,如眨眼、皱眉、摇头、耸肩等运动[1]。目前该病的病因和发病机制尚未明确,皮质-纹状体-丘脑-皮质回路中神经递质失衡一直是学者们探索的主流方向,多数学者认为多巴胺(DA)系统功能异常及相关递质(受体)表达失衡可能是其主要发病机制,但随着研究的深入,逐渐发现氨基酸类递质与TS的发生密切相关[2]。胰岛素样生长因子-1(IGF-1)可减缓肌萎缩侧索硬化症病情恶化[3]。IGF-1对戊四唑诱导的幼年大鼠癫痫持续状态具有明显的神经保护作用,可抑制神经细胞凋亡,并促进增殖[4]。研究表明,TS患儿血清IGF-1含量显著下降,且可作为其诊断的辅助检测指标[5]。本研究探讨IGF-1对TS模型大鼠纹状体神经元内氨基酸递质水平及细胞凋亡的影响,以期为TS的临床治疗和药物研发提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性Wistar大鼠24只,体重(220±30)g,购自华中科技大学实验动物中心,许可证号为SCXK(鄂)2015-0007,动物实验遵循《关于善待实验动物的指导下意见》的相关规定。大鼠分笼饲养,实验前实验性饲养1周,室温(22±2)℃,湿度50%~70%,通风,昼夜节律为12 h/12 h,自由摄食饮水。
1.1.2 实验试剂 亚氨基二丙腈(IPDN)、谷氨酸(Glu)、γ-氨基丁酸(GABA)、四硼酸钠、邻苯二甲醛购自美国Sigma公司,重组IGF-1购自美国Chemicon公司,二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自美国Thermo Fisher公司,核转录因子-κB(NF-κB)、半胱天冬酶-3(caspase-3)一抗购自南京碧云天生物技术公司,GAPDH一抗、兔抗鼠二抗购自武汉博士德公司,磷酸氢二钠、高氯酸、无水甲醇等均为国产分析纯。
1.2 方法
1.2.1 动物分组 24只大鼠按照随机数字表法均分为3组:对照组大鼠注射与各组药物等体积的生理盐水;模型组大鼠注射腹腔注射IPDN,剂量为350 mg·kg-1,每天1次,连续给药7 d;治疗组大鼠先腹腔注射IPDN,剂量及时间与模型组一致,第7天注射完后6 h再注射重组IGF-1 1次,剂量为0.1 mg·kg-1。IGF-1采用脑立体定位注射,药物使用生理盐水稀释至终浓度为6 μg·μl-1,大鼠经水合氯醛麻醉后固定于脑立体定位仪,按脑立体定位图谱用微量注射器注射,注射完后停针15 min,缝合伤口,继续喂养7 d。
1.2.2 TS模型建立判断 大鼠腹腔注射IPDN造模7 d后,模型鼠均出现不同程度的刻板行为(头部抽动、旋转运动)和运动行为(探究活动增加),尤其刻板行为表现明显且易分辨,提示TS大鼠模型建立成功。
1.2.3 刻板运动评分 分别于给药后即刻及3、5、7 d对大鼠进行行为学检测,参照Khan等[6]的方法并加以改进。将大鼠放置于单独的观察笼内,室内环境安静、避光,适应5 min后使用数码摄录机进行大鼠行为的摄像,同时采用双盲法对大鼠刻板运动进行评分,评分时间为2 min,具体标准:无刻板运动记0分,有旋转行为记1分,头部垂直运动记2分,头部垂直运动和旋转行为记3分,头侧摆伴头部垂直运动记4分。取两人评分的平均值并记录结果。
1.2.4 高效液相色谱法测定纹状体内Glu、GABA含量 将大鼠在最后一次给药24 h后断头处死,快速分离出纹状体,用干净铝箔包好置于液氮中速冻,-80 ℃冰箱保存。称取纹状体组织30~50 mg,加0.35 ml预冷的匀浆工作液,冰浴下使用电动微量匀浆器快速匀浆,静置10 min,4 ℃下14 000×g离心15 min,取上清液,用离心式过滤器7 000 r·min-1离心过滤,再用0.05 mol·L-1高氯酸10倍稀释,取20 μl放入自动进样器中待测。色谱条件:预柱为Shiseido,Guard Cartridge,Capcell C18 MG S-5,4.0 mm×10 mm;色谱柱:Waters XterraTM MS(3.0 mm×50 mm,2.5 μm);流动相为100 mol·L-1磷酸氢二钠,25%甲醇,10%乙腈,用磷酸调pH至6.70;流速:0.6 ml·min-1;衍生方法:取50 μl OPA/β-巯基乙醇加入到20 μl稀释后的纹状体组织匀浆液中,衍生2 min后上样,进样量为20 μl,柱温40 ℃,设置2道电势为150和550 mV。
1.2.5 蛋白印迹法检测NF-κB、caspase-3蛋白的表达 使用细胞蛋白裂解液将纹状体组织充分裂解完全,离心后吸取上清,采用BCA法测定总蛋白浓度,小管分装后加上样缓冲液,沸水浴使蛋白高温变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,半干电转移至硝酸纤维素膜,脱脂奶粉封闭,NF-κB、caspase-3、GAPDH一抗孵育4 ℃过夜,洗膜后二抗孵育,洗膜后暗房显影。蛋白表达半定量采用条带灰度分析。
1.3 统计学处理
2 结 果
2.1 刻板运动评分比较
对照组大鼠各个时间点均无刻板运动发生,模型组和治疗组大鼠各个时间刻板运动评分详见表1。与模型组相同时间比较,治疗组大鼠IGF-1处理后5、7 d的刻板运动评分显著减少(P<0.05)。
表1模型组与治疗组大鼠给药后不同时间点的刻板运动评分
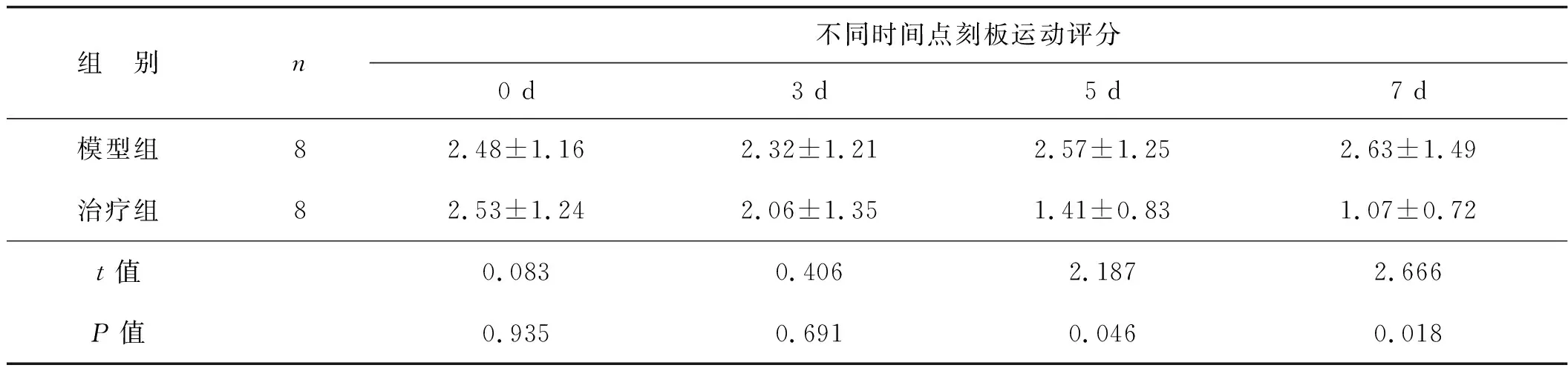
组 别n不同时间点刻板运动评分0 d3 d5 d7 d模型组82.48±1.162.32±1.212.57±1.252.63±1.49治疗组82.53±1.242.06±1.351.41±0.831.07±0.72t值0.0830.4062.1872.666P值0.9350.6910.0460.018
2.2 纹状体Glu、GABA含量比较
与对照组比较,模型组大鼠纹状体Glu、GABA含量显著上升(分别t=5.037、t=4.855,均P<0.05),治疗组纹状体Glu、GABA含量也显著上升(分别t=2.759、t=2.622,均P<0.05);与模型组比较,治疗组大鼠IGF-1处理后纹状体Glu、GABA水平明显降低(分别t=2.457、t=2.213,均P<0.05)。见表2。
表2各组大鼠给药后纹状体内Glu和GABA含量
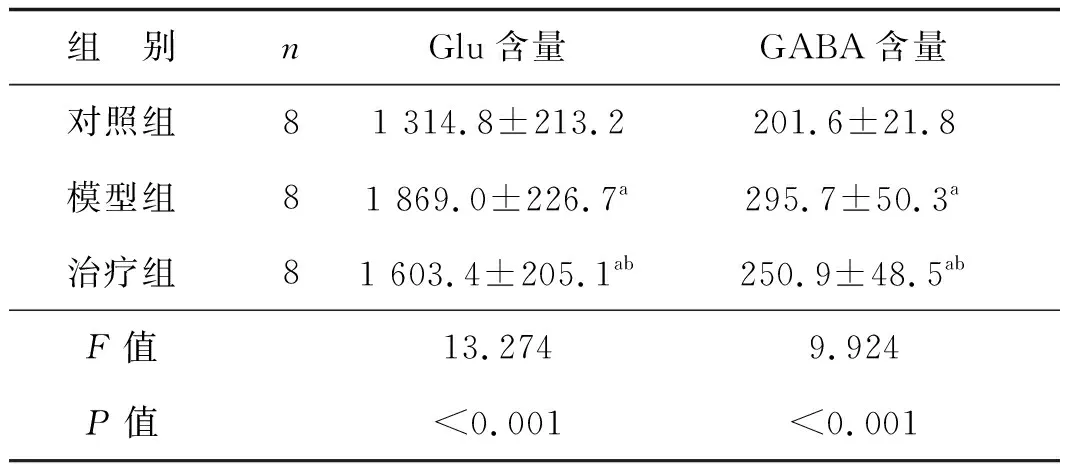
μg·g-1
a 与对照组比较,P<0.05; b 与模型组比较,P<0.05
2.3 纹状体组织NF-κB、caspase-3蛋白表达
与对照组比较,模型组大鼠纹状体NF-κB、caspase-3蛋白表达水平显著上调(均P<0.05),治疗组纹状体NF-κB、caspase-3蛋白表达水平也显著上升(均P<0.05);与模型组比较,治疗组大鼠IGF-1处理后纹状体NF-κB、caspase-3蛋白表达水平明显下降(均P<0.05)。见图1。
3 讨 论
TS发病与DA、5-羟色胺(5-HT)、去甲肾上腺素等神经递质系统失衡有关[1]。目前研究表明,脑内氨基酸类神经递质异常可能参与TS发展[2]。TS患者脑内Glu水平升高使中枢神经系统呈过度兴奋状态,抑制Glu过度释放可有效改善TS及其合并症发生[7]。TS病人血清GABA含量升高,推测GABA参与TS发展[8]。本研究结果显示,模型组大鼠纹状体内Glu和GABA含量与对照组比较显著上升,与上述报道结果一致,说明TS发病与脑内氨基酸递质水平异常有关。

a 与对照组比较,P<0.05; b 与模型组比较,P<0.05
图1各组大鼠纹状体凋亡相关蛋白NF-κB、caspase-3表达情况
IGF-1又称生长调节素C,与机体组织修复、神经保护等有关[9-10]。研究表明,运动神经障碍患者脑脊液中IGF-1含量较之健康对照者明显减少[11];帕金森病患者血清IGF-1水平也显著低于健康对照组[12];皮质下缺血性脑血管病患者血清IGF-1水平明显降低,且与认知功能损害呈正相关。本研究结果显示,脑内注射给予IGF-1能够抑制TS大鼠刻板运动行为的发生,降低纹状体内氨基酸递质Glu和GABA的含量,延缓TS症状发展,但确切的作用分子机制有待将来更深入的研究。
IGF-1受体广泛分布于人体各组织器官,在中脑黑质纹状体区DA能神经元中亦有表达。多项研究发现,IGF-1具有神经保护作用;IGF-1可抑制左旋多巴对神经细胞的凋亡诱导作用[13];IGF-1基因敲除小鼠纹状体微白蛋白神经元严重脱失[14]。研究表明,IGF-1抑制细胞凋亡与减少促凋亡因子caspase-3合成、降低Bax/Bcl-2之值、减少细胞色素C释放等相关[15-16]。本研究结果表明,IGF-1可通过抑制caspase-3、NF-κB蛋白表达对TS纹状体神经元具有一定的保护作用。
综上所述,IGF-1对TS大鼠纹状体神经元具有一定的保护作用,机制可能与其下调纹状体内氨基酸递质水平及凋亡蛋白表达有关。
[参考文献]
[1] 姚阳,刘坤,杨宇,等.异钩藤碱对多发性抽动症模型大鼠头部抽动行为与脑内单胺递质水平的影响[J].中华行为医学与脑科学杂志,2016,25(1):29-33.
[2] 张雯,王素梅,王道涵,等.健脾止动汤对多发性抽动症模型小鼠抽动行为及纹状体内氨基酸递质的影响[J].中华行为医学与脑科学杂志,2013,22(8):700-703.
[3] LUNETTA C,SERAFINI M,PRELLE A,et al.Impaired expression of insulin-like growth factor-1 system in skeletal muscle of amyotrophic lateral sclerosis patients[J].Muscle Nerve,2012,45(2):200-208.
[4] 李文斌,龚亮.胰岛素样生长因子-1对幼年大鼠癫痫持续状态的神经保护作用的研究[J].中国现代医学杂志,2015,25(22):28-33.
[5] 秦贺玉,姚宝珍.血清胰岛素样生长因子 1水平与多发性抽动症患儿的关系[J].中国综合临床,2015,31(2):1145-1148.
[6] KHAN H A,ALHOMIDA A S,ARIF I A.Neurovestibular toxicities of acrylonitrile and iminodipropionitrile in rats:a comparative evaluation of putative mechanisms and target sites[J].Toxicol Sci,2009,109(1):124-131.
[7] MÜLLER-VAHL K R,CATH D C,CAVANNA A E,et al.European clinical guidelines for Tourette syndrome and other tic disorders.Part IV:deep brain stimulation[J].Eur Child Adolesc Psychiatry,2011,20(4):209-217.
[8] WANG S,QI F,LI J,et al.Effects of Chinese herbal medicine Ningdong Granule on regulating dopamine(DA)/serotonin(5-TH) and gamma-amino butyric acid(GABA) in patients with Tourette syndrome [J].Biosci Trends,2012,6(4):212-218.
[9] OKI K,LAW T D,LOUCKS A B,et al.The effects of testosterone and insulin-like growth factor 1 on motor system form and function [J].Exp Gerontol,2015,64:81-86.
[10]吴亚平,郭新跃,张婧婧,等.重组人生长激素治疗糖尿病足对血浆胰岛素样生长因子-1及胰岛素样生长因子结合蛋白-3水平的影响[J].现代医学,2017,45(10):1489-1492.
[11]BILIC E,RUDAN I,KUSEC V,et al.Comparison of the growth hormone,IGF-1 and insulin in cerebrospinal fluid and serum between patients with motor neuron disease and healthy controls[J].Eur J Neurol,2006,13(12):1340-1345.
[12]黄嵘,王翀.帕金森病患者血清一氧化氮,胰岛素样生长因子 1 及 S-100B 蛋白水平关系的研究[J].疑难病杂志,2014,13(1):40-41.
[13]贺荣霓,谢惠芳,刘振华,等.JAK/STAT 信号转导通路在 IGF-1 抑制左旋多巴诱导的多巴胺能神经元凋亡中的作用[J].中华神经医学杂志,2011,10(5):475-479.
[14]MARSHALL J,DOLAN B M,GARCIA E P,et al.Calcium channel and NMDA receptor activities differentially regulate nuclear C/EBPβ levels to control neuronal survival[J].Neuron,2003,39(4):625-639.
[15]KANG B P,URBONAS A,BADDOO A,et al.IGF-1 inhibits the mitochondrial apoptosis program in mesangial cells exposed to high glucose[J].Am J Physiol Renal Physiol,2003,285(5):F1013-F1024.
[16]陈琪,步仰高,王杨,等.IGF-1 对缺氧缺血性脑损伤新生小鼠脑细胞线粒体 Cyt-C,caspase-3 表达的影响[J].安徽医科大学学报,2014,49(10):1422-1427.
