ICG纳米探针在早期结肠癌诊断中的应用及其价值
2018-06-27刘志超屈亚威刘海峰
刘志超,屈亚威,刘海峰
结肠癌(colon cancer,CC)是常见的消化系统恶性肿瘤之一,近年来结直肠癌新增和死亡率已跃升至国内全部癌症中的第五位[1]。目前,结肠癌及癌前病变的临床早期诊断主要依靠消化道内镜检查和活检病理诊断,由于多数早癌形态结构变化不明显且病变活检定位随机性高,因此传统的早期诊断方法存在准确性低、灵敏度低、漏诊率高的不足。随着荧光分子成像(fluorescence molecular imaging,FLI)技术的快速发展,使得内镜下分子成像辅助诊断成为消化道肿瘤早期诊断、筛查研究的热点,此方法不仅漏诊率低,还能够对肿瘤进行精准的靶向治疗[2],因此有望成为早期结肠癌诊断的新手段。本研究旨在探讨利用组织穿透性较高的近红外[3]荧光染料吲哚菁绿(indocyanine green,ICG)标记人血清白蛋白(human serum albumin,HSA)的纳米探针HSA-ICG,在结肠癌分子成像中的靶向性和荧光效应,为研发应用于实际临床诊断与治疗的结肠癌荧光分子探针打下基础。
1 材料与方法
1.1 材料 活体荧光成像仪(IVIS,Xenogen公司);980 nm近红外激光器,购自长春市海洋光电有限公司;Cell DMEM培养基、胎牛血清、胰蛋白酶均购自GiBCO公司。结肠癌细胞HCT116(军事科学院军事医学研究院);BALB/C裸鼠,SPF级,雌性,4~6周龄,18~22 g,饲养于无菌独立通风笼盒中,小鼠饲养房室内温度保持在 25 ℃左右,空气相对湿度保持在40%~70%,用专门为小鼠配制的消毒饲料、纯净水饲喂。每3天更换垫料、食物和水。
1.2 方法
1.2.1 细胞培养 将HCT116结肠癌细胞接种于提前配置好的细胞培养液中,置于培养箱,37 ℃,5% CO2培养24~48 h,观察细胞贴壁情况,贴壁达70%~80%后,倒掉培养液,放入25 ml的培养瓶中,向培养瓶中加入2~3 ml胰蛋白酶,充分混匀,边消化边取少量细胞悬液在倒置显微镜下观察,当镜下细胞收回突起变圆或细胞间隙增大时停止消化。吸出消化液,加入少量细胞培养液,反复吹打使细胞脱壁形成悬液。将悬液倒入离心管,再离心1000 r/min,5 min,离心后,倒掉上清液,加入少量DMEM培养液重悬。根据细胞数量进行1∶2-1∶3传代,将细胞悬液倒入松瓶口置于培养箱(37 ℃,5% CO2)。
1.2.2 建立裸鼠结肠癌皮下移植瘤模型 用2.5 g/L的胰酶消化处于生长期的HCT116细胞,离心(1000 r/min,5 min),加入PBS缓冲液形成重悬液,通过细胞计数得到细胞数为 2×107/ml。使用75%乙醇消毒裸鼠右侧肩部部位,皮下注射0.2 ml细胞悬液,待肿瘤长至0.8~1.0 cm时备用,定期更换小鼠垫料及食物、水。
1.2.3 裸鼠结肠癌皮下移植瘤活体荧光分子成像
1.2.3.1 FolateRsenseTM680探针的FLI 根据特异性荧光分子探针及免疫组化的相关文献报道[4,5],本实验选用叶酸受体α[6,7](Folate receptor,FRα)作为目标靶点,并选择其相对应的商业化特异性荧光分子探针FolateRsenseTM680,对裸鼠HCT116皮下移植瘤模型进行荧光分子成像。
在IVC笼盒中随机选取3只成功构建HCT116结肠癌皮下肿瘤模型的裸鼠,注射探针前吸入异氟烷麻醉后均经尾静脉注射100 μl的FolateRsenseTM680,并于注射前、注射后1、3、7、24、48 h使用IVIS进行FLI。用IVIS Spectrum系统分析,ROI为以成肿瘤部位为中心,直径为10 mm的圆形区域,测量各时间点ROI的平均荧光信号强度。
1.2.3.2 注射HSA-ICG纳米探针的裸鼠FLI 随机选取同一批建模成功的3只裸鼠,尾静脉注射相应HSA-ICG探针200 μg/200 μl。并于注射前、注射后1、3、7、24、48 h使用IVIS进行FLI。探针注射后同样进行FLI。用IVIS Spectrum系统分析,ROI为以成肿瘤部位为中心,直径为10 mm的圆形区域,测量各时间点的ROI平均荧光信号强度。
1.2.3.3 注射ICG探针的裸鼠FLI 随机选取同一批建模成功的3只裸鼠,尾静脉注射相应ICG探针200 μg/200 μl。并于注射前、注射后1、3、7、24、48 h使用IVIS进行FLI。探针注射后同样进行FLI。用IVIS Spectrum系统分析,ROI为以成肿瘤部位为中心,直径为10 mm的圆形区域,测量各时间点ROI的平均荧光信号强度。
2 结 果
两种探针注射后分别进行FLI,结果显示与对照探针ICG相比,商用的荧光探针及构建的HSA-ICG纳米探针在裸鼠结肠癌皮下移植瘤模型中均有较强的荧光信号,且信噪比好。FolateRsenseTM680及HSA-ICG在裸鼠肝癌皮下移植瘤模型中浓聚高峰时间分别为1 h及24 h(图1、2、3),且平均荧光信号均比ICG强。而作为对照的ICG主要在肝脏部位聚集,故肝脏信号特别强,肿瘤部位无特别明显的肿瘤聚集(图4)。ICG主要通过肝脏代谢排出体外,故ICG在肝脏部位聚集最多。说明HSA-ICG能够达到结肠癌肿瘤荧光标记诊断作用。
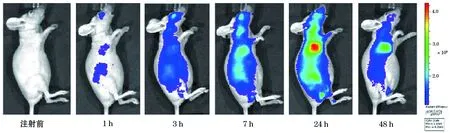
图1 注射HSA-ICG后结肠癌裸鼠移植瘤模型活体FLI图
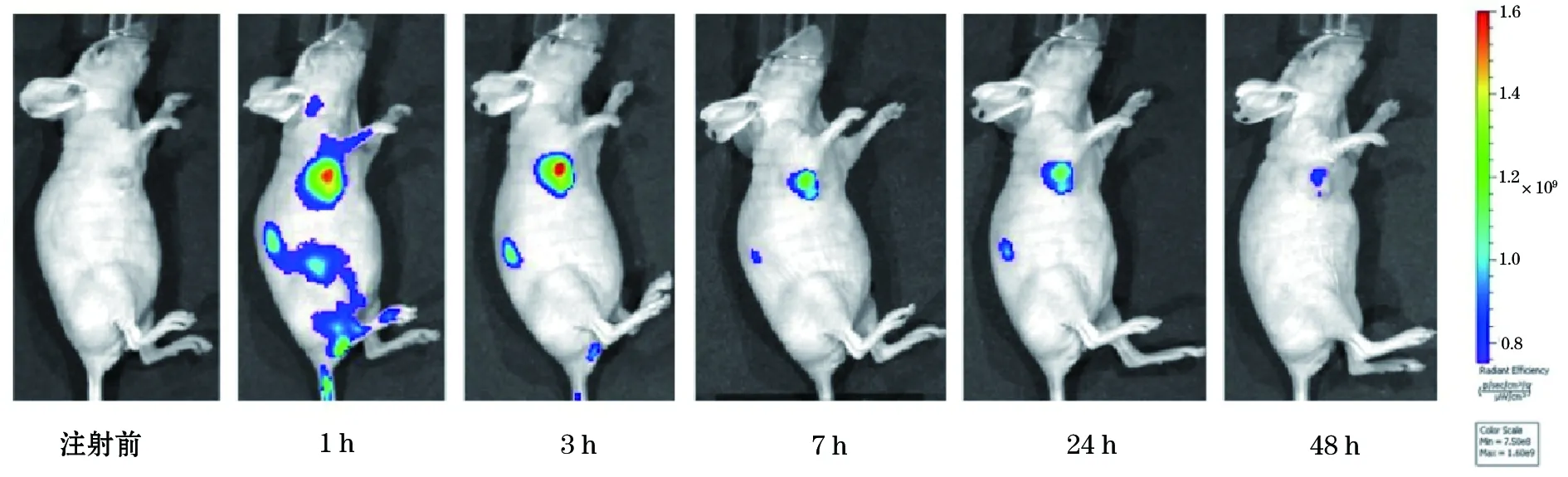
图2 注射FolateRsenseTM680后结肠癌裸鼠移植瘤模型活体FLI图
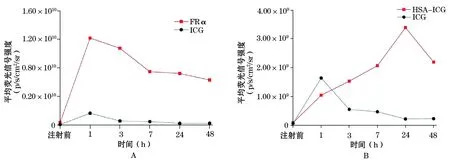
图3 结肠癌裸鼠两种特异性荧光探针与ICG对照的平均荧光信号强度随时间变化图
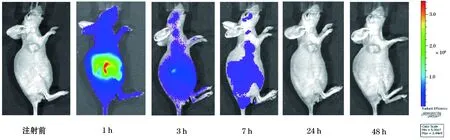
图4 注射ICG后结肠癌裸鼠移植瘤模型活体FLI图
3 讨 论
早期结肠癌手术后5年存活率高达90%,而晚期存活率仅为17%[8],可见,早诊断、早治疗可大幅度提高消化道肿瘤患者的生存质量和存活率。为实现临床肿瘤的早期、精准诊断,进一步降低肿瘤患者的病死率,结合纳米医学与分子影像技术的早期微创诊断技术已成为临床研究探索的热门方向之一。
纳米荧光探针主要有无机纳米探针和有机纳米探针两类[9],目前研究较多的无机纳米探针材料主要有纳米金、荧光纳米碳、发光量子点、磁性纳米颗粒及硫化铜等[10-12],但大多无机材料并不是生物体内天然存在的物质,降解和代谢相对较难,限制了其在临床中的应用[13,14]。常见的有机纳米探针材料主要是有机近红外染料[15]、卟啉脂质体[16]和高分子聚合物及循环肿瘤细胞、基质金属酶、单克隆抗体等[17-19]。有机纳米材料细胞毒性低、生物安全性好,其中近红外染料可随尿液排出体外;聚苯胺、聚吡咯等有机探针虽然不易降解,但也不会溶解并释放出有毒元素[20]。余祖红等[21]将肿瘤的标志物基质金属蛋白酶[22](MMPs)与荧光材料偶联制备成MMP-2/9探针,该探针对结肠癌细胞的检测率高达95%以上,充分证明了聚合物探针具有较强的特异性、灵敏度。有机纳米探针具有良好的应用前景,但仍需要解决一些问题如成像深度浅、稳定性差、易受自体荧光干扰、潜在毒性研究不透彻等。
目前,既能保证人体安全,又能用于肿瘤的早期诊断、治疗而被批准用于临床的近红外成像试剂只有吲哚菁绿(ICG)[23,24]。ICG具有两亲性结构、近红外吸收特性和发射荧光特性,既能溶于水又能溶于油脂,可在深层组织中吸收近红外光,易于标记和跟踪,但ICG本身具有稳定性不高、浓度聚集、体内的清除快及靶向性差等缺点。为避免ICG在体内的分解和清除,提高探针的稳定性和靶向性,利用蛋白质的生物相容性强、表面的活性基团便于功能性修饰、可与某些近红外光谱染料产生共价或非共价相互作用的特性[25],笔者以蛋白质为载体,将ICG制备成聚合物近红外荧光纳米探针,通过分子影像技术靶向标记肿瘤。
HSA是一种生物内源性蛋白质,无毒、无免疫原性,可与许多外源性物质有机结合,是探针颗粒和靶向药物的理想载体。本研究对实验裸鼠结肠癌皮下移植瘤模型分别尾静脉注射HSA-ICG、FolateRsenseTM680、ICG,结果表明,商用的荧光探针及HSA-ICG纳米探针在裸鼠结肠癌皮下移植瘤模型中均有较强的荧光信号,且信噪比好。FolateRsenseTM680及HSA-ICG在裸鼠肝癌皮下移植瘤模型中浓聚高峰时间分别为1 h及24 h。将ICG进行HSA的修饰后并进行纳米颗粒化,能将ICG的粒径变小,使其通过肿瘤时产生EPR效应,从而在肿瘤部位实现特异性聚集,产生肿瘤靶向性。故本实验证明了HSA-ICG纳米探针对结肠癌的靶向性与商用的FolateRsenseTM680相当,具有很好的光学检测结肠癌肿瘤的能力。
HSA-ICG诊断原理简单成熟、质量可控、安全高效,为结肠癌的早期诊断提供了新的思路,但真正应用于临床还需进一步分析其在生物组织细胞、脏器层面及整个机体之间的运行机制和潜在毒性。由于临床对肿瘤诊断与治疗的期望值越来越高,纳米探针在结肠癌早期诊断的应用正在不断走向完善,随着纳米技术的迅猛发展,将来还会有更多、更加稳定、更加安全有效的纳米探针应用于肿瘤的临床诊断,甚至可能研发出集药物传输、控释,靶向标记、跟踪为一体的多功能诊疗一体化探针。
【参考文献】
[1] Chen W,Zheng R,Baade P D,etal.Cancer Statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Li M,Wang T D. Targeted endoscopic imaging[J]. Gastrointest Endosc Clin N Am,2009,19(2):283-298.
[3] Goetz M,Wang T D. Molecular imaging in gastrointestinal endoscopy [J].Gastroenterology,2010,138(3):828-833.
[4] Gonda T A,Kim Y I,Salas M C,etal. Folic acid increases global dna methylation and reduces inflammation to prevent helicobacter-associated gastric cancer in mice[J]. Gastroenterology,2012,142: 824-833.
[5] Kubben F J,Sier C F,Van DuiJin W,etal. Matrix metalloproteinase-2 is a consistent prognostic factor in gastric cancer[J]. Br J Cancer,2006,94: 1035-1040.
[6] Zheng M,Zhao P,Luo Z,etal. Robust ICG theranostic nanoparticles for folate targeted cancer imaging and highly effective photothermal therapy[J]. Acs Appl Master Interfaces,2014,6: 6709-6716.
[7] Lee H,Kim J,Choi Y,etal. A folate receptor-specific activatable probe for near-infrared fluorescence imaging of ovarian cancer[J]. Chem Commun (Camb), 2014,50: 7507-7510.
[8] Siegel R,DeSantis C,Virgo K,etal. Cancer treatment and survivorship statistics 2012[J]. CA Cancer J Clin,2012, (62): 220-241.
[9] 陈静文,王 悍.纳米材料在肿瘤光热治疗中的研究进展[J].中华生物医学工程杂志, 2015,13(4):369-372.
[10] Dreaden E C,Alkilany A M,Huang X,etal. The golden age: gold nanoparticles for biomedicine[J]. Chem Soc Rev, 2012,41(7):2740-2779.
[11] Bartelmess J,Quinn S J,Giordani S. Carbon nanomaterials: multi-functional agents for biomedical fluorescence and Raman imaging[J]. Chem Soc Rev, 2015, 44(14): 4672-4698.
[12] Guo C,Yin S,Yan M,etal. Morphology-controlled synthesis of nanostructures and their near-infrared absorption properties[J].Inorg Chem, 2012,51(8):4763-4771.
[13] Zhu M,Nie G,Meng H,etal. Physicochemical properties determine nanomaterial cellular uptake, transport, and fate[J].Acc Chem Res, 2013,46(3):622-631.
[14] Nystrom A M,Fadeel B. Safety assessment of nanomaterials:implications for nanomedicine[J]. J Control Release, 2012,161(2):403-408.
[15] Yuan A,Wu J,Tang X,etal. Application of near-infrared dyes for tumor imaging, photothermal, and photodynamic therapies [J]. J Pharmaceutical Sci, 2013,102 (1): 6-28.
[16] Muhanna N,Jin C S,Huynh E,etal. Phototheranostic porphyrin nanoparticles enable visualization and targeted treatment of head and neck cancer in clinically relevant models [J]. Theranostics, 2015, 5 (12): 1428-1443.
[17] Yan L,Qiu L. Indocyanine green targeted micelles with improved stability for near-infrared image-guided photothermal tumor therapy[J]. Nanomedicine (Lond), 2015,10(3):361-373.
[18] Yang K,Xu H,Cheng L,etal. In vitro and in vivo near-infrared photothermal therapy of cancer using polypyrrole organic nanoparticles[J]. Adv Mater, 2012,24(41):5586-5592.
[19] Zheng C,Zheng M, Gong P,etal. Indocyanine green-loaded biodegradable tumor targeting nanoprobes for in vitro and in vivo imaging[J]. Biomaterials,2012, 33 (22):5603-5609.
[20] 詹求强,张 欣,李 心,等. 几种先进的光学纳米探针在光学生物诊疗中的应用[J].激光生物学报,2015,24(3):207-219.
[21] 余祖红,栾富娟,冷 霞,等.基质金属蛋白酶MMP-2/9分子探针对临床结肠癌组织的检测[J].科学通报,2018,63(3):318-326.
[22] Dai Z F. Applications,opportunities and challenges of molecular probes in the diagnosis and treatment of major diseases (in Chinese) [J].Chin Sci Bull,2017,1:25-35.
[23] Zheng M B,Gong P, Jia D X,etal. PLGA-Lecithin-PEG core-shell nanoparticles for cancer targeted therapy[J]. Nano Life, 2012,2(1):1250-1252.
[24] Kim T H,Chen Y,Mount C W,etal. Evaluation of temperature-sensitive, indocyanine green-encapsulating micelles for noninvasive near-infrared tumor imaging[J]. Pharm Res, 2010, 27(9):1900-1913.
[25] Yu J,Javier D,Yaseen M A,etal. Self-assembly synthesis, tumor cell targeting, and photothermal capabilities of antibody-coated indocyanine green nanocapsules [J]. J Am Chem Soc,2010,132 (6): 1929-1938.
