颈动脉内膜切除术围术期安全性分析
2018-06-27朱凯强郭克勤李中林
张 贺,朱凯强,郭克勤,李中林
脑卒中是我国人群主要的死亡原因。我国目前每年新发脑卒中患者达240万人,每年因卒中死亡的人数为110万,现存脑卒中患者1100多万[1]。脑卒中患者中颈动脉狭窄的发生率较高,在不同人群,引起缺血性卒中的原因中颅外段颈内动脉狭窄占15%~20%,而且卒中的风险与狭窄程度呈正相关[2]。颈动脉内膜切除术是颅外段颈动脉狭窄的有效干预措施。自1953年DeBakey首次报道成功实施第1例颈动脉内膜切除术(carotid endarterectomy,CEA)以来,颈动脉内膜切除术被广泛用于治疗颈动脉狭窄性疾病,其疗效也得到了广泛证实。虽然目前CEA已非常成熟,但仍可能导致术后神经功能损伤、脑出血等致残性并发症,同时,影响CEA围术期卒中或死亡风险的危险因素仍存在争议。为此,笔者通过对CEA围术期安全性进行回顾性分析,旨在对临床诊治有一定的借鉴作用。
1 对象与方法
1.1 对象 选取2014-01至2017-11我院脑血管外科收治的颈动脉狭窄行CEA治疗的患者128例。入选标准:符合手术指征的颈动脉狭窄率>70%的无症状患者;颈动脉狭窄率>50%症状性患者。排除标准:(1)神经功能不稳定,大面积脑梗死急性期;(2)有严重冠心病或其他器质性病不能耐受手术者;(3)有麻醉禁忌证;(4)颈动脉高位狭窄,范围超过下颌角;(5)失访患者。
1.2 方法
1.2.1 术前准备 对128例术前血压、血糖水平控制在可接受的范围(血压<140/90 mmHg,血糖<8.0 mmol/L),对吸烟者劝导戒烟。所有手术均采用全身麻醉。
1.2.2 手术方法 术中取仰卧位,胸锁乳突肌前缘切口,逐层分离皮下组织、颈阔肌、胸锁乳突肌和深部结缔组织,放置自动牵开器暴露颈动脉鞘。外周静脉注射肝素5000 U或按85 U/kg进行全身肝素化,升高血压,保持收缩压升至基础血压的130%,依次阻断颈内动脉、颈总动脉和颈外动脉。移入手术显微镜,切开颈动脉,剥除斑块,用25 000 U/L的肝素生理盐水反复冲洗血管腔,显微镜下仔细剥除血管腔表面漂浮的内膜残片,修整远端内膜直至移行部平整光滑。以6-0 Prolene缝线连续缝合血管壁,降低收缩压至110~130 mmHg,依次开放颈外动脉、颈总动脉、颈内动脉,彻底止血。冲洗切口,检查无活动性出血,放置一根引流管,逐层缝合切口。术后复查CT、CTA,围术期严格控制血压、血糖,予标准抗血小板治疗[氯吡格雷和(或)阿司匹林]。
1.3 监测指标 (1)术前一般资料:年龄、性别、高血压、糖尿病、对侧颈动脉狭窄(>50%)、吸烟史、症状、手术部位;(2)围术期死亡和脑卒中(包括脑出血和脑梗死)发生率。根据NASCET标准,CEA围术期定义为术后30 d内,脑卒中以症状判断为主[2]。参照NASCET标准,症状性颈动脉狭窄定义为近6个月内出现卒中或短暂性脑缺血发作(transient ischemic attack,TIA)[2]。

2 结 果
2.1 一般情况 128例中,121例行单侧手术,7例分期行双侧手术,共计手术135次。以下每次手术按1个单独病例计算。男99例(73.3%),女29例(26.7%)。年龄43~81岁,平均(64.8±8.3)岁,年龄≥70岁者41例(30.4%)。合并高血压者95例(70.4%),合并糖尿病者43例(31.9%),合并对侧狭窄(>50%)者42例(31.1%),有吸烟史者60例(44.4%),症状性颈动脉狭窄114例(84.4%)。其中67例为近期(6个月内)发生过脑梗死,47例为近期(6个月内)有TIA,左侧手术69例(51.1%)。
2.2 围术期主要并发症 围术期(术后30 d内)死亡2例,病死率1.5%,卒中4例,卒中发生率为3.0%。2例死亡者中,1例死于急性心肌梗死,1例死于大面积脑梗死。4例出现脑卒中,其中1例经颅脑MR证实为小范围脑梗死,颈动脉CTA显示术侧颈动脉充盈良好;1例经颅脑MR证实为同侧大脑半球的大面积脑梗死,经CTA证实为术侧颈动脉急性闭塞,经治疗好转;另2例经颅脑CT证实分别为高灌注脑出血和术前脑梗死灶的梗死后出血转化。围术期死亡和卒中发生率为4.4%,其中症状性颈动脉狭窄患者为5.3%,无症状患者为0。
2.3 单因素分析 年龄≥70岁组与<70岁组、女性组与男性组、高血压组与非高血压组、糖尿病组与非糖尿病组、单侧颈动脉狭窄组与双侧颈动脉狭窄组、吸烟史组与无吸烟史组、症状组与无症状组、左侧手术组与右侧手术组患者围术期死亡和卒中的发生率,差异均无统计学意义(均P>0.05,表1)。
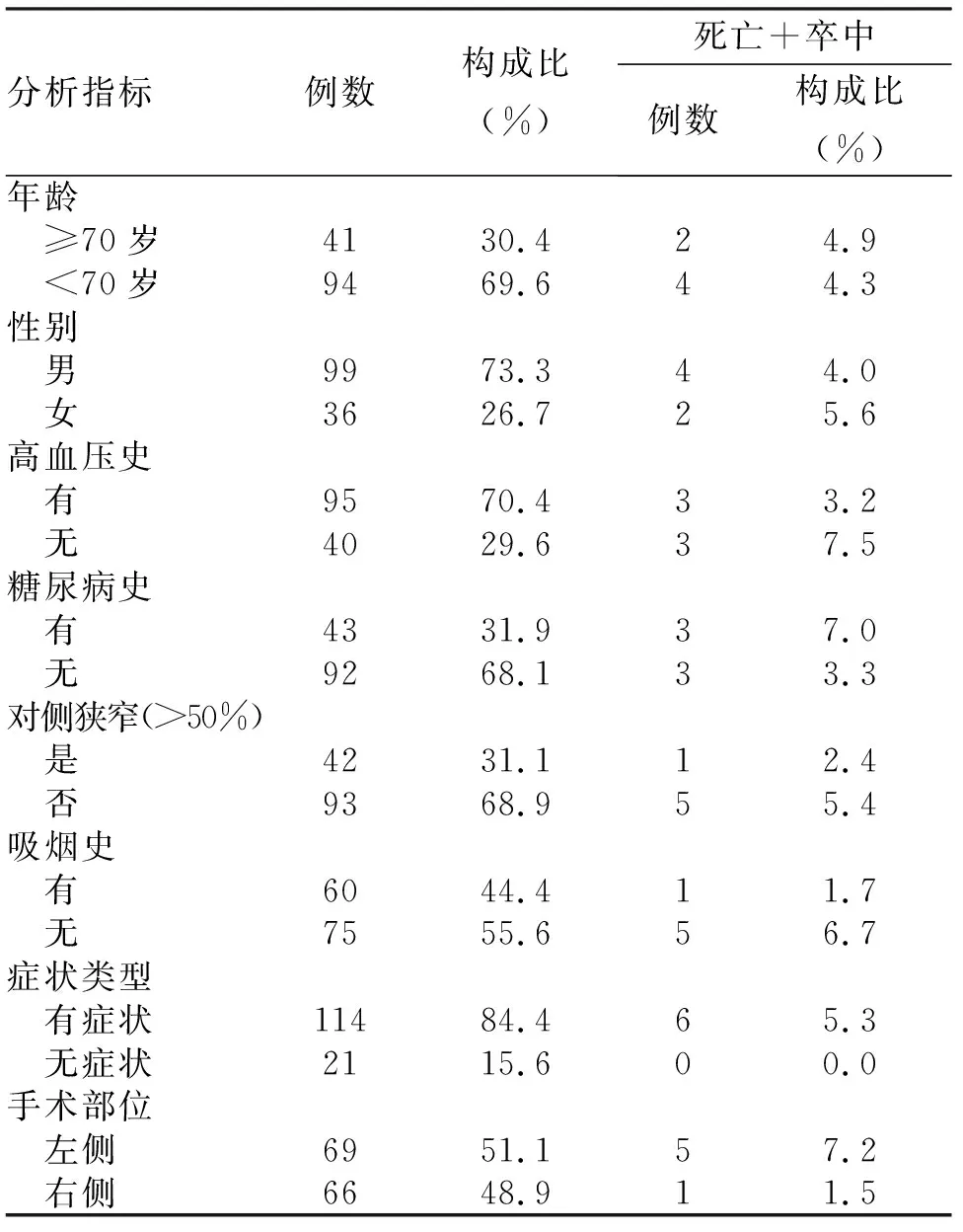
表1 颅动脉内膜切除术围术期死亡和脑卒中的单因素分析
3 讨 论
自20世纪90年代开始,欧美国家进行了多项关于颈动脉内膜切除术疗效的前瞻性临床研究,这些研究结果已得到了广泛的认可:与药物治疗相比, CEA已被证明是预防缺血性脑卒中的一个更有效的治疗方法,且围术期(术后30 d)的卒中和死亡风险可控制在较低水平[2,3]。围术期风险是决定患者是否适合行CEA的重要因素。最新的美国心脏协会/美国卒中协会(AHA/ASA)指南推荐:对于近期(6个月内)发生同侧TIA或缺血性卒中的颈动脉严重狭窄(70%~99%)患者,预计围术期的卒中和病死率<6%,建议行CEA;对于近期发生同侧TIA或缺血性卒中的颈动脉狭窄率在50%~69%者,预计围术期的卒中和病死率<6%,建议根据患者的年龄、性别和合并症等具体因素决定是否行CEA[4]。对于狭窄率>70%的无症状性颈动脉狭窄患者,预计围术期死亡、心肌梗死和卒中的风险<3%,建议行CEA[5]。本研究结果显示,症状性颈动脉狭窄患者围术期(术后30 d内)死亡和和卒中发生率为5.3%,无症状患者为0,符合指南要求,表明CEA是一种安全的干预措施。
高血压是颈动脉粥样硬化的危险因素[6],也是CEA围术期常见的并发症,围术期血流动力学不稳定与患者术后不良结局相关,严格控制血压是预防术后脑出血和其他并发症的最重要的措施[7]。本研究对合并高血压的患者术前口服降压药控制血压至<140/90 mmHg,术后实行严格的血压控制(根据患者基础血压、颈动脉狭窄程度等综合因素制定个体化血压控制目标),结果显示高血压组与非高血压组患者围术期死亡和卒中发生率无统计学差异。文献[8,9]的研究结果也表明,合并高血压不会明显增加CEA围术期发生死亡和卒中的风险。由此可见,良好的血压控制是手术成功的关键。
赵克强等[10]发现,在CEA围术期对血糖进行严格管理的前提下,糖尿病不会增加围术期发生脑卒中和死亡的风险。此外,将血糖控制接近正常水平(糖化血红蛋白<7%)还可以降低糖尿病微血管并发症和心血管并发症风险[11]。本研究将患者围术期血糖控制在<8.0 mmol/L,结果也显示糖尿病组与非糖尿病组围术期卒中和死亡的发生率无统计学差异,这提示在严格控制血糖前提下对合并糖尿病者行CEA同样是安全的。
对于不同性别间CEA手术围术期卒中和死亡发生率是否有差异,国外学者进行了大量研究。Guzman等研究成果表明,女性和男性患者CEA术后发生并发症的风险并无明显差异[12]。但Stoberock等研究表明女性患者围术期死亡和卒中风险高于男性[13]。本研究结果显示女性患者术后死亡和卒中发生率高于男性(6.3%比2.3%),但这种差异并无统计学意义,可能与本研究中女性样本量偏小有关。这种不同性别死亡和卒中的发生率是否存在种族差异,有待进一步地研究。
Halm等[14]对9308例CEA病例进行统计分析发现,不同年龄之间围术期死亡和卒中的发生率无统计学差异。CREST结果也显示,CEA围术期风险不随着年龄增加而明显增高[15]。本研究也表明,年龄≥70岁组和年龄<70岁组围术期死亡和卒中发生率无统计学差异,这说明虽然年龄是不可干预因素,但并不明显增加CEA围术期风险。
然而,随着20世纪90年代颈动脉支架置入术(carotid stenting,CAS)的兴起,因CAS以其狭窄部位不受限制、手术时间短、创伤小和恢复快等优势迅速发展,被认为是CEA 手术高危人群的一种理想的可替代的治疗手段,CEA与CAS这两种干预措施的疗效及安全性比较更是目前临床研究的热点。国外的多项大型临床研究结果显示,CEA与CAS术后30 d脑卒中或死亡的发生率并无显著性差异[14]。但CREST作为目前最大的一项国际多中心随机对照临床试验,其结果显示对于70岁以下的患者CAS疗效略优于CEA,对于70岁以上的患者CEA疗效更好;CAS在围术期发生脑卒中的风险更高,而CEA在围术期发生心肌梗死的风险更高[15]。然而,CEA与CAS各有其局限性,如CEA不适用于高位颈动脉狭窄、合并严重基础疾病不能耐受手术者等,CAS不适用于严重的钙化性颈动脉斑块等。因此,CEA 目前仍然是治疗颈动脉狭窄的首选治疗方案。
综上所述,CEA是目前仍是预防脑卒中的一种安全的干预措施,其围术期死亡和卒中的风险可控制在较低水平。本研究还存在样本量较少的问题,下一步将扩大样本进行更深入地研究。
【参考文献】
[1] 孙海欣,王文志.中国脑卒中患病率、发病率和死亡率调查结果发表[J].中华神经科杂志,2017,50(5):337.
[2] North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. Nengl J Med, 1991, 325(7): 445-453.
[3] Halliday A, Harrison M, Hayter E,etal. 10-year stroke prevention after successful carotid endarterectomy for asymptomatic stenosis (ACST-1): a multicentre randomised trial[J]. The Lancet, 2010,376(9746):1074-1084.
[4] Kernan W N, Ovbiagele B, Black H R,etal. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2014, 45(7): 2160-2236.
[5] Meschia J F, Bushnell C, Boden-Albala B,etal. Guidelines for the primary prevention of stroke: A statement for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2014, 45(12): 3754-3832.
[6] 翟卫东,钟建卫,王 涛,等.高血压脑出血并发大面积脑梗死的危险因素分析[J].武警医学,2014,25(5):497-499.
[7] 叶 炜,宋小军,刘昌伟,等.颈动脉内膜切除术与围手术期高血压[J].血管与腔内血管外科杂志,2016,2(5):435-439.
[8] 刘昌伟,倪 冷,陈跃鑫,等.颈动脉内膜切除术618例经验总结及结果分析[J].中华医学杂志,2015,95(24):1897-1901.
[9] 余 翀,李毅清.颈动脉内膜切除术的预后及其危险因素的研究[J].血管与腔内血管外科杂志,2016,2(4):293-310.
[10] 赵克强,吴巍巍,赵俊来,等.颈动脉狭窄合并糖尿病患者行颈动脉内膜剥脱术的疗效分析[J].中华医学杂志,2015,95(44):3584-3587.
[11] Ricotta J J, AbuRahma A, Ascher E,etal. Updated Society for Vascular Surgery guidelines for management of extracranial carotid disease[J]. Journal of vascular surgery, 2011, 54(3): 1-31.
[12] Guzman R P, Weighell W, Guzman C,etal. Female sex does not influence 30-day stroke and mortality rates after carotid endarterectomy[J]. Annals of vascular surgery, 2014, 28(1): 245-252.
[13] Stoberock K, Debus ES, Atlihan G,etal. Gender differences in patients with carotid stenosis[J]. Vasa, 2016, 45(1): 11-6.
[14] Halm E A, Tuhrim S, Wang J J,etal. Risk factors for perioperative death and stroke after carotid endarterectomy[J]. Stroke, 2009, 40(1): 221-229.
[15] Mantese V A, Timaran C H, Chiu D,etal. The carotid revascularization endarterectomy versus stenting trial (CREST)[J]. Stroke, 2010, 41(10): S31-S34.
