抗菌肽VIP在毕赤酵母中的高效表达及鉴定
2018-06-26乔想金李文新白丽娟胡巍南怀燕
乔想金,李文新,白丽娟,胡巍,南怀燕
1 兰州兰石能源装备工程研究院 生物制造工程技术中心,甘肃 兰州 730300
2 中国科学院西北生态环境研究院,甘肃 兰州 730000
抗菌肽是一类具有天然抗菌活性的小肽,最初是从昆虫血淋巴细胞中发现的[1]。自瑞典科学家Boman等从天蚕蛹中发现第一个抗菌肽后,科学家相继从细菌、真菌、高等植物、高等动物中发现并分离得到了具有类似天然抗菌活性的小肽类[2]。到目前为止发现的抗菌肽有1 000多种[2-3]。过去的几十年中,人们发现大量使用传统抗生素容易诱导耐药性菌株的产生,从而导致治疗同种感染时抗生素的使用量越来越多[4-6],陷入一种恶性循环模式。因此,开发不具有诱导耐药性菌株产生的新型抗生素极为迫切。
大多数抗菌肽都带有正电荷,具有正电性和两亲性分子的特征[7-8]。其杀菌机制主要是通过直接破坏生物膜或与细胞内大分子相互作用而抑杀细菌,从而不会诱导产生耐药菌株[2,8]。抗菌肽具有广谱的抗菌活性,对革兰氏阳性菌和革兰氏阴性菌都有一定的抗性,被认为是最具有开发新型抗生素药物的肽类物质[9-10]。目前,国外有一些抗菌肽药物已经应用于临床[11-13]。抗菌肽VIP是有机体内广泛分布的具有抗菌活性的小肽,对细菌和真菌都有很好的抗菌活性[14]。VIP的天然产量很低,化学合成成本相当昂贵,这是其开发利用过程中的关键瓶颈[15]。因此,通过基因工程方法高效生产VIP具有很好的前景。
抗菌肽 VIP对细菌有很强的抑杀作用,因此不能在原核表达系统中直接表达。本实验室曾将人抗菌肽VIP与用硫氧还蛋白串联,用pET32a在大肠杆菌中融合表达,但是由于需要切除融合标签和破碎菌体,成本还是相对较高,不太理想。毕赤酵母具有可以直接分泌表达蛋白和折叠修饰的优势,是目前分泌表达外源蛋白最理想的表达系统之一[16]。VIP对真核生物几乎没有毒性[14],因此,我们尝试采用毕赤酵母表达系统直接分泌表达 VIP,从而省略切割标签和破碎菌体的繁琐步骤,以期VIP高效表达,降低生产成本。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
毕赤酵母 GS115、表达质粒 pPICZαA、NCM460和IPEC-J2由西北工业大学生命学院生物化学实验室惠赠;大肠杆菌Escherichia coliDH5α、E. coliATCC25922、金黄色葡萄球菌S. aureusATCC25923均由本实验室保存。
1.1.2 试剂耗材
限制性内切酶XhoⅠ、XbaⅠ及T4 DNA连接酶购自TaKaRa公司;PCR试剂盒、PCR产物纯化试剂盒、小量质粒提取试剂盒和DNA胶回收试剂盒购自天庚生物科技有限公司;博来霉素、DNA Marker、蛋白Marker购自BBI生命科学有限公司。
1.2 方法
1.2.1 VIP目的基因的克隆
VIP氨基酸序列为:HSDAVFTDNYTRLRKQ MAVKKYLNSILN。根据毕赤酵母密码子偏好性,优化获得VIP核苷酸序列:CACAGCGACGCCGT ATTCACAGATAACTACACCAGACTAAGAAAA CAAATGGCCGTAAAAAAGTACCTAAACAGCA TCCTAAAC,在序列两端添加XhoⅠ和XbaⅠ限制性内切酶酶切位点和保护碱基,限制性内切酶XhoⅠ和基因序列之间添加Kex2酶切位点,基因序列末端添加终止密码子TAA,引物序列设计见表1。
其中,所述引物序列P1和引物序列P2中的方框分别表示XhoⅠ和XbaⅠ酶切位点,使用套叠PCR (Splice overlap extension PCR,SOE-PCR)扩增vip基因,反应条件如下:94 ℃变性5 min;94 ℃ 30 s,60 ℃ 40 s,72 ℃ 1 min,进行 35 个循环;72 ℃延伸 5 min。将 PCR产物和克隆载体质粒PUC19同时用限制性内切酶XhoⅠ和XbaⅠ进行双酶切,用T4 DNA连接酶进行连接,转化DH5α感受态细胞,涂布氨苄抗性 LB固体平板,挑取5个单克隆,用小量质粒提取试剂盒抽提质粒,送往生工生物工程 (上海) 股份有限公司测序。
1.2.2 表达载体的构建
将SOE-PCR扩增的目的基因与pPICZαA质粒用限制性内切酶XhoⅠ和XbaⅠ同时进行双酶切,用DNA胶回收试剂盒对基因和质粒片段进行回收,用T4 DNA连接酶于16 ℃连接过夜。将连接混合液转化DH5α感受态细胞,37 ℃摇床孵育60 min,取100 μL转化菌液涂布固体LB培养基(含 20 μg/mL 博来霉素),37 ℃培养 18 h。挑取单克隆,双酶切和基因测序鉴定正确后进行下一步实验。

表1 引物序列Table 1 Primers used in this study
1.2.3 重组质粒的转化与鉴定
制备毕赤酵母GS115感受态细胞,具体过程如下:从超低温冰箱取出 GS115菌种,接种于YPD固体平板上,30 ℃培养30 h;挑取单克隆接种于10 mL YPD液体培养基,30 ℃培养过夜;取500 μL过夜培养的菌液接种于50 mL YPD液体培养基,30 ℃培养至OD600为0.8–1.2时离心,收集菌体;用冰水浴预冷的超纯水洗涤3次;用山梨醇缓冲液洗涤一次,用1 mL山梨醇缓冲液重悬,每100 μL分装到1.5 mL离心管中,以备电转。
取 50 μL重组质粒 pPICZαA-vip,用限制性内切酶SacⅠ进行线性化,用琼脂糖凝胶电泳进行鉴定并回收,胶回收的最后一步用超纯水进行洗脱,以保证较低的离子强度以便电转。取 10 μL线性化回收的质粒片段,加入到GS115感受态细胞中,迅速吹打均匀后置冰上10 min;将感受态细胞和质粒混合液迅速转入2 mm预冷的电转杯中,2 500 V电击;电击完成后迅速加入800 μL YPD培养基,冰上静置10 min,放入30 ℃培养箱静置培养3 h;取300 μL菌液涂布于博来霉素抗性的YPD固体平板上,培养2 d;挑取单克隆接种于含有200 μg/mL博来霉素的YPD液体培养基上;用酵母基因组提取试剂盒提取重组酵母基因组 DNA,以 5’AOX1 和 3’AOX1 为引物,用 PCR检测目的基因在GS115中的整合情况,将验证正确的重组菌命名为GS115-PIC-vip。
1.2.4 重组质粒的诱导表达、纯化及质谱鉴定
将基因工程菌 GS115-PIC-vip接种于 50 mL YPD培养基,30 ℃摇床培养过夜。取上述过夜培养菌液,按照1∶100的比例接种于1 L新鲜YPD培养基中,待OD600值达到0.8–1.2时,6 000 r/min离心,将菌体重悬于50 mL新鲜YPM培养基进行诱导,每24 h补加甲醇5 mL,连续诱导120 h。
重组VIP的纯化:用5倍柱体积的去离子水冲洗阳离子交换柱(层析柱介质为 CM Sepharose Fast flow,柱尺寸 1.6 cm×20 cm),流速 2 mL/min;用4倍柱体积0.1 mol/L NaOH处理阳离子交换柱,流速2 mL/min;用去离子水冲洗至中性;用4倍柱体积0.1 mol/L HCl处理阳离子交换柱,流速2 mL/min;去离子水冲洗至中性;用4倍柱体积的A液(20 mmol/L磷酸盐缓冲液,pH 6.5)进行平衡,流速2 mL/min;将发酵上清液稀释5倍,用0.45 μm的滤膜进行过滤,超声脱气10 min后上样,流速1 mL/min;用磷酸缓冲液洗脱杂蛋白,直至280 nm处没有紫外吸收峰;用A液和B液(1 mol/L NaCl)进行线性梯度洗脱,收集280 nm处的紫外吸收峰。将纯化的VIP用透析袋进行脱盐处理,通过冷冻干燥仪进行浓缩,用 Bradford法测定浓缩液重组VIP的浓度,取样进行质谱鉴定,其余的浓缩液在–20 ℃保存,以便后续重组VIP溶液的稀释配制。
质谱测定的是核质比m/z,因此测定的物质分子量计算公式如下:

1.2.5 重组VIP的抑菌活性检测
用琼脂孔扩散实验对重组表达的人抗菌肽VIP从定性方面检测抗菌活性。将E. coliATCC25922和S. aureusATCC5923培养至对数期(OD600为 0.4–0.6),用平板稀释法稀释至108CFUs/mL,将其按照1%的比例接到LB固体培养基中,混匀后倒平板。等平板凝固后用打孔器进行打孔,每孔加入70 μL液体,37 ℃静置培养过夜,观察抑菌圈情况。
1.2.6 重组VIP的最小抑菌浓度(MIC)检测
从–80 ℃取出冻存的E. coliATCC25922和S. aureusATCC25923,划线接种于肉汤培养基(MH)中培养过夜;挑单克隆接种于MH液体培养基,培养过夜;将过夜培养的菌按照1∶100的比例转接到MH培养基,待OD600达到0.4–0.6时,取适量菌液,通过平板稀释法,用MH培养基稀释至 1×105–5×105CFUs/mL;取 96孔板,每孔加入100 μL菌液,再加入100 μL用MH培养基稀释好的重组VIP溶液,使VIP终浓度为2–64 μmol/L(阴性对照孔加入200 μL MH培养基;阳性对照加入 100 μL 菌液+100 μL MH 培养基);37 ℃静置培养过夜后用酶标仪测OD600值,分析纯化后的VIP对E. coliATCC25922和S. aureusATCC25923的MIC。
1.2.7 重组VIP摇瓶发酵条件优化
将过夜培养的工程菌 GS115-PIC-vip按照1∶100的比例转接,培养OD600至0.4–0.6时,设置诱导时间长度、诱导温度、甲醇诱导浓度梯度,通过检测VIP分泌的量确定实验室摇瓶最佳发酵条件。
1.2.8 VIP细胞毒性检测
将人肠上皮细胞 (NCM460) 和猪肠上皮细胞(IPEC-J2)进行活化,培养至对数期;细胞浓度稀释至 1×105个/mL,将稀释好的细胞液转接至96孔板,每孔加入 90 μL,5% CO2、37 ℃静置培养4 h;待细胞贴壁后,加入10 μL稀释好的VIP溶液(用0.22 μm的滤器过滤除菌),使VIP终浓度为 16 μmol/L;空白对照:90 μL DMEM+10 μL PBS,正常对照:90 μL 细胞悬液+10 μL PBS。培养 24 h后,每孔加入20 μL MTT溶液,继续培养4 h;吸取上清,每孔加入150 μL DMSO,振荡15 min使结晶紫充分溶解;490 nm下测吸光值。细胞存活率计算公式如下:

1.2.9 VIP溶血活性检测
取5 mL SD大鼠静脉腹腔血,在含有玻璃珠的三角瓶中轻摇 10 min;将三角瓶中的血液用0.9% NaCl稀释10倍,1 000 r/min离心收集血细胞;收集的血细胞用0.9% NaCl重悬,1 000 r/min离心,弃上清;重复上述步骤,直到上清不显红色;将所得的红细胞用0.9% NaCl配制成2%的红细胞悬液;取10个10 mL无菌离心管,每管加入2.5 mL红细胞悬液。加入0.9% NaCl和纯化的VIP溶液。使重组VIP终浓度为5、10、20、40、80 μmol/L;阴性对照:2.5 mL红细胞悬液和2.5 mL 0.9% NaCl;阳性对照:2.5 mL红细胞悬液和2.5 mL ddH2O;37 ℃静置4 h,1 000 r/min离心5 min,吸取上清在545 nm下测吸光值。红细胞溶血率计算公式:
红细胞溶血率(%)=(OD实验–OD阴性)/(OD阳性–OD阳性)×100%。
1.2.10 VIP抗菌机制检测
将培养至对数期的E. coliATCC25922和S. aureusATCC25923稀释1 000倍,加入终浓度为MIC浓度的重组VIP。37 ℃孵育2 h,3 000 r/min离心,用5%的戊二醛溶液重悬,放入4 ℃冰箱固定过夜。做包埋后切片,在 JEM-1230型透射电镜下观察细菌形态变化。
2 结果
2.1 目的基因的获取
通过SOE-PCR法,以3条引物合成vip基因序列。用1.2%的琼脂糖凝胶电泳进行检测,结果如图1所示,PCR产物片段大小与理论值 (122 bp)相一致,挑取的阳性克隆测序正确。
2.2 表达载体的构建
通过双酶切对重组质粒PIC-vip进行鉴定,结果如图 2所示。结果表明,双酶切得到的 DNA片段大小与理论值一致。进一步测序表明,目的基因已成功构建到质粒pPICZaA上。

图1 目的基因vip的扩增Fig. 1 Amplification of the target gene vip. M: DNA marker; 1: target gene.
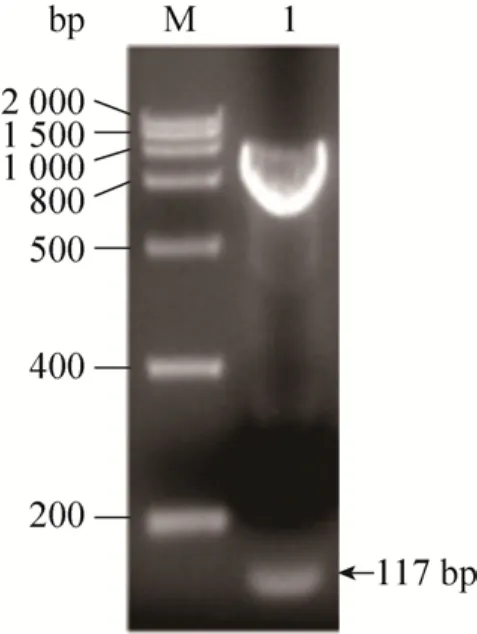
图2 双酶切鉴定重组质粒PIC-vipFig. 2 Recombinant plasmids PIC-vip were identified by double enzyme digestion. M: DNA marker; 1: target gene.
2.3 重组质粒的转化与鉴定
将重组质粒PIC-VIP通过电转化将其整合到毕赤酵母GS115中。提取毕赤酵母基因组DNA,以5’AOX1和3’AOX1为引物,进行PCR扩增。通过琼脂糖凝胶电泳检测质粒整合情况,结果如图3所示。PCR扩增条带大小与理论值 (613 bp)一致,这表明重组质粒PIC-vip已成功整合到毕赤酵母GS115中。
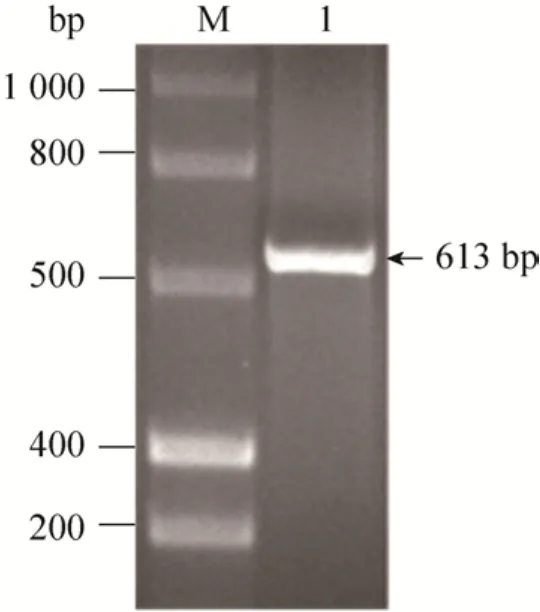
图3 全基因组扩增鉴定质粒整合Fig. 3 Plasmid integration was identified by wholegenome PCR amplification. M: DNA marker; 1: target gene.
2.4 VIP的诱导表达及质谱鉴定
转接重组菌GS115-PIC-vip,进行诱导。用阳离子交换树脂对分泌的VIP进行纯化,通过质谱进行鉴定,结果如图4所示。质谱中M+6H、M+5H、M+4H等均为同一个物质,只是所带电荷数不同。质谱测定的是核质比m/z,因此所检测物质的分子量为:555.46×6–6=3 326.76 或 666.36×5–5=3 326.80 或 832.71×4–4=3 326.84 或 1 109.93×3–3=3 326.79,根据计算结果,在误差允许的范围内,分泌表达的人抗菌肽VIP分子量与理论值 (3 326.82)一致,这表明重组菌 GS115-PIC-vip能够成功分泌表达VIP。
2.5 重组VIP抗菌活性检测
通过抑菌圈法可以从定性角度观察重组VIP是否具有抗菌活性。结果如图 5所示,对照组 YPM培养基、空质粒诱导培养上清液和纤维素酶缓冲液均没有抗菌活性,重组菌GS115-PIC-vip诱导后上清液有明显的抑菌圈出现,纯化后的VIP具有更强的抗菌活性。实验表明,分泌的VIP从定性角度具有良好的抗菌活性。下一步将通过最小抑菌浓度MIC从定量角度验证分泌的VIP抗菌活性。
2.6 重组VIP的最小抑菌浓度检测
通过测定重组VIP最小抑菌浓度MIC,从定量角度分析VIP的抗菌能力。检测结果显示,纯化后的VIP对E. coliATCC25922和S. aureusATCC25923的MIC分别为8 μmol/L和16 μmol/L,从定量角度说明重组 VIP对E. coliATCC25922和S. aureusATCC25923具有很好的抗菌活性。
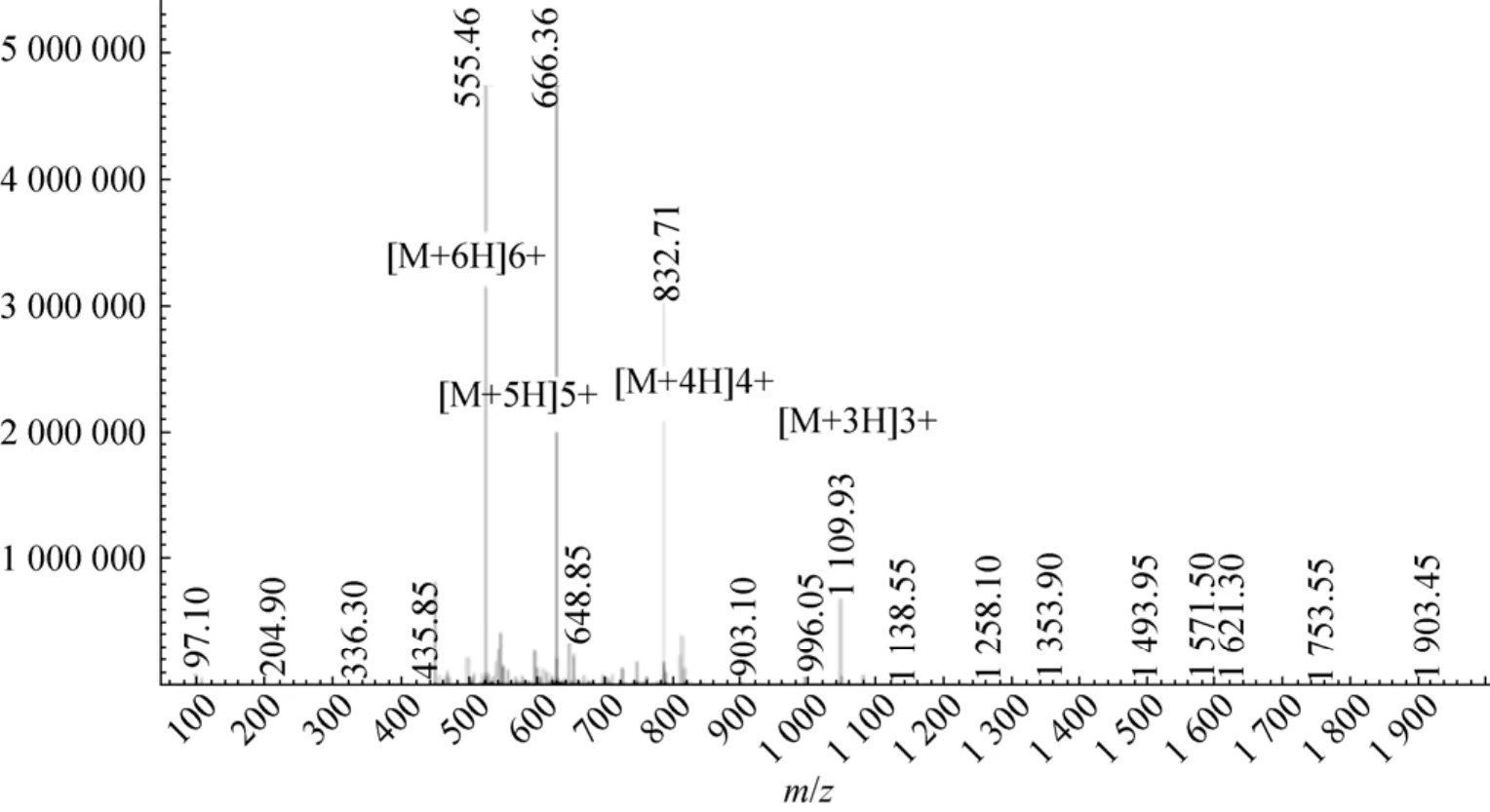
图4 重组VIP质谱鉴定结果Fig. 4 Identification of VIP by mass spectrometry.
2.7 重组VIP摇瓶发酵条件优化
通过测定诱导后VIP的含量确定摇瓶最佳发酵条件,结果如图6所示。结果显示,在24–96 h范围内,随着诱导时间的延长,VIP表达量呈上升趋势;96 h后,随着诱导时间的延长,VIP表达量呈缓慢下降趋势;在 24–28 ℃范围内,VIP表达量随着温度的升高呈上升趋势,当温度超过28 ℃时,随着温度的上升,VIP表达量呈下降趋势;甲醇诱导浓度在 0.1%–0.7%范围时,随着甲醇浓度的升高,VIP表达量呈上升趋势,当甲醇浓度超过0.7%时,随着甲醇诱导浓度的上升,VIP表达量呈下降趋势。结果表明重组菌GS115-PIC-vip在 28 ℃、0.7%甲醇浓度条件下诱导 96 h时VIP表达量最高,为13.37 mg/mL。
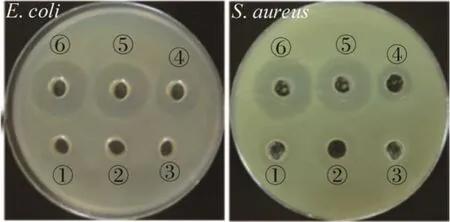
图5 重组VIP对E. coli和S. aureus的抑菌活性Fig. 5 Antibacterial activity of recombinant VIP against E. coli and S. aureus. ①: YPM medium; ②: induced supernatant of empty plasmid; ③: cellulase buffer; ④:induced supernatant of recombinant GS115-PIC-vip; ⑤,⑥: purified VIP.
2.8 重组VIP细胞毒性检测
通过检测 VIP对人肠上皮细胞 (NCM460)和猪肠上皮细胞 (IPEC-J2) 存活率的影响测定VIP对正常机体细胞的毒性 (图 7)。结果表明重组VIP对正常NCM460和IPEC-J2细胞存活率没有影响。
2.9 重组VIP溶血活性检测
取SD大鼠静脉腹腔血,检测重组VIP对其的溶血活性。结果如图8所示,5–40 μmol/L VIP处理后的 SD大鼠红细胞都没有发生溶血作用,表明VIP不具有溶血性。
2.10 重组VIP抗菌机制研究
用MIC浓度 VIP处理后的E. coliATCC25922和S. aureusATCC25923形态如图9所示。结果显示,对照组E. coliATCC25922形态结构完整,呈杆状,细胞质分布均匀;而与对照组相对应的用MIC浓度VIP处理之后的实验组E. coliATCC25922细胞膜和细胞壁遭到严重破坏,细胞质固缩、内容物外泄甚至空泡化。正常对照组S. aureusATCC25923呈球形,表面光滑,细胞质分布均匀;而用 MIC浓度VIP处理之后的S. aureusATCC25923几乎看不到完整的细胞,细胞壁和细胞膜严重变形甚至破裂,内容物外泄,细胞质固缩。说明在MIC浓度的VIP处理下,E. coliATCC25922和S. aureusATCC25923细胞结构破坏极其显著。
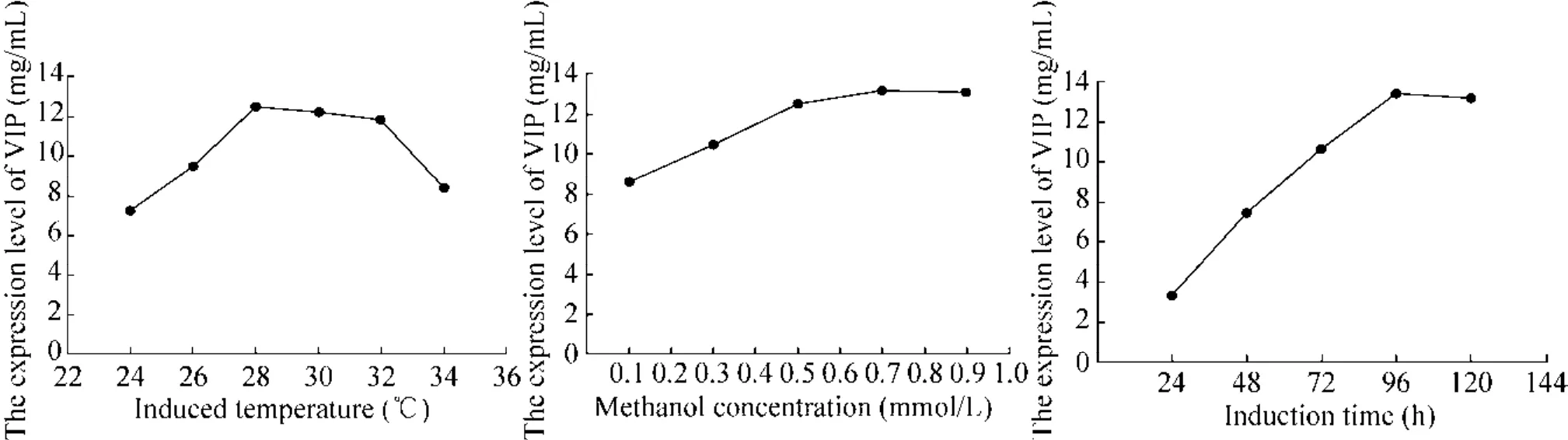
图6 发酵参数优化Fig. 6 Optimization of fermentation parameters.

图7 VIP对NCM460和IPEC-J2存活率的影响Fig. 7 Effect of VIP on the survial rate of NCM460 and IPEC-J2.
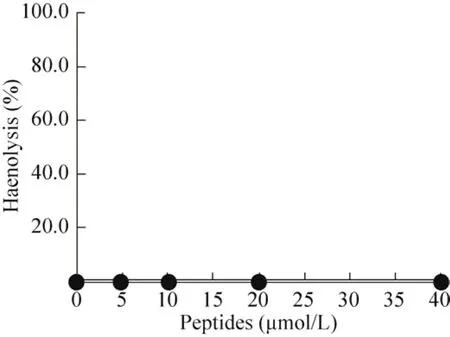
图8 VIP对SD大鼠红细胞溶血活性分析Fig. 8 Analysis of erythrocyte hemolytic activity of VIP on SD rats.
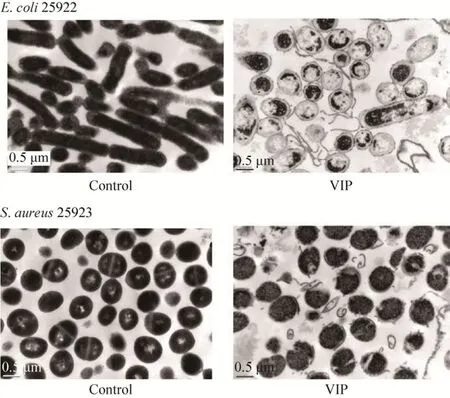
图9 VIP对E. coli ATCC25922和S. aureus ATCC25923的抗菌机制 (1×MIC,2 h,30 000×)Fig. 9 Antimicrobial mechanism of VIP on E. coli ATCC25922 and S. aureus ATCC25923 (1×MIC, 2 h, 30 000×).
3 讨论
抗菌肽起初是从昆虫血淋巴细胞中分离得到的一类具有抗菌活性的多肽,具有分子量小、热稳定性好、不具有免疫原性、抗菌谱广等特点[17-18]。Bals等[13]研究发现大多抗菌肽对细菌和真菌都有很好的杀伤活性,而对正常动物细胞没有杀伤作用[19-20]。本研究结果也再次证明了人抗菌肽VIP对正常细胞NCM460和IPEC-J2不具有细胞毒性。抗菌肽的溶血性则直接反映了其在生物体内的安全性,对于抗菌肽是否能运用于临床起到决定性的作用[7]。本研究结果显示5–40 μmol/L的VIP对SD大鼠静脉腹腔血红细胞均未发生溶血现象,表明VIP对SD大鼠红细胞没有溶血活性。本研究电镜观察到人抗菌肽VIP主要通过对细菌细胞膜进行破坏而抑杀细菌。徐博成等也发现,抗菌肽杀菌机制主要是通过直接破坏生物膜或与细胞内大分子相互作用而抑杀细菌,从而不会诱导产生耐药菌株[8]。抗菌肽是新型抗生素开发的首选[2-3],由于抗菌肽天然产量非常低,化学合成成本昂贵,无法满足临床需求[21]。因此,利用基因工程方法获得高产、高效、低成本的抗菌肽极为迫切。毕赤酵母被美国FDA认定为GRAS(Generally recognized as safe) 微生物,从而为毕赤酵母在食品和医疗卫生行业的应用奠定了良好基础[22]。毕赤酵母具有翻译后修饰、分泌表达外源蛋白、表达量高等诸多优点,广泛用于外源蛋白的表达[23]。
本研究根据毕赤酵母密码子的偏好性优化人抗菌肽VIP基因序列,并通过毕赤酵母菌表达系统对人抗菌肽VIP进行表达与分离纯化,成功构建了表达载体 pPICZαA-vip。通过电转化将重组质粒pPICZaA-vip整合到毕赤酵母GS115基因组上。经0.5%的甲醇诱导后,人抗菌肽VIP得以表达。28 ℃、0.7%甲醇诱导96 h产量达到最大值13.37 mg/mL。通过发酵液的纯化,纯化产物的鉴定,质谱鉴定结果均显示分泌表达的产物与人抗菌肽VIP大小完全一致,表明人抗菌肽VIP成功分泌表达。分泌表达人抗菌肽VIP的抗菌活性实验表明,对大肠杆菌E. coliATCC25922和金黄色葡萄球菌S. aureusATCC25923均有明显的抑制作用。本实验只选择了具有代表性的大肠杆菌和金黄色葡萄球菌进行抗菌活性实验,对于人抗菌肽VIP的抗菌谱还要进行更深入的研究。
本研究采用毕赤酵母表达系统成功分泌表达了具有生物活性的人抗菌肽 VIP,并对摇瓶发酵条件进行了优化,为VIP进行大量生产和开发成为新型肽类抗生素药物奠定了基础。
REFERENCES
[1]Boman HG. Peptide antibiotics and their role in innate immunity. Annu Rev Immunol, 1995, 13(1):61–92.
[2]Nibbering PH, Hiemstra P, Drijfhout JW.Antimicrobial peptide: US, 9562085. 2017-02-07.
[3]Wang GS. Human antimicrobial peptides and proteins. Pharmaceuticals, 2014, 7(5): 545–594.
[4]Zasloff M. Antimicrobial peptides of multicellular organisms. Nature, 2002, 415(6870): 389–395.
[5]Li Q, Ma HX, Zhang HR, et al. Research process in artificial antimicrobial peptides. Pharmaceut Biotechnol, 2017, 24(4): 364–368 (in Chinese).李倩, 马慧霞, 张皓然, 等. 人工抗菌肽的研究进展. 药物生物技术, 2017, 24(4): 364–368.
[6]Wang Q, Xu YZ, Liu BG, et al. Research advance in characteristics and genetic engineering of antibacterial peptides. Heilongjiang Anim Sci Vet Med, 2017, 17(9): 5–8 (in Chinese).王青, 徐彦召, 刘保国, 等. 抗菌肽的特点及其基因工程研究进展. 黑龙江畜牧兽医, 2017, 17(9):5–8.
[7]Deslouches B, Di YP. Antimicrobial peptides with selective antitumor mechanisms: prospect for anticancer applications. Oncotarget, 2017, 8(28):46635–46651.
[8]Xu BC, Chou SL, Shan AS. Antibacterial peptide classification, mechanism of action and application in animal production. Heilongjiang Anim Sci Vet Med, 2017(11): 72–76 (in Chinese).徐博成, 丑淑丽, 单安山. 抗菌肽的分类、作用机理和在动物生产中的应用. 黑龙江畜牧兽医,2017(11): 72–76.
[9]Tian CP, Mao AH, Yuan HX, et al. Effects of the antibacterial peptide in prevention and treatment of cancer. Gansu Med J, 2017, 36(6): 431–432 (in Chinese).田彩平, 毛爱红, 袁红霞, 等. 抗菌肽在肿瘤防治中的作用. 甘肃医药, 2017, 36(6): 431–432.
[10]Zhao DH, Dai ZY, Zhou KY. The research advances in function, mechanism and molecular biology of insect antibacterial peptides. Progr Biotechnol,1999, 19(5): 14–18 (in Chinese).赵东红, 戴祝英, 周开亚. 昆虫抗菌肽的功能、作用机理与分子生物学研究最新进展. 生物工程进展, 1999, 19(5): 14–18.
[11]Hancock EW, Patrzykat A. Clinical development of cationic antimicrobial peptides: from natural to novel antibiotics. Curr Drug Targets Infect Disord, 2002,2(1): 79–83.
[12]Diamond G. Natures antibiotics: the potential of antimicrobial peptides as new drugs. Biologist(London), 2001, 48(5): 209–212.
[13]Bals R. Antimikrobielle peptide und peptidantibiotika. Med Klin, 2000, 95(9): 496–502.
[14]Xu CL, Wang YM, Sun R, et al. Modulatory effects of vasoactive intestinal peptide on intestinal mucosal immunity and microbial community of weaned piglets challenged by an enterotoxigenicEscherichia coli(K88). PLoS ONE, 2014, 9(8): e104183.
[15]Xu CL, Shang XY, Niu WN, et al. Study on solid synthesis and antimicrobial activityinvitroof vasoactive intestinal peptide. Chem Bioeng, 2012,29(5): 12–15 (in Chinese).徐春兰, 尚晓娅, 牛卫宁, 等. 血管活性肠肽的固相合成及其体外抗菌活性研究. 化学生物工程,2012, 29(5): 12–15.
[16]Zhang J, Wu X, Yue YY, et al. Cloning, expression and characterization of antibacterial peptide CM4 inPichia pastoris. Acta Microbiol Sin, 2005, 45(5):720–723 (in Chinese).张杰, 吴希, 岳园园, 等. 抗菌肽 CM4基因克隆及其在毕赤酵母中的表达鉴定. 微生物学报,2005, 45(5): 720–723.
[17]Robinson K, Deng Z, Hou YQ, et al. Regulation of the intestinal barrier function by host defense peptides. Front Vet Sci, 2015, 2: 57.
[18]Gong X, Shi YH, Le GW. Study on the interaction mechanism of antibacterial peptide MDL-1 inMusca domesticaLandE. coliDNA by fluorescence spectra. Spectrosc Spect Anal, 2005,25(3): 420–423 (in Chinese).宫霞, 施用晖, 乐国伟. 荧光光谱分析家蝇幼虫抗菌肽与大肠杆菌染色体DNA作用机理. 光谱学与光谱分析, 2005, 25(3): 420–423.
[19]Tam JP, Wang S, Wong KH, et al. Antimicrobial peptides from plants. Pharmaceuticals (Basel), 2015,8(4): 711–757.
[20]Bommineni YR, Dai HE, Gong YX, et al.Fowlicidin-3 is an α-helical cationic host defense peptide with potent antibacterial and lipopolysaccharide-neutralizing activities. FEBS J,2007, 274(2): 418–428.
[21]Hong J, Hu JY, Wang FM, et al. Molecular mechanisms of tachyplesin I role on genomic DNA and RNA ofEscherichia coli. J Agric Sci Technol,2013, 15(1): 71–75 (in Chinese).洪军, 胡建业, 王福梅, 等. 鲎源抗菌肽对大肠杆菌基因组DNA和RNA作用的分子机制. 中国农业科技导报, 2013, 15(1): 71–75.
[22]Ansari AM, Majidzadeh AK, Darvishi B, et al.Extremely low frequency magnetic field enhances glucose oxidase expression inPichia pastorisGS115.Enzyme Microb Technol, 2017, 98: 67–75.
[23]Ma XJ, Liu L, Li QQ, et al. High-level expression of a bacterial laccase, CueO fromEscherichia coliK12 inPichia pastorisGS115 and its application on the decolorization of synthetic dyes. Enzyme Microb Technol, 2017, 103: 34–41.
