有机磷阻燃剂甲状腺干扰效应及其作用机制研究
——以磷酸三(2-氯丙基)酯(TCPP)为例
2018-06-25孔东东王荣芳北京师范大学水科学研究院北京师范大学地下水污染控制与修复教育部工程中心北京100875
沈 扬,于 畅,孔东东,王荣芳,李 剑 (北京师范大学水科学研究院,北京师范大学地下水污染控制与修复教育部工程中心,北京 100875)
甲状腺激素由甲状腺分泌,在人类和动物的生理过程中发挥着重要的作用,包括调节生长、能量代谢、组织分化和发育以及维护大脑功能等[1].甲状腺激素干扰物(TDCs)是一类能改变下丘脑-垂体-甲状腺轴稳态的维持和调节或者作用于依赖于甲状腺激素的相关功能的一类外源性化合物[2].甲状腺激素功能的紊乱可导致儿童大脑的发育和神经系统的发育障碍[3-4].
目前许多外源性化合物能够干扰甲状腺激素活性,已发现的可疑甲状腺激素干扰物包括:多氯联苯类(PCBs)、二噁英类物质、溴代阻燃剂类(BFRs,如多溴联苯类(PBBs),多溴联苯醚(PBDEs))、有机磷阻燃剂类(OPFRs)、邻苯二甲酸酯类(PAEs)等[4-5].其中,OPFRs由于其优良的阻燃性能,成为 BFRs的替代产品,目前已广泛应用于纺织、化工、建材以及电子等行业[6].随着BFRs在世界范围逐步禁用, OPFRs目前的全球年产量已达 20万 t[7].其中,磷酸三(2-氯丙基)酯(TCPP)是目前最常见的有机磷阻燃剂.TCPP的大量生产和使用导致其在环境和人体组织中的广泛检出. Khan等[8]在巴基斯坦的工业区和农村的饮用水中检出 TCPP是主要的阻燃剂类污染物.2014年,在我国黄海、东海海域广泛检出TCPP,检出浓度范围为 92~1392ng/L.TCPP甚至在南京饮用水中被检出,浓度为 325ng/L[9].TCPP在环境中的广泛检出可能对人体健康和生态安全构成威胁[10].例如,TCPP会干扰内分泌系统,影响斑马鱼的正常发育[11].
TCPP在分子结构方面与天然甲状腺激素三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)结构类似,可能模拟天然甲状腺激素对生物体产生干扰.TCPP已被列入可疑TDCs清单,因此TCPP可能对甲状腺激素产生干扰效应.陆美娅等[12]采用报告基因检测方法考察9种OPFRs与甲状腺激素受体(TR)的作用,结果表明 TCPP表现出显著的TR抑制活性.但是,Kojima等[13]开展TCPP与甲状腺核受体 TRα、TRβ的作用研究发现,未检出其对 TRα/β诱导或抑制活性.可见,对于TCPP甲状腺激素毒性,目前的研究报道并没有得到一致性的结论.综上所述,TCPP甲状腺激素干扰毒性及其致毒机理的研究才刚刚起步,急需开展 TCPP的甲状腺激素干扰活性及其作用机理的相关研究.
由于 TCPP可能模拟天然甲状腺激素干扰其活性,关于 TCPP对甲状腺激素干扰作用机理的研究通常以甲状腺激素的分子作用机制研究为基础.目前的研究发现,甲状腺激素主要通过基因组作用和非基因组作用两种途径在不同的组织中行使生理功能[14].目前的研究多集中于基因组作用途径,即经典核受体途径.近年来的研究发现,甲状腺激素还可以通过非基因转录的方式对靶细胞或组织进行调节,即存在非基因组(nongenomic)途径.甲状腺激素的非基因组作用可以定义为 THs与细胞核外的受体不通过核内结合过程所产生的作用[15].此前,有文献[16-17]证实PCB153可通过非基因组作用途径产生甲状腺激素干扰效应,进一步佐证了非基因组作用途径是TDCs的甲状腺激素干扰效应的重要因素.但是目前关于 TDCs对甲状腺激素的非基因组作用途径的研究报道较少.
本文选择典型的OPFRs TCPP作为研究对象,通过对GH3细胞增殖实验和重组TR基因酵母实验考察其甲状腺激素干扰效应,同时采用实时定量PCR技术,表征TCPP暴露对GH3细胞关键基因表达的调节,初步探明其干扰作用机理.以期为TCPP的甲状腺激素毒性及TCPP环境风险评价提供基础数据和理论支持;同时,本研究可为其他 TDCs的甲状腺激素干扰机理的研究提供方法学上的借鉴.
1 材料与方法
1.1 实验材料
F10培养基、DMEM/F12培养基、胎牛血清、15%马血清均购自Gibco公司(美国);胰蛋白酶购自 Life Technologies公司(美国);牛胰岛素(≥95%)、牛血清白蛋白(98%)购自 Sigma公司(美国);人脱铁转铁蛋白(98%)购自 Solarbio公司;乙醇胺(99.5%),亚硒酸钠(99.75%),TCPP(99%),T3(98%,购自上海百灵威化学公司);MTT试剂盒和LDH试剂盒均购自南京建成生物工程研究所.二甲亚砜(Dimethylsulfoxide,DMSO)(99.5%)购自Sigma-Aldrich公司(美国).
1.2 重组TR基因酵母实验
重组TR基因酵母由中国科学院生态环境研究中心环境水质学国家重点实验室提供.测试方法参考文献[18]进行.可简述为,选择指数生长期的酵母,调节酵母菌株培养液在600nm波长处的吸光度值为0.8左右.在无菌条件下取995µL菌株培养液、5µL DMSO 溶解的样品,混匀成暴露培养液.DMSO作为阴性对照,T3作为阳性对照.将200µL暴露培养液加入无菌的 96孔培养板中,800r/min、30℃下振荡培养2h.酶标仪(TECAN GENios A-5002, Austria)测定 OD600的值.从培养板中吸出150µL菌液,加入120µL缓冲液,在微孔摇床上预培养5min后加入20µL三氯甲烷,微孔摇床最大转速振荡 10min破碎酵母细胞;再加入40µL o-NPG 反应液启动酶反应,并计时直至出现明显的黄色,反应完成后加入 100µL (1mol/L)的碳酸钠溶液,固定反应,吸取200µL转移到酶标板中测定420nm波长处的吸光度值,计算目标化合物诱导酶活性值如文献[18]所述.对目标化合物的 TR抑制活性开展检测时,在测试体系中添加5×10-6mol/L T3,检测目标化合物对T3诱导酶活性的抑制作用,每个样品设 4组平行,参考文献[19]报道计算目标化合物的抑制率.
1.3 细胞增殖实验
GH3大鼠垂体瘤细胞株引自中国医学科学院基础所细胞中心,GH3(TRβ-)细胞由英茂盛业生物科技有限公司提供,其原理可简述为:根据TRβ1mRNA序列设计6个靶点和一个阴性随机对照序列,构建慢病毒 TRβ1RNA 干扰载体和阴性对照载体.将慢病毒 TRβ1RNA 干扰载体和阴性对照载体分别包装为慢病毒后感染GH3细胞,通过嘌呤霉素(puromycin)筛选 TRβ1基因 RNA干扰稳定细胞株,验证结果表明 GH3(TRβ-)细胞株TRβ1的相对表达量为空白对照的17.95%,可认为 TRβ1缺陷细胞.GH3细胞和 GH3(TRβ-)细胞的培养方式细胞增殖实验步骤相同,参考文献[20],可简述为:用F10培养基(含2.5%胎牛血清、15%马血清)37℃、5%CO2细胞培养箱中培养,3~4天传代 1次.取对数生长期的细胞,经 0.25%胰蛋白酶消化后,用贴壁培养基(1mg 牛胰岛素,0.6µL 乙醇胺(1µmol/L),1µg亚硒酸钠,1mg人辅基转铁蛋白及 50mg牛血清白蛋白定容于100mL DMEM/F12培养基)调整细胞密度为4×l05个/mL.每孔加入 100µL 细胞悬液,8µL 目标化合物加入到4mL培养基中制备暴露培养液,待24h细胞贴壁后,加入暴露培养液20µL,DMSO作为空白对照,保证每孔 DMSO终浓度为 0.1%.继续培养48h后,每孔加入20µL的MTT溶液,培养箱中孵化 4h后吸尽所有溶液,加入 150µL/孔DMSO,置于摇床上振摇 10min后,酶标仪测定570nm 下的吸光度值 OD570.样品(Iai)和对照(IT3)的细胞增殖率的计算参考文献[18]报道进行.细胞增殖抑制率Ibi计算公式如下.

式中:Ibi为细胞增殖抑制率;IT3为T3的细胞增殖率;Iai为样品诱导的细胞增殖率.
1.4 乳酸脱氢酶(LDH)检测方法
为排除目标化合物急性细胞毒性对测试结果的影响,重组基因酵母实验参考文献[18]报道方法检测目标化合物对酵母细胞的急性毒性.
LDH实验补充检测化合物暴露后诱导细胞产生的乳酸脱氢酶,以表征目标化合物对GH3细胞的急性毒性.测试流程可简述为:细胞增殖实验在加入 MTT溶液之前,从对应的培养板中取上清液100µL加入新的96孔板中,置于 37℃培养箱中培养10min,根据LDH试剂盒的说明书进行检测.酶标仪于440nm波长处测定吸光度值,
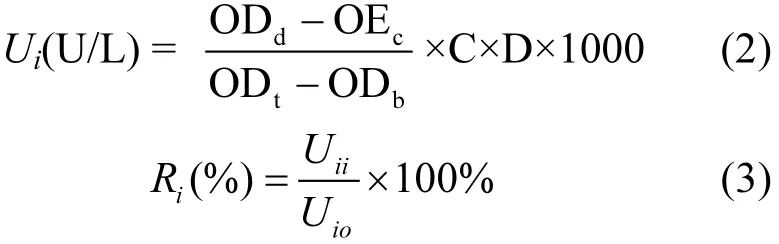
式中:Ui为LDH露出率;ODd为目标化合物的吸光度值;ODc为对照的吸光度值;ODt为标准品的吸光度值;ODb为空白样品的吸光度值;C为标准品浓度2mmol/L;D为稀释倍数;Ri为LDH相对露出率;Uii为目标化合物的 LDH露出率;Uio为DMSO的LDH露出率.Uii和Uio均由式(2)计算得到.
1.5 RT-PCR法检测目的基因mRNA表达[21]
1.5.1 RNA提取方法与逆转录 GH3细胞暴露TCPP与细胞增殖实验前期步骤相同,暴露完成后,使用RNA-Solv reagent试剂盒(Omega公司,美国)并按照其步骤提取总 RNA.通过测定样品在A260nm/A280nm的比值确定样品的纯度在1.8到2.0的范围内(Nanodrop ND-1000, Nano-Drop,Wilmington, USA).使用 PrimeScript™ II 1st Strand cDNA Synthesis Kit试剂盒(Takara公司,日本)逆转录,具体操作方法参见试剂盒的说明书.
1.5.2 荧光定量PCR方法 使用ABI7500Realtime PCR System对目标基因进行SYBR Green绝对定量PCR反应,每个样品设4组平行.在无菌96孔板中配置20µL PCR反应体系.SYBR Green溶液10µL;前引物、后引物各1µL;DNA样品<1µg;无菌水补齐20µL.反应过程为:95℃下变性5min,之后进行40个循环,每个循环在95℃下15s,退火温度55℃1min.以 β-actin为内参照.各目的基因及内参基因β-actin的引物见表1.采用比较循环阈值法分析各组中mRNA的相对表达量.

表1 实时定量PCR引物Table 1 Primer sequence for quantitative Real-time PCR in GH3cell
1.6 数据处理与分析
所有实验数据均采用Excel软件进行统计处理.所得数据以±s表示,组间差异采用 t检验.P<0.05认为差异有统计学意义.
2 结果与讨论
2.1 TCPP对GH3细胞增殖的影响
TCPP 暴露浓度范围设定为 2×10-8~2×10-4(mol/L),检测不同暴露浓度下 TCPP对甲状腺激素效应的干扰.测试结果如图1(a)所示, TCPP与空白对照相比对GH3细胞无显著的增殖促进作用(P>0.05).
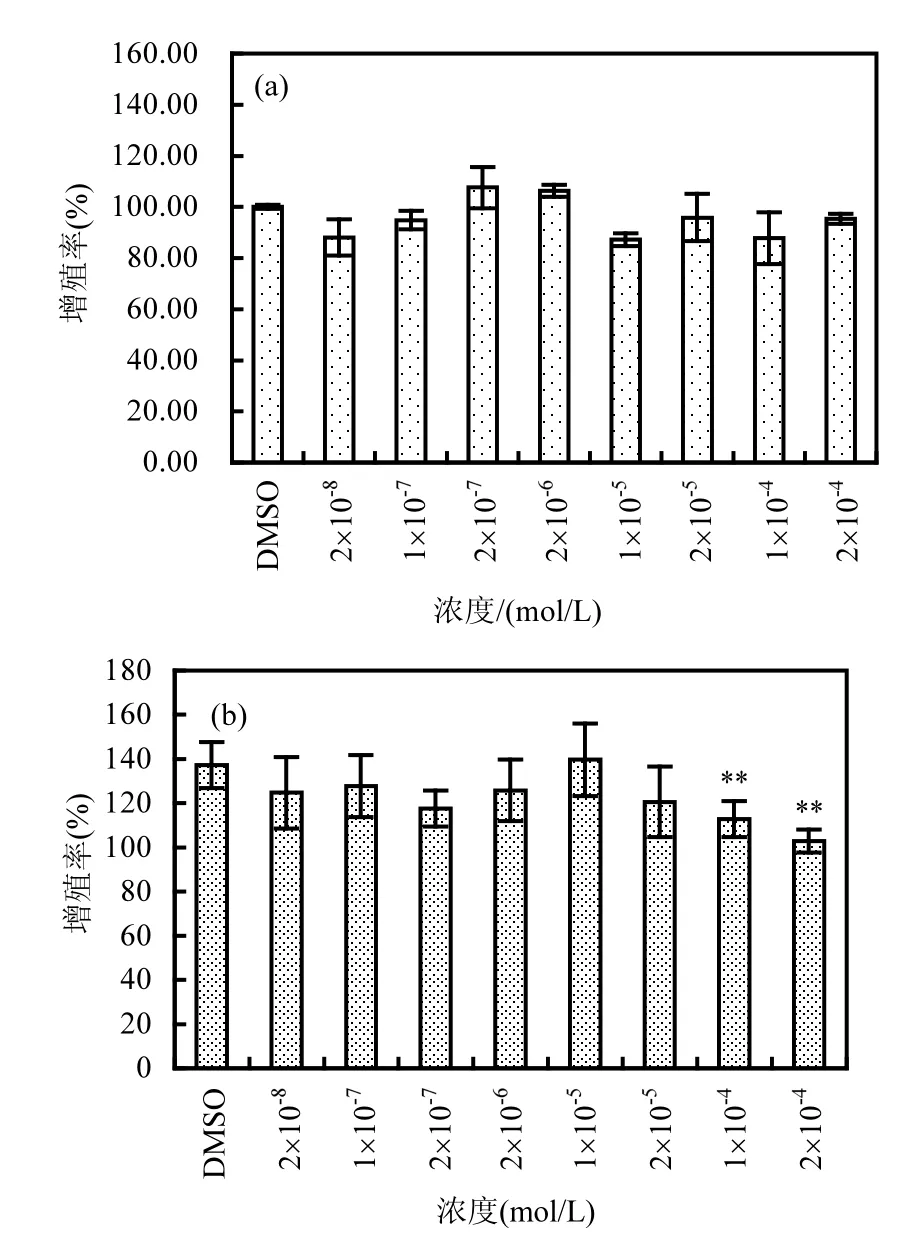
图1 TCPP对GH3细胞增殖的影响Fig.1 Effect of different treatment concentrations on GH3 proliferation of TCPP
为表征 TCPP对 T3增殖活性的抑制,将TCPP与T3(2×10-8mol/L)共同暴露,考察TCPP对GH3细胞增殖的影响.结果如图 1(b)所示,TCPP在 1×10-4mol/L和2×10-4mol/L暴露浓度下抑制率分别达到24.47%和34.43%,对T3的增殖具有明显的抑制作用(P<0.01).GH3细胞富含 TR,具有甲状腺激素依赖增殖的特点,通过检测化合物暴露对GH3细胞增殖的影响发展了该方法,已成为TDCs筛选的主要方法,广泛应用于PCBs等甲状腺激素干扰效应的检测[22].本实验的结果表明,TCPP对于GH3细胞无明显的细胞增殖诱导效应.但是,TCPP能够抑制天然甲状腺激素T3对GH3细胞的增殖效应,表现出GH3细胞增殖抑制活性.说明TCPP可干扰甲状腺激素效应,表现为甲状腺激素的抑制剂.
为排除目标化合物的急性毒性对实验结果的影响,添加 LDH 检测实验.其测试原理可表征为:化合物暴露导致细胞损伤,受损细胞在培养过程中破碎并释放LDH,因此通过检测细胞培养液中LDH露出率的高低反映暴露化合物的急性毒性[23].TCPP 暴露 GH3细胞后,通过检测培养液中的LDH活性变化,表征TCPP对GH3细胞的急性毒性.测试结果如图 2所示,所有暴露浓度下,TCPP对GH3细胞的LDH露出率与空白对照相比无显著变化(P>0.01),表明测试浓度下,TCPP未对GH3细胞产生显著损伤.该实验结果基本排除 TCPP产生细胞毒性对细胞增殖的影响,表明TCPP对 T3诱导的 GH3细胞增殖具有抑制活性,TCPP具有甲状腺激素干扰效应.
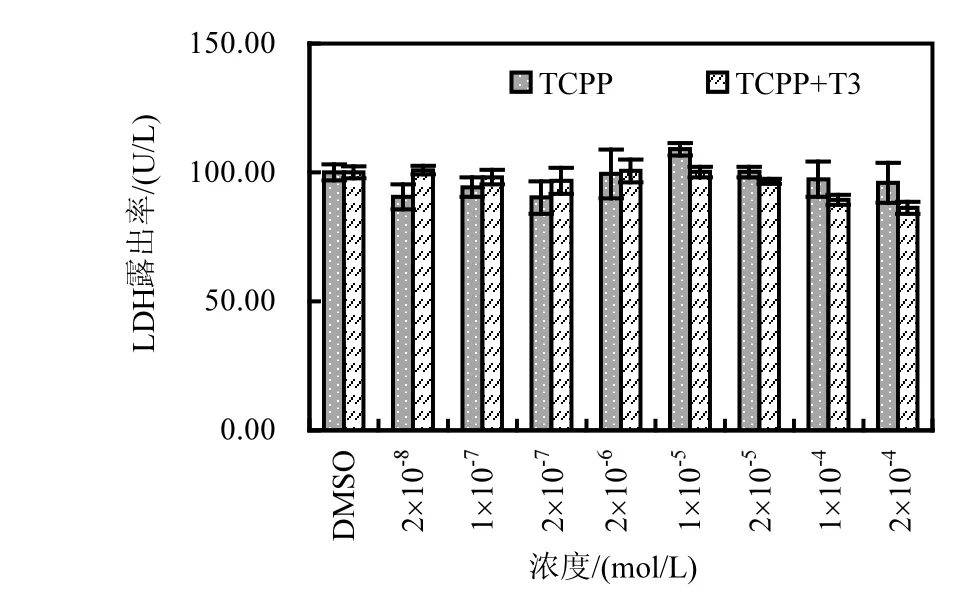
图2 TCPP染毒对GH3细胞LDH露出率的影响Fig.2 LDH leakage rate of GH3cells exposure to TCPP
2.2 TCPP甲状腺激素干扰途径初步研究
2.2.1 TCPP对重组TR基因酵母的甲状腺激素干扰效应 为了考察 TCPP对 TR的干扰作用,选择暴露浓度为 2×10-8~2×10-4(mol/L)开展重组TR基因酵母实验,测试结果表明,所有样品均未检出显著的酵母细胞急性毒性,表明了 TCPP即使在最高暴露浓度下也不会诱导酵母细胞损伤,排除了待测化合物急性毒性对酵母细胞甲状腺激素干扰效应测试结果的影响.
如图3(a)所示,对比各浓度下TCPP与T3的诱导率(100.50%)可知,TCPP未表现出明显的TR诱导活性.低浓度下,TCPP未表现出显著的TR抑制活性;高浓度(>2×10-5mol/L)情况下,TCPP 表现出显著的TR抑制效应(P<0.05),在TCPP的暴露浓度为 2×10-4mol/L 时,诱导率达到 36.09%(P<0.01)(图 3(b)).陆美娅等[12]采用报告基因检测方法考察 TCPP等的甲状腺激素干扰效应,结果表明 TCPP 在(1×10-9mol/L~1×10-5mol/L)浓度范围内无TR诱导活性,而在1×10-5mol/L浓度下表现出 TR抑制活性,与本文的研究结论基本一致.该结果与上文报道的GH3细胞增殖实验的结果也具有一致性,均未检测出显著的 TCPP甲状腺激素诱导活性,但是检测出 TCPP甲状腺激素抑制活性.重组 TR基因酵母方法实验的实验原理可简述为采用酵母双杂交技术将TR基因和受体共激活因子基因共转化进入酵母细胞,通过测定报告基因 LacZ表达产物 β-半乳糖苷酶活性,表征化合物对 TR的干扰活性[24].结合本文的实验结果,可初步表明TCPP可通过TR途径实现对甲状腺激素活性的干扰.大量文献报道典型的 TDCs,例如PCBs、PBDEs和PBBs[25-26],均可通过作用TR,实现对甲状腺激素活性的干扰.
2.2.2 TCPP对 GH3(TRβ-)细胞增殖的影响 近年来有研究表明,甲状腺激素不仅可以通过 TR对靶细胞进行作用,还可以通过非基因转录的方式对靶细胞或组织进行调节,即存在非基因组途径.已有研究表明在 TR众多亚型中,甲状腺激素主要通过TRβ对靶细胞进行作用[27].因此,本研究采用基因沉默技术敲除 GH3细胞中的TRβ 基因,构建 GH3(TRβ-)缺陷型细胞,并通过GH3(TRβ-)细胞增殖实验,考察 TCPP是否通过非基因组途径干扰甲状腺激素效应.本文重点考察 TCPP对 GH3(TRβ-)细胞增殖的抑制效应.TCPP和T3共同暴露于GH3(TRβ-)细胞,结果表明,TCPP的暴露浓度在 1×10-4mol/L 和 2×10-4mol/L时,细胞增殖率分别为 113.39%和109.23%,显著低于T3单独作用下的细胞增殖率(P<0.05),表明 TCPP 对 T3 诱导的 GH3(TRβ-)细胞增殖具有抑制活性.
本文的实验结果表明,TCPP在暴露浓度为1×10-4mol/L和2×10-4mol/L时可抑制T3诱导的GH3(TRβ-)细胞增殖,表明TCPP可能存在TR途径外的作用方式.Liu等[16]的报道也证实PCB153可通过刺激氨基末端激酶(JNK)/丝裂原活化蛋白激酶(MAPK)信号通路下调甲状腺激素水平,证实 PCB153可通过非基因组作用产生甲状腺激素干扰效应.进一步佐证了非基因组作用途径不仅存在于 THs 调节的生物学效应,同时也是TDCs甲状腺激素干扰效应的重要作用方式.此前的研究表明非基因组途径不依赖基因转录和翻译、能够在数秒或分钟时间内快速应答,对维持THs的生物学效应起着至关重要的作用[15].因此,研究 TDCs的甲状腺激素干扰非基因组效应的作用机理具有重要的环境意义,其对于更加全面的评估 TDCs的毒理学效应,从而预测造成的生态与健康风险.由此可见,研究TDCs不应仅仅局限于对基因组作用途径的考察,应拓展 TDCs作用途径的研究.

图4 TCPP对GH3(TRβ-)细胞的抑制效应Fig.4 Antagonist activities of TCPP using the GH3(TRβ-)cell proliferation assay
2.3 TCPP对相关mRNA表达的影响
为探究TCPP的甲状腺激素干扰效应及可能的作用途径,在基因层面上,考察 TCPP暴露对相关基因mRNA表达的调节.测试结果如图5所示,TCPP与T3共同暴露GH3细胞48h后, c-fos基因、TRβ基因, integrin-av基因和k-ras基因mRNA表达显著下调;TRα基因、raf-1基因和Mapk-3基因mRNA表达与对照组相比无显著变化.
已有研究证明 TDCs能够在不同的组织干扰TRα、TRβ mRNA的表达[26].此外,Scarlett等[29]通过对人类成骨细胞对甲状腺激素信号通路的研究,结果表明甲状腺激素能通过结合细胞膜整合素 αvβ3能够迅速激活 ERK-1/2活性.ERK1/2是一条重要的调节细胞增殖分化和凋亡的信号转导通路,其主要受各种生长因子或外来化合物等磷酸化而激活[30].ERK1/2的活化是信号从细胞膜表面转导至核内的关键,这一转导过程包括k-ras、raf-1、Mapk-3等基因的参与.
已有研究表明,c-fos基因是一个与细胞增殖相关的原癌基因,可调控细胞增殖和凋亡的动态平衡,诱导细胞转化和肿瘤形成[31].GH3细胞增殖实验表明TCPP可抑制T3诱导的细胞增殖效应,c-fos表达的下调与此结果相符合,提示TCPP可能通过下调c-fos抑制细胞增殖.
如图5所示,TCPP暴露可导致TRβ mRNA表达显著下调.Augustine等报道了与本文类似的结论,证实典型 TDCs可以通过干扰 TRβmRNA的表达干扰甲状腺激素活性.p,p,-DDE在0.01mg/kg暴露青蛙后,检测到肾脏中 TRβ基因表达下调[32].Shi等[33]研究也表明全氟辛烷磺酸暴露导致斑马鱼幼鱼 TRβ表达下调.THs与 TR结合通过受体级联反应实现对相关基因表达的调控,而TDCs通过调节TRβ基因表达,可能导致THs不能激活受体级联反应[34],从而影响细胞增殖等激素调节过程.基于此,可初步认为TCPP可能通过影响 TRβ基因表达,干扰激素-受体级联反应,产生甲状腺激素干扰效应.

图5 TCPP与T3(2×10-8mol/L)共同暴露GH3细胞对相关基因mRNA表达水平的调节Fig.5 mRNA levels of related gene in GH3cell** P<0.01
αvβ3-ERK-1/2转导过程包括 integrin-av、k-ras和 raf-1等基因的参与[30].本研究中,integrin-av和k-ras基因的mRNA显著下调,说明 TCPP可能激活 αvβ3-ERK-1/2通路.已有文献[35]报道典型 TDCs 邻苯二甲酸二丁酯(DBP)染毒大鼠睾丸支持细胞后致使ERK通路相关基因表达显著降低.相关理论研究表明,αvβ3-ERK-1/2信号通路在细胞的分裂、迁移及存活方面有重要的调节作用,主要参与各种生长因子、细胞因子、丝裂原以及激素受体活化后的信号转导,参与细胞的生存、增殖[36].初步表明TCPP可通过αvβ3-ERK-1/2信号通路,即通过非基因组作用途径,调节细胞增殖,与本文 2.2.2研究结果一致.此外,有研究表明[15],非基因组途径可能和基因组途径产生协同效应.以 αvβ3-ERK1/2 信号通路为例, ERK1/2亦可进入细胞核内,通过磷酸化激活 TR,直接作用于甲状腺激素反应基因.因此,TCPP也可能两种作用途径的整合干扰甲状腺激素调节的快速及长期效应.
3 结论
3.1 GH3细胞增殖实验表明TCPP可对甲状腺激素产生干扰效应.同时,重组 TR基因酵母实验和 GH3(TRβ-)细胞增殖实验初步表明,TCPP可能通过基因组途径和非基因组途径实现其甲状腺激素干扰.
3.2 TCPP对GH3细胞相关基因mRNA表达影响测试结果表明:TCPP与T3的共同暴露,下调c-fos、TRβ、integrin-av和k-ras的mRNA表达.初步认为TCPP可能通过影响 TRβ基因表达和激活 αvβ3-ERK-1/2信号通路产生甲状腺激素干扰效应.
3.3 本研究初步表明 TCPP不仅可以通过基因组途径,还可以通过非基因组途径实现对甲状腺激素的干扰.结果能够更加全面地反映 TCPP的生物学毒性,有利于进一步开展 TCPP的生态和健康风险评价.
[1]艾 扬,孔东东,于 畅,等.水环境中溶解态腐殖酸对锌抗甲状腺激素干扰效应的影响 [J]. 环境科学, 2017,38(1):195-200.
[2]Murk A. J, Rijntjes E, Blaauboer B J, et al. Mechanism-based testing strategy using in vitro approaches for identification of thyroid hormone disrupting chemicals [J]. Toxicology in Vitro,2013,27(4):1320-1346.
[3]Shi W, Hu X X, Zhang F X, et al. Occurrence of thyroid hormone activities in drinking water from Eastern China: Contributions of phthalate esters [J]. Environmental Science & Technology,2012,46(3):1811-1818.
[4]Boas M, Feldt-Rasmussen U, Main K M. Thyroid effects of endocrine disrupting chemicals [J]. Molecular and Cellular Endocrinology, 2012,355(2):240-248.
[5]穆希岩,李成龙,黄 瑛,等.两种邻苯二甲酸酯类污染物对斑马鱼胚胎发育的影响 [J]. 中国环境科学, 2017,(9):3566-3575.
[6]王晓伟,刘景富,阴永光.有机磷酸酯阻燃剂污染现状与研究进展 [J]. 化学进展, 2010,22(10):1983-1992.
[7]Zhao F R, Chen M, Gao F M, et al. Organophosphorus flame retardants in pregnant women and their transfer to chorionic Villi [J].Environmental Science & Technology, 2017,51(11):6489-6497.
[8]Khan M, Li, J, Zhang, G et al. First insight into the levels and distribution of flame retardants in potable water in Pakistan: An underestimated problem with an associated health risk diagnosis[J]. Science of Total Environment, 2016,565:346-359.
[9]Farhat A, Crump D, Chiu S, et al. In ovo effects of two organophosphate flame retardants-TCPP and TDCPP-on pipping success, development, mRNA expression, and thyroid hormone levels in chicken embryos [J]. Toxicological Sciences, 2013,134(1):92-102.
[10]van der Veen I, de Boer J. Phosphorus flame retardants: Properties,production, environmental occurrence, toxicity and analysis [J].Chemosphere, 2012,88(10):1119-1153.
[11]皮天星,蔡磊明,蒋金花.新型阻燃剂TCPP对斑马鱼的毒性研究[J]. 生态毒理学报, 2016,11(2):247-256.
[12]陆美娅.雌激素受体ER和甲状腺激素受体TR介导的典型环境内分泌干扰物效应研究 [D]. 杭州:浙江工业大学, 2015.
[13]Kojima H, Takeuchi S, Itoh T, et al. In vitro endocrine disruption potential of organophosphate flame retardants via human nuclear receptors [J]. Toxicology, 2013,314(1):76-83.
[14]Davis P J, Lin H Y, Mousa SA, et al. Overlapping nongenomic and genomic actions of thyroid hormone and steroids [J]. Steroids,2011,76(9):829-833.
[15]Davis P J, Leonard J L, Davis F B. Mechanisms of nongenomic actions of thyroid hormone [J]. Frontiers in Neuroendocrinology,2008,29(2):211-218.
[16]Liu C, Ha M, Cui Y, et al. JNK pathway decreases thyroid hormones via TRH receptor: A novel mechanism for disturbance of thyroid hormone homeostasis by PCB153 [J]. Toxicology,2012,302(1):68-76.
[17]周 君. p,p'-DDE,PCB-153单独及联合作用通过ERK1/2信号转导通路对大鼠离体脑垂体细胞的类激素效应 [D]. 武汉:华中科技大学, 2013.
[18]Li J, Ma M, Wang Z J. A two-hybrid yeast assay to quantify the effects of xenobiotics on thyroid hormone-mediated gene expression [J]. Environmental Toxicology and Chemistry, 2008,27(1):159-167.
[19]刘 芸,李 剑,马 梅,等.代谢活化作用对多溴代联苯类污染物类/抗甲状腺激素活性的影响 [J]. 生态毒理学报, 2008,3(1):27-33.
[20]Schriks M., Vrabie C M, Gutleb A C, et al. T-screen to quantify functional potentiating, antagonistic and thyroid hormone-like activities of poly halogenated aromatic hydrocarbons (PHAHs)[J]. Toxicology in Vitro, 2006,20(4):490-498.
[21]Pruden A, Pei R T, Stortrboom H, et al. Antibiotic resistance genes as emerging contaminants: studies in northern Colorado [J].Environmental Science and Technology, 2006,40(23):7445-7450.
[22]李 剑,任姝娟,马 梅,等.改进型重组基因酵母 TR-GRIP1检测化合物甲状腺激素干扰活性 [J]. 环境科学研究, 2011,24(10):1172-1177.
[23]文 育,雷炳莉,康 佳,等.双酚 A 类同系物的雌激素效应及对MCF-7细胞的毒性 [J]. 上海大学学报(自然科学版), 2015,21(4):515-524.
[24]Li J, Liu Y, Kong D, et al. T-screen and yeast assay for the detection of the thyroid-disrupting activities of cadmium,mercury, and zinc [J]. Environmental Science and Pollution Research, 2016,23(10):9843-9851.
[25]Techer R, Houde M, Verreault J. Associations between organohalogen concentrations and transcription of thyroid-related genes in a highly contaminated gull population [J]. Science of Total Environment, 2016,545:289-298.
[26]Dingemans M M L, van den Berg M, Westerink RHS.Neurotoxicity of brominated flame retardants: (in) direct effects of parent and hydroxylated polybrominated diphenyl Ethers on the (Developing) Nervous System [J]. Environmental Health Perspectives, 2011,119(7):900-907.
[27]Sandler B, Webb P, Apriletti J W. Thyroxine-thyroid hormone receptor interactions [J]. Journal of Biological Chemistry,2004,279(53):55801-55808.
[28]Arukwe A, Jenssen B M. Differential organ expression patterns of thyroid hormone receptor isoform genes in p.p’-DDE-treated adult male common frog Rana temporaria [J]. Environmental Toxicology and Pharmacology, 2005,20:485-492.
[29]Scarlett A, Parsons M P, Hanson P L, et al. Thyroid hormone stimulation of extracellular signal-regulated kinase and cell proliferation in human osteoblast-like cells is initiated at integrin V 3[J]. Journal of Endocrinology, 2008,196(3):509-517.
[30]Cohen K, Ellis M, Khoury S. Thyroid hormone is a MAPK dependent growth factor for human myeloma cells acting via αvβ3integrin [J]. Molecular Cancer Research, 2011,9:1385-1394.
[31]Ashida R, Tominaga K, Sasaki E, et al. AP-1and colorectal cancer [J]. Inflammopharmacology, 2005,13:113-125.
[32]Augustine A, Bjørn M J. Differential organ expression patterns of thyroid hormone receptor isoform genes in p, p’-DDE-treated adult male common frog, Rana temporaria [J]. Environmental Toxicology and Pharmacology, 2005,20:485—492.
[33]Shi X Y, Liu C S, Wu G Q, et al. Waterborne exposure to PFOS causes disruption of the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Chemosphere, 2009,77:1010-1018.
[34]Wu Y F, Koenig R J. Gene regulation by thyroid hormone [J].Trends in Endocrinology Metabolism, 2000,11:207-211.
[35]邱志群.邻苯二甲酸二丁酯和苯并[a]芘对大鼠睾丸支持细胞的联合毒性研究 [D]. 重庆:第三军医大学, 2008.
[36]Cohen-Armon M. PARP-1activation in the ERK signaling pathway [J]. Trends in pharmacological sciences, 2007,28(11):556-560.
