壬基酚对羊角月牙藻的毒性效应研究
2018-06-25刘伟杰吴孝情鄢佳英段舜山暨南大学水生生物研究中心广东广州506环境保护部华南环境科学研究所广东广州50655宜春学院生命科学与资源环境学院江西宜春6000
刘伟杰 ,吴孝情,鄢佳英,何 宁,陈 琪,段舜山* (.暨南大学,水生生物研究中心,广东 广州 506;.环境保护部华南环境科学研究所,广东 广州 50655;.宜春学院,生命科学与资源环境学院,江西 宜春 6000)
烷基酚聚氧乙烯醚(APEOs)是目前全球第二大类非离子表面活性剂,常用于洗涤剂、纺织、造纸、医药和化妆品行业中[1].APEOs产品中80%是壬基酚聚氧乙烯醚(NPEO),在废水处理厂中NPEO被分解为壬基酚(NP),最终排放到江河、湖泊、海洋等水域生态系统中[2].而壬基酚具有极强的稳定性和抗降解能力,使其在水域生态系统中能够长期残留[3].最近的十几年中,在我国不同地区不同水域壬基酚均被频繁检出. 如青岛胶州湾水域表面水和固体悬浮物中的存在量为20.2~269ng/L 和 17.2~77.5ng/L[4];黄河兰州河段水体中壬基酚含量为 34.2~599ng/L[5];珠江入海口处水域水体中壬基酚含量为 233.04~3352.86ng/L[6].随着壬基酚的广泛应用其对水域生态系统的威胁有可能日趋严重[7-8].
壬基酚是公认的内分泌干扰物,能够模拟天然雌激素与雌激素受体相互作用,干扰水生动物的内分泌系统,对生殖系统具有明显负效应[9].唐思等[10]的研究表明 NP对多刺裸腹溞(Moina Macrocopa)可产生毒性增强的代际效应,对其生长繁殖产生严重干扰;孙凯峰[11]研究指出壬基酚对枝角类浮游动物具有很强的毒性效应,而微藻对壬基酚具有高富集效应;此外,壬基酚对鱼类的生长发育、求偶行为[12]、性腺发育[13]及相关激素调控基因的表达都有不良影响[14];何宁等[15]认为NP集生物毒性、内分泌干扰性、存在持久性和生物积累性于一体,对水域生态系统和人类健康具有严重威胁.NP进入水体后必将对浮游藻类产生影响,同时由于藻类对于污染物具有富集作用[16],能够将环境中残留的NP进行浓缩,经摄食行为进入食物网中各营养级生物体内产生不良效应.
浮游植物在水域生态系统中具有十分重要的地位和作用,作为水域生态系统的初级生产者,其种类的多样性和初级生产力会直接影响到整个系统的结构功能及健康水平,常作为研究不同水体中污染物毒性效应的指示生物[17].然而,关于壬基酚(NP)对于浮游藻类的毒性效应方面的报道并不充足.Correa-Reyes等[18]报道了 NP对海洋微藻,球等鞭金藻 (Isochrysis galbana)的毒性效应,发现NP浓度在1mg/L时能够完全抑制其光合效应;而 Gao等[19]研究发现,普通小球藻(Chlorella vulgaris)对 NP具有较高的耐受性,在经受1mg/L处理时,整个抗氧化酶系均处于激活状态,含量及活性大幅升高,而四尾栅藻(Scenedesmus quadricauda)则表现为抑制效应.羊角月牙藻(Selenastrum capricornutum)是淡水水体中常见绿藻,对污染胁迫十分敏感,因此成为水生生态毒理研究的模式生物(ISO 8692-1989)[20].目前关于 NP暴露于羊角月牙藻的相关报道,只有 Gao等[21]曾在研究中指出羊角月牙藻在 NP暴露下过氧化氢酶(CAT)和还原型谷胱甘肽(GSH)的活性先升高后降低,最大光能转化效率(Fv/Fm)逐渐下降,热耗散(DI0/RC)小幅度上升.然而 NP暴露下,羊角月牙藻光系统各参数的响应方面的了解仍不够全面.因此本研究选取羊角月牙藻作为受试对象,了解其在 NP暴露处理下的生长情况、光合色素含量、抗氧化系统的响应情况,并通过荧光诱导动力学参数指标,进一步探讨壬基酚(NP)暴露对浮游植物的毒害效应及影响.以期为进一步了解 NP对浮游藻类的作用特点提供实验依据和研究基础,并为 NP在水域生态系统中的风险评估提供补充.
1 材料与方法
1.1 实验材料
壬基酚(Nonyphonel,NP)为分析纯,纯度>99%,购自 Sigma公司,配置高浓度母液所用的助溶剂为丙酮(广州化学试剂厂).
受试藻种羊角月牙藻(Selenastrum capricornutum)为暨南大学水生生物研究中心藻种室提供.藻种于玻璃三角瓶中置于人工气候光照培养箱中静置培养,培养温度(23±1)℃,光照强度 80µmol/(m2·s),光暗周期 12h:12h,每日定期摇晃三角瓶 3次,并随机改变三角瓶位置.实验周期开始前,经过两周时间对藻种活化及扩大培养,选取处于对数生长期的羊角月牙藻用于实验.
1.2 生长实验设计
BG11培养基经高压蒸汽灭菌冷却后,分装于 150mL玻璃三角瓶中,每瓶 100mL.选取对数生长期羊角月牙藻(S.capricornutum)进行接种,初始接种浓度为1.5×105cells/mL.NP的工作液由储备液由培养基稀释得到,根据预实验设置浓度梯度分别为:0.1,0.3,0.6,0.9,1.2mg/L.每个处理(含对照组)设置3个平行重复,助溶剂丙酮添加量不高于0.1%.加入稀释液混匀后置于原培养条件下96h,每 24h取样,通过细胞计数绘制生长曲线并计算比生长速率(µ)[22].
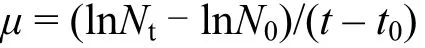
比生长速率(µ)以羊角月牙藻细胞数均值为基础数据,按照下面公式进行计算:式中:Nt和N0分别为t(24h、48h、72h、96h)时刻和 t0(初始接种)时的藻细胞数.在比生长率速率基础上,采用概率单位-浓度对数法绘制曲线,根据线性回归方程计算 96h的半数抑制浓度(EC50).
1.3 叶绿素测定
测定不同浓度处理下NP暴露对羊角月牙藻叶绿体色素含量的影响[23].取 10mL暴露处理96h后的羊角月牙藻藻液,经高速冷冻离心机4℃,5000g离心15min,弃上清液,加入5mL抽提液(丙酮:乙醇=1:1),震荡摇匀之后,4℃黑暗静置24h后,同条件离心 15min,取上清液,用紫外-可见光分光光度计测定440nm,645nm,663nm波长下上清液的吸光值,以抽提液作为空白对照,参照以下公式计算叶绿素a(chl a),叶绿素b(chl b)和类胡萝卜素(Car)含量(mg/L)[24]:
叶绿素a(chl a)=12.7OD663—2.69OD645
叶绿素b(chl b)= 22.9OD645—4.68OD663
类胡萝卜素(Car)=4.7OD440—0.27(chl a+chl b)
1.4 叶绿素荧光诱导动力学参数的响应研究
取 2mL藻液转移至专用测量小瓶,于暗箱中暗适应 30min后,利用植物效率仪(Handy PEA, Hansatech,英国)在室温下进行测定叶绿素荧光诱导动力学参数,由 3000µmol/(m2·s)的连续光诱导,荧光信号记录从 10µs开始,至 2s结束[23].叶绿素荧光动力学相关参数的意义及计算公式如表1.

表1 快速叶绿素荧光诱导动力学参数Table 1 Parameters in the analysis of the O-J-I-P fluorescence transient
1.5 抗氧化酶活性的测定
超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量以及可溶性蛋白含量用南京建成公司相应的试剂盒进行测定.
1.6 统计分析
实验数据采用 Origin 8.0整理并制图,统计分析采用SPSS 13.0,单因素方差分析(One way -ANOVA)中的多重比较(Duncan)来检验各组之间差异的显著性,P<0.05为显著性差异.
2 结果与讨论
2.1 NP暴露对羊角月牙藻生长的影响
如表2所示,壬基酚对羊角月牙藻96h EC50为 0.979mg/L,根据标准及相关文献报道,其风险指数(RI)>1,属于高毒性污染物[25].壬基酚暴露胁迫处理下,对羊角月牙藻的生长影响如图1所示.初始的 24h暴露时期,壬基酚暴露对羊角月牙藻生长表现为抑制效应,处理组的藻细胞数较对照下降了27.3%~47.2%;48h暴露后,0.1mg/L处理组细胞密度略高于对照组(上升 4.1%),表现出一定程度的毒物兴奋效应,其他浓度(≥0.3mg/L)壬基酚处理组的羊角月牙藻则表现为抑制效应,藻细胞数较对照下降了14.2%~44.2%;经过72h和96h暴露处理后,除最低处理组外,其他浓度(≥0.3mg/L)壬基酚处理组的羊角月牙藻则始终表现为抑制效应,藻细胞数较对照组相比,分别下降了5.8%~35.3%和 8.9%~49.1%.由以上结果可见,壬基酚可影响羊角月牙藻细胞增殖,抑制种群的增长,具有潜在风险.

表2 NP暴露处理对羊角月牙藻96h EC50Table 2 96h acute toxicity of NP on Selenastrum capricornutum

图1 羊角月牙藻生长对NP暴露处理的响应Fig.1 Growth response of S.capricornutum to NP treatments
虽然关于NP对微藻产生不良效应相关报道并不十分完善,但可以确定微藻对毒性物质有高度的种类特异性响应[21].研究结果表明斜生栅藻(Scenedesmus obliquus)、四尾栅藻 (Scenedesmus quadricauda)、蛋白核小球藻(Chlorella pyrenoidosa)、肥壮蹄形藻(Kirchneriella obesa)和月牙藻(Pseudokirchneriella subcapitata)等淡水种类绿藻的 96h EC50在 0.82 — 3.33mg/L[11],而中肋骨条藻(Skeletonema costatum)和旋链角毛藻(Chaetoceros curvisetus)的 96h EC50仅为0.13mg/L和 0.22mg/L[26],微小小环藻(Cyclotella caspia)的 96h-EC50也仅有 0.18mg/L[27].虽然 NP在环境中的检出浓度一般在“µg/L”级以下水平,而对微藻产生产生干扰效应的浓度在 100µg/L以上[18],造成急性毒性的浓度在 0.13~3.33mg/L,但是微藻对于环境中NP具有很强的富集积累能力, 能够在短时间内将环境中残留的“µg/L”级以下水平的进行 NP浓缩.研究表明球等鞭金藻(Isochrysis galbana)[18]、蛋白核小球藻 (Chlorella pyrenoidosa)[20]和团集刚毛藻(Cladophora glomerata)[2]对 NP的富集系数(BCF)分别为6940,7393和10000,这意味着实际作用于微藻细胞的NP浓度已经远高出最低效应浓度(LOEC),并将通过食物链逐级传递放大,进入高营养级生物甚至人类体内,产生不良效应.
2.2 NP暴露胁迫下羊角月牙藻的光合色素变化
如图 2所示,NP暴露处理能够影响羊角月牙藻体内光合色素含量,与对照组相比,NP暴露处理在0.1mg/L时,可诱导叶绿素a(chl a)和叶绿素b(chl b)含量下降7.1%和25.8%,类胡萝卜素(Car)含量上升16%,其中chl b和Car变化程度显著;随着NP处理浓度的上升,0.3mg/L处理组叶绿素含量进一步下降,chl a下降18.8%,chl b下降35.5%,Car含量再次显著升高 26.5%,当处理浓度达到0.6mg/L时,羊角月牙藻叶绿素a(chl a)的含量也出现了明显降低,降低程度为22.3%,此时Car含量又一次表现出显著升高,较对照增加了 4倍以上;处理浓度增至 0.9mg/L时,chl a含量再次显著下降(31.3%),Car含量高于对照组4.5倍,由此可知,NP暴露处理对于羊角月牙藻的光合色素有着不良影响,能够造成主要光合色素(叶绿素)含量下降,辅助色素(类胡萝卜素)含量上升,说明这种胁迫对其光合作用性能已产生胁迫效应.

图2 不同浓度NP暴露胁迫下羊角月牙藻叶绿素a、叶绿素b和类胡萝卜素的含量Fig.2 Contents of chl a, chl b and carotenoids of S.capricornutum after exposure in different NP concentrations treatments
2.3 NP胁迫对羊角月牙藻光系统II(PSII)的影响
图 3显示 NP可以使最大光能转化效率(Fv/Fm)显著下降,在1.2mg/L浓度下,Fv/Fm下降幅度最大,为对照组的 66.7%.这说明羊角月牙藻PSⅡ对NP暴露处理十分敏感,0.1mg/L浓度就可以造成最大光能转化效率(Fv/Fm)的显著下降,而 PSⅡ中光能转化效率受损必将对羊角月牙藻的正常生长增殖产生不良影响.

图3 不同浓度NP暴露处理下羊角月牙藻的最大光能转化效率(Fv/Fm)Fig.3 Fv/Fm of S.capricornutum after exposure in different NP concentrations treatments
如图4所示,0.1mg/L浓度NP处理组参数与对照组相比几乎无差异;当处理浓度达到0.3mg/L时,ABS/RC(单位反应中心吸收光能)显著上升,DI0/RC(单位反应中心耗散能量)、ET0/RC(单位反应中心捕获用于电子传递的能量)、TR0/RC(反应中心用于还原 QA 的能量)也随之升高,整体来看,虽然单位反应中心吸收的光能大幅增加,但是耗散能量和消耗能量也随之增加,光合效率降低,同时光合性能指数(PI)开始出现显著下降;随着处理浓度的升高,羊角月牙藻PSⅡ反应中心活性在 0.6mg/L时达到峰值,反应中心吸收的光能(ABS/RC)值达到最大值,反应中心捕获电子用于还原QA的能量ET0/RC和用于电子传递的能量TR0/RC也相应上升,但PI依旧显著降低,说明其 PSⅡ反应中心已受到损伤;0.9mg/L浓度处理下,TR0/RC开始出现显著下降,反应中心用于其他电子受体的能量大幅增加;处理浓度增至1.2mg/L后,DI0/RC出现了显著升高,这表明以热能等其他形式进行耗散的反应中心吸收的光能比例大幅度上升.
Correa-Reyes等[18]认为NP降低藻类的光合性能的可能途径有两条,一种是改变天线色素(antenna size)即chl a含量降低;另一种则是降低光能吸收效率或降低吸收光能的利用率,使其以热能等方式耗散.在本研究中,在 NP暴露处理下chl a降低十分明显,光合色素含量变化显著,这与诸多报道结果相一致[11,22,29-30].光合色素(主要为chl a)含量下降,能够减少藻细胞对光能的吸收及利用,光合作用效率降低必将影响到藻类的生长增殖.Fv/Fm(最大光能转化效率)是衡量光合性能的主要参数,也是直接表现微藻光合作用效率的重要指标[31].本研究中,在NP作用下羊角月牙藻的 Fv/Fm 随着处理浓度的增加而降低,说明NP能够降低其光合性能,对其生长产生抑制.三角褐指藻 (Phaeodactylum tricornutum)在NP的胁迫下,光合性能出现显著下降[22]. Srivastava等[33]认为胁迫诱导下Fv/Fm的下降,是一种光系统在胁迫条件下的短期响应,可能是微藻在光能吸收与利用之间重新构建的平衡关系,以使受到的损伤降到最低.通过叶绿素荧光诱导动力学相关参数,可以进一步了解化学胁迫处理下,藻细胞光系统的响应情况[34].相关研究指出,NP暴露处理小球藻(Chlorella vulgaris),可以引起光能吸收下降,ABS/RC参数降低,并认为这是小球藻(Chlorella vulgaris)在胁迫条件下捕光复合物和光系统活性反应中心之间短期内形成的新的平衡,其研究结果也表明在 96h处理后,小球藻(Chlorella vulgaris)的各项测试指标已恢复到正常水平[32].而在本研究中,羊角月牙藻在NP处理后,ABS/RC参数显著上升,表明系统吸收的光能开始增加,但是光合性能(PI)并未出现显著增高,反而在高浓度NP处理下显著降低,同时DI0/RC表现出明显增加,热能等形式耗散的能量上升,这一点也正说明在 NP胁迫下,羊角月牙藻的捕光复合物与光系统活性反应中心的连通性受损,造成吸收的光能并不能有效的进行利用.王晶晶[29]的文献报道中也对此现象表示相同的观点,同时指出虽然JIP测试能够相对全面的了解NP胁迫下微藻细胞光系统性能参数,但是由于光合作用的复杂性,污染物对微藻的毒性效应具体进程仍需要更深层次的研究.
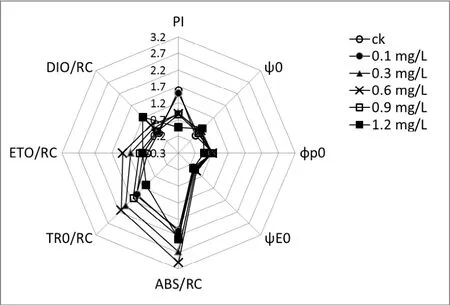
图4 NP处理后羊角月牙藻的各JIP-测定参数的响应变化Fig.4 Changes of each selected JIP-test parameters in S.capricornutum after exposure in different NP concentrations treatments
2.4 NP暴露胁迫下羊角月牙藻膜的脂过氧化
NP处理胁迫下,会引起藻细胞膜系统的损伤,造成细胞膜脂过氧化,甚至破坏膜系统的完整性.丙二醛(MDA)是膜脂过氧化的产物之一,其含量可以说明藻细胞膜脂过氧化的程度[13].如图 5所示,NP暴露胁迫诱导羊角月牙藻MDA含量增高,当处理浓度为0.3mg/L,MDA含量增加到对照组的 2倍,达到显著水平,当处理浓度增至0.9mg/L和1.2mg/L时,MDA含量再次显著增加,分别达到对照组的3倍和5倍.这表明壬基酚浓度与藻细胞膜脂过氧化程度成正比,浓度越高膜质损伤程度越强,膜系统完整性受到破坏.

图5 NP处理胁迫后羊角月牙藻的丙二醛含量Fig.5 Contents of MDA in S.capricornutum after exposure in different NP concentrations treatments
2.5 NP胁迫下羊角月牙藻SOD与CAT的响应
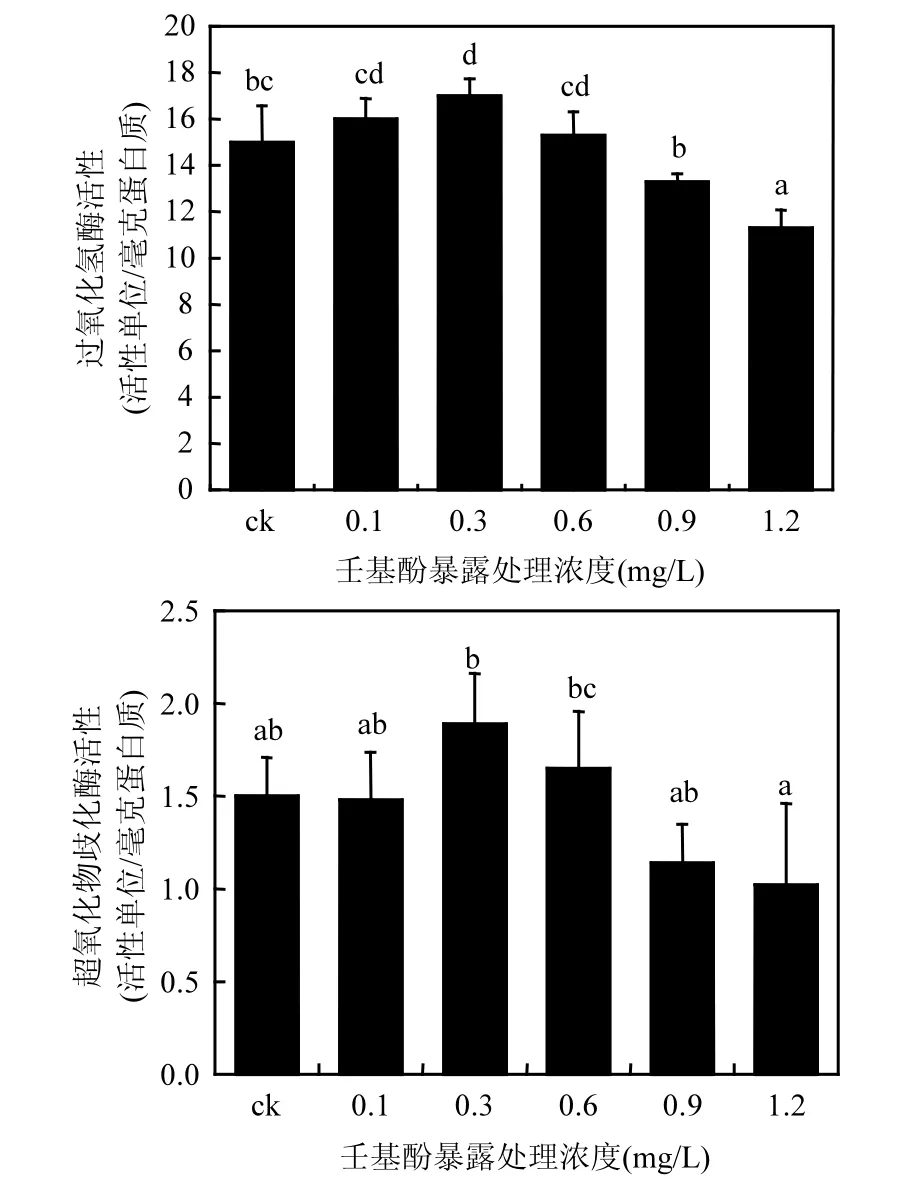
图6 NP对羊角月牙藻CAT和SOD活性的影响Fig.6 Effects of NP on activities of CAT and SOD in S.capricornutum after exposure in different NP concentrations treatments
如图6所示,NP对羊角月牙藻细胞超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性效应.NP浓度在0.3mg/L和0.5mg/L时,羊角月牙藻的SOD酶活性上升了26% 和10%,诱导刺激效应十分明显,随着处理浓度的升高,在高浓度(≥0.9mg/L)下,SOD 酶活性开始降低;浓度增至1.2mg/L时,SOD明显下降为对照组活性的68%.CAT变化趋势与SOD基本相同,活性随NP处理浓度的增加其活性先升高后降低.在0.1mg/L时,CAT活性较对照组升高了 6.7%,在0.3mg/L时,活性增加达到显著程度,增长到对照组的 113%,而后随着处理浓度的增加活性开始降低,在0.9mg/L时活性显著下降,降低至对照组活性的88.7%,处理浓度增至1.12mg/L,降低程度到达对照组的75.3%,显著性进一步增加.综上,羊角月牙藻体内SOD和CAT对NP暴露处理表现出低浓度处理活性上升,高浓度胁迫活性降低的整体趋势,相较而言,SOD活性波动程度较 CAT的活性变化更加剧烈.
一般来说,当藻细胞受到化学胁迫时,其叶绿体和线粒体中的电子传递状态会发生改变,胞内的能量体系将形成一个暂时的新的平衡状态,在这个过程中将会产生对细胞造成氧化胁迫的活性氧(ROS),例如超氧化物、过氧化氢和超氧自由基等[34].针对这些活性氧物质,微藻自身的抗氧化系统能够启动一系列抗氧化酶对其进行清除,以维持细胞正常的代谢和生长增殖[37].在活性氧物质的氧化胁迫下,藻细胞生物膜中的不饱和脂肪酸将形成脂质过氧化产物,丙二醛(MDA),其含量的高低可以大体反映膜质过氧化损伤的程度[35].本研究结果中,MDA的含量随着 NP处理浓度的增加而升高,说明羊角月牙藻细胞膜系统在NP胁迫下受到了损伤.目前来说,关于微藻体内抗氧化系统的研究表明,污染物胁迫下,CAT和SOD等抗氧化酶的活性会受到诱导激活,并表现出酶活性先增强后减弱的趋势[36].在本研究中,两者的活性也表现出随着NP处理浓度升高而先激发后抑制的显著趋势.Wang[37]研究NP的毒性效应时,也得到了一致的结果,并指出,当低剂量的毒性物质刺激藻细胞产生额外的活性氧物质,以此为底物的SOD瞬时受到诱导而活性迅速增加对其进行猝灭,而当毒性物质剂量上升到其催化阈值,甚至超过最大催化能力时,过量的活性氧将破坏酶结构,表现出活性下降.CAT在催化处理过氧化氢时也表现出同样的趋势.这同时也能够说明 MDA含量在中高剂量表现出显著差异的原因:中高剂量的 NP胁迫产生的活性氧接近或超过抗氧化酶系阈值后,无法减少 ROS的积累,造成膜质过氧化程度进一步加深.而不同种类的抗氧化酶系本身的阈值“因藻而异”,因此不同种类的微藻受到同种污染物胁迫时,表现出不同的抗性或敏感性.
3 结论
3.1 壬基酚对羊角月牙藻的生长具有抑制作用,96h EC50为 0.979mg/L,根据标准及相关文献报道,其风险指数(RI)>1,属于高毒性污染物,对于水生生物存在潜在威胁.
3.2 壬基酚对羊角月牙藻光合色素的含量及构成具有显著影响,能够降低叶绿素含量,增加类胡萝卜素合成;同时对光系统Ⅱ各参数产生显著干扰,降低光能转化效率,能量耗散增加.
3.3 壬基酚暴露处理能够破坏羊角月牙藻膜系统,并对抗氧化系统产生影响,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性表现出随着处理浓度增加而先升高后下降的趋势.
综上,壬基酚暴露处理对羊角月牙藻的生长、光合色素含量、光系统效率以及抗氧化酶生成均具有明显的干扰作用.
[1]Ying G G, Williams B, Kookana R. Environmental fate of alkylphenols and alkylphenol ethoxylates--a review [J].Environment International, 2002,28(3):215-26.
[2]周自坚,虢清伟,王 丽,等.壬基酚聚氧乙烯醚在印染废水处理工艺中的去除研究 [J]. 环境工程学报, 2014,8(8):3107-3113.
[3]连 静,刘俊新. NPEOs及其代谢产物在城市污水处理厂中的归趋分析 [J]. 环境科学, 2012,33(9):3295-3300.
[4]Fu M, Li Z, Gao H. Distribution characteristics of nonylphenol in Jiaozhou Bay of Qingdao and its adjacent rivers [J]. Chemosphere,2007,69(7):1009-16.
[5]Xu J, Wang P, Guo W, et al. Seasonal and spatial distribution of nonylphenol in Lanzhou Reach of Yellow River in China. [J].Chemosphere, 2006,65(9):1445-1451.
[6]Diao P, Qi C, Rui W, et al. Phenolic endocrine-disrupting compounds in the Pearl River Estuary: Occurrence,bioaccumulation and risk assessment [J]. Science of the Total Environment, 2017,s584—585:1100-1107.
[7]向昆仑.壬基酚、辛基酚、双酚A在珠江口水生动物体内的积累特征 [D]. 广州:暨南大学, 2015.
[8]陈慰双.我国水环境中壬基酚的污染现状及生态风险评估 [D].青岛:中国海洋大学, 2013.
[9]吴天伟,孙 艺,崔 蓉,等.内分泌干扰物壬基酚与辛基酚的污染现状与毒性的研究进展 [J]. 环境化学, 2017,36(5):951-959.
[10]唐 思,刘伟杰,段舜山.壬基酚对多刺裸腹溞连续世代的毒性效应 [J]. 生态毒理学报, 2016,11(2):275-282.
[11]孙凯峰.环境激素壬基酚对枝角类浮游动物的生殖干扰效应研究 [D]. 广州:暨南大学, 2012.
[12]夏继刚,牛翠娟,傅俊华,等.壬基酚对斑马鱼求偶行为的生态毒理效应 [J]. 水生生物学报, 2012,36(6):1142-1148.
[13]夏继刚,牛翠娟,高 颖,等.壬基酚长期暴露对斑马鱼雄鱼第二性征、精子活力的影响 [J]. 生态毒理学报, 2010,5(1):44-49.
[14]刘晓丽,汪 奇,贾林芝,等.壬基酚对斑马鱼精巢组织及性激素合成酶基因表达的影响 [J]. 环境科学学报, 2011,31(11):2523-2529.
[15]何 宁,刘伟杰,孙 东,等.典型环境激素壬基酚对水产品安全性的影响 [J]. 生态科学, 2013,32(5):654-659.
[16]孙凯峰,孙 东,綦世斌,等.壬基酚对浮游生物的毒性效应及其食物链传递研究 [J]. 中国环境科学, 2016,36(12):3816-3823.
[17]谢 菁,区又君.微藻在水域生态系统中的作用 [J]. 海洋与渔业, 2007,(7):26-28.
[18]Correa-Reyes G, Viana M T, Marquez-Rocha F J, et al.Nonylphenol algal bioaccumulation and its effect through the trophic chain. [J]. Chemosphere, 2007,68(4):662-670.
[19]Gao Q T, Wong Y S, Tam N F Y. Antioxidant responses of different microalgal species to nonylphenol-induced oxidative stress [J]. Journal of Applied Phycology, 2017,29(3):1317-1329.
[20]苏 甜,李义刚,欧瑞康,等.镉离子对羊角月牙藻光合作用及其抗氧化酶的毒性影响 [J]. 生态科学, 2014,33(2):301-306.
[21]Gao Q T, Tam N F. Growth, photosynthesis and antioxidant responses of two microalgal species, Chlorella vulgaris and Selenastrum capricornutum, to nonylphenol stress [J].Chemosphere, 2011,82(3):346-54.
[22]李 根,管 超,安 民,等.壬基酚对三角褐指藻的毒性效应及其机理 [J]. 生态科学, 2013,32(3):298-302.
[23]周静韵,段舜山.全氟辛酸和全氟壬酸对两种海洋微藻的联合毒性效应 [J]. 生态科学, 2016,35(6):84-90.
[24]王学奎.植物生理生化实验原理和技术. [M]. 2版.北京:高等教育出版社, 2006.
[25]刘 娜,金小伟,王业耀,等.我国地表水中药物与个人护理品污染现状及其繁殖毒性筛查 [J]. 生态毒理学报, 2015,10(6):1-12.
[26]刘 霞,赵 静,但丽霞,等.壬基酚对胶州湾典型微藻的毒性效应 [J]. 海洋环境科学, 2012,(5):45-51.
[27]代晓康.壬基酚(NP)对微小小环藻的毒性及其生物降解研究[D]. 广州:中山大学, 2005.
[28]Ahel M, Mcevoy J, Giger W. Bioaccumulation of the lipophilic metabolites of nonionic surfactants in freshwater organisms [J].Environmental Pollution, 1993,79(3):243.
[29]王晶晶.双酚 A和壬基酚对青岛大扁藻的复合干扰效应研究[D]. 广州:暨南大学, 2013.
[30]周 峰,刘训财,厉以强,等.壬基酚胁迫对莱茵衣藻的生理影响[J]. 生态与农村环境学报, 2013,29(1):87-90.
[31]曾晓鹏,夏建荣.光强对两种硅藻光合作用、碳酸酐酶和RubisCO活性的影响 [J]. 水生生物学报, 2015,39(2):368-374.
[32]姜智飞,窦 勇,张文慧,等.AHLs对小球藻 PSⅡ光化学活性与光合作用关键酶的影响研究 [C]//微藻与水族高峰论坛, 2017.
[33]Srivastava A, Guissé B, Greppin H, et al. Regulation of antenna structure and electron transport in Photosystem II of Pisum sativum, under elevated temperature probed by the fast polyphasic chlorophyll a, fluorescence transient: OKJIP [J].Biochimica et biophysica acta. Bioenergetics, 1997,1320(1):95-106.
[34]李 藩,李仁辉,于晓章,等.小麦麸皮水浸提液对铜绿微囊藻(Microcystis aeruginosa)光合色素含量和叶绿素荧光诱导动力学的影响 [J]. 湖泊科学, 2013,25(3):373-377.
[35]陈 花,吴俊林,李晓军.叶绿体中活性氧的产生和清除机制 [J].现代生物医学进展, 2008,8(10):1979-1981.
[36]张容芳,唐东山,刘 飞.藻类抗氧化系统及其对逆境胁迫的响应 [J]. 环境科学与管理, 2011,36(12):21-25.
[37]Wang J, Xie P, Guo N. Effects of nonylphenol on the growth and microcystin production of Microcystis strains [J]. Environmental Research, 2007,103(1):70-78.
