傀儡湖沉积物-水界面硝酸盐异养还原过程研究
2018-06-25薛惊雅姜星宇姚晓龙中国科学院大学北京100049中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室江苏南京210008
薛惊雅 ,姜星宇 ,姚晓龙 ,李 敏 ,张 路 (1.中国科学院大学,北京 100049;2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008)
氮是湖泊、河流等水生生态系统的重要营养组分,其含量的变化势必会影响到水生生态系统结构和功能的稳定[1-2].过高的氮负荷致使水质不断恶化,引起水体富营养化,扩大水体缺氧面积,最终导致蓝藻水华的频繁暴发[3-4].此外,大量研究表明,在总氮含量保持不变的情况下,氮的不同形态组成及形态变化对水域生态系统健康具有重要影响[5].氨氮和硝酸盐是水域生态系统中主要的无机氮形态,氨氮在有氧条件下可通过微生物作用被氧化为硝酸盐(硝化过程);硝酸盐在无氧状态下经反硝化细菌可被还原为氮气,释放出水体,达到脱氮的目的[6].然而,越来越多的研究发现[7-8],硝酸盐在还原为氮气的过程中,还存在与反硝化作用相反的硝酸盐还原过程——硝酸盐异养还原为氨(DNRA).
反硝化及DNRA过程是水体中硝酸盐还原的两个主要过程[6].虽然这两个过程都属于硝酸盐的还原过程,但两个过程最终对硝酸盐的转化结果却大相径庭.反硝化过程是以有机质作为电子供体将硝酸盐还原为氮气的过程[8],而 DNRA过程是将硝酸盐还原为铵根离子,继续以生物可利用的形式存在于水体中[6].两个过程都是以硝酸根作为反应底物,所以DNRA过程和反硝化过程之间存在竞争关系.有大量的文献报道硝酸盐异氧还原过程与其影响因子的关系.Deng等[9]研究了长江口沉积物中硝酸盐异氧还原过程,认为有机质浓度、硫化物是主要影响因子.Song等[10]对东海沉积物的研究发现溶解氧和有机质是主要的影响因子.此外,也有研究认为沉积物含水率、温度是影响反硝化和DNRA过程的主要因子[11-12].然而,目前已有的研究对淡水湖泊生态系统硝酸盐异养还原过程的研究还相对较少,对水体中硝酸盐的归趋转化途径认识不足.因此,研究不同环境条件下反硝化过程与DNRA过程的相对强弱、不同环境因子的作用及硝酸盐最终的转化归趋,对评估水体未来的氮素含量、制定合理的控制思路具有重要意义.
太湖流域是长江三角洲的核心区域,也是中国人口密度最大的区域之一.经济快速发展的同时,也促使大量的无机氮进入太湖流域的众多湖泊及河流,引起严重的水体污染问题[13].氮污染是该区域最为严重的环境问题之一.本研究以太湖流域的傀儡湖为研究对象,采用近年来新兴的OX/MIMS方法快速测定15N标记的硝酸盐在泥浆中的异化还原过程,快速测定15NH4+-N浓度,计算得DNRA速率;反硝化速率需结合同位素示踪技术获得.本研究旨在比较傀儡湖硝酸盐异养还原过程中DNF和DNRA的相对贡献率及可能的环境因素对其产生的影响,对傀儡湖中的硝酸盐的转化与归趋过程有全面的了解.此外,本研究弥补了国内淡水生态系统中硝酸盐异养还原过程研究的空缺,为太湖流域其他河流、湖泊的硝酸盐异养还原过程的研究提供了参考.
1 材料与方法
1.1 研究区域
傀儡湖(31°21′~31°30′N,120°39′~120°51′E)位于太湖流域下游,是昆山市的封闭型湖泊水源地.湖面呈椭圆形,南北最长端 4.80km,东西最宽处为2.48km,湖面面积为6.73km2,多年平均水位2.93m,蓄水量 10×106m3.傀儡湖容积较小,湖体中部水浅底平,属吞吐形的小型湖泊,西北侧与阳澄湖相邻,并通过野尤泾和箱涵(暗渠)承接阳澄湖来水,由庙泾河作为出湖河道.上游来水、农业面源污染、养殖污染曾是傀儡湖水体污染的主要原因,其中大量使用农药、氮肥导致的面源污染是湖泊水源地的主要污染源[14].自上世纪九十年代开始,昆山市从傀儡湖的功能定位出发,提出“点面源控制、上下游结合”的一体化水污染控制策略,湖泊管理模式由资源利用管理过渡到资源保护管理.在这些控制对策的作用下,在这些控制对策的作用下,傀儡湖总氮、总磷浓度得到有效控制,但富营养化响应指标叶绿素a的浓度不降反升,这说明傀儡湖的生态环境安全仍存在很大风险[15].
1.2 样品采集和处理
本研究根据傀儡湖出入湖、不同水深、植被覆盖及取水口等关键点,选取10个具有代表性的采样点来覆盖整个湖区面积(图1).样品采集分别于2011年7月和2016年7月完成.2011年采集样品通过流动培养用于傀儡湖沉积物基本参数的调查及沉积物-水界面营养盐通量的计算,具有培养方法详见徐徽等[16],在预培养完成后,采集培养系统的进出水样经孔径 0.2µm 醋酸纤维滤膜过滤后测定溶解性无机氮含量,用于沉积物-水界面无机氮通量的计算;2016年数据用于潜在反硝化和DNRA过程的研究.所取表层沉积物样品(0~10cm) 密封在无菌自封袋中,并在 4℃下保存,用10L聚乙烯桶来采集现场水样,用于室内培养实验.
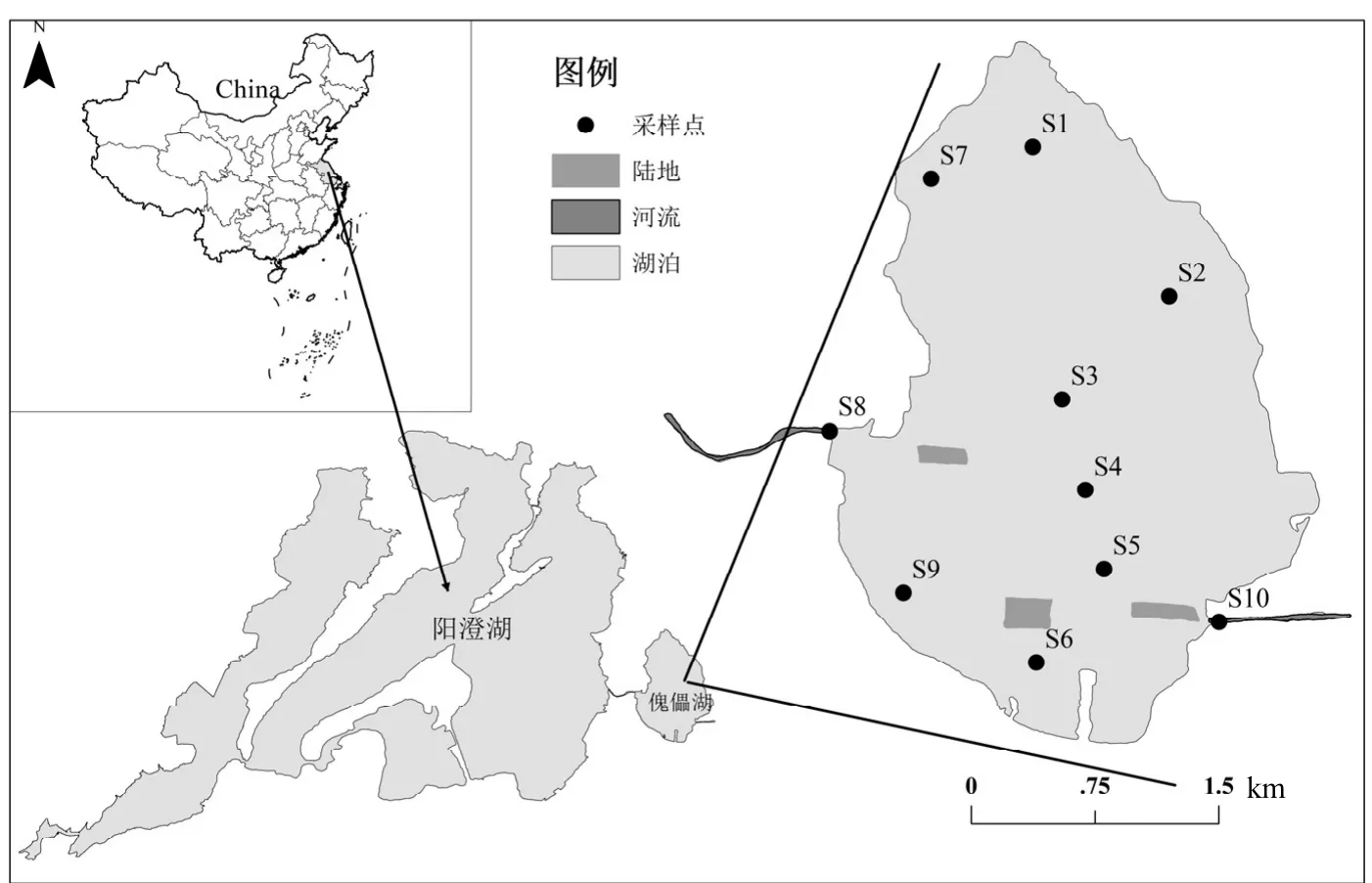
图1 傀儡湖采样点分布Fig.1 Location of the sampling sites in Lake Kuilei
1.3 室内培养实验
将采集好的样品带回实验室,用氩气吹扫自封袋中采集到的沉积物,并搅拌均匀,同时将采集回来的现场水样用氩气吹扫30min以达到去除水样中溶解的同位素气体(29N2、30N2)的目的.将每个点位已均质化的沉积物30g与300mL现场采集来的经过净化的水样充分混合形成泥浆,并在氩气吹扫下将泥浆净化20min.混合后的泥浆被分装到8个12mL的labco气密瓶中,确保瓶中无气体残留后用带橡胶垫的瓶盖封紧,以防止大气中的气体对其产生污染.首先进行 24h的预培养以消耗泥浆中残留的硝酸盐、亚硝酸盐以及氧气[9].预培养完成后,在每个labco瓶中注入15NO3-(最终浓度约为100µmol/L).每个点位取其中的2个labco瓶注入0.1mL的饱和ZnCl2溶液作为初始样品,剩下的泥浆在200r/min的摇床上培养10h分别用于反硝化过程和DNRA过程的测定分析.培养完成后,在剩下的泥浆样品中也分别加入 0.1mL的饱和ZnCl2溶液以结束反应过程.其中的3个样品待泥浆沉降后用于反硝化过程的测定,剩下的 3个样品再次经过氩气吹扫30min以去除培养过程中由于反硝化过程或/和厌氧氨氧化过程产生的29N2和30N2,曝气后立即密封瓶盖并加入 0.2mL的氧化剂(次溴酸盐碘溶液),于 4℃保存用于后续DNRA过程的测定分析[17].
潜在反硝化速率由膜接口质谱仪(MIMS)通过测定始末样品之间反硝化过程产生的溶解性气体含量差值经同位素配对法计算得到.DNRA速率采用的是氨氧化技术与膜接口质谱仪结合的方法(OX/MIMS)通过测定15NH4+-N浓度计算得到,即在培养实验完成后在泥浆样品中注入的氧化剂(次溴酸盐碘溶液)将 NH4+-N氧化为 N2,再用膜接口质谱仪(MIMS)测定水样中溶解的气体(28N2,29N2,30N2)含量,根据29N2、30N2含量计算出DNRA过程产生的15NH4+-N浓度,进而得到DNRA的反应速率[18].
1.4 沉积物特征分析
表层沉积物样烘干碾磨过筛,用过硫酸钾法测定TN、TP,用烧失法测定有机物含量(LOI).沉积物含水率的测定方法是将预先称量好的湿泥在80℃的烘箱烘烤至恒重,再计算沉积物中的含水率.SOD是通过MIMS测定培养前和培养完成时泥浆中的氧气含量得到的[19].
1.5 营养盐通量计算方法
2011年的流动培养实验中,NH4+-N、NO3--N、NO2--N在沉积物-水界面的通量计算公式为[20]:
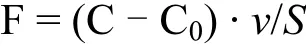
总溶解态无机氮(DIN)通量为:
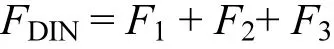
式中:F1、F2、F3分别为通 量,µmol/(m2·h);FDIN是 总 溶 解 态 无 机 氮 通量,µmol/(m2·h);C、C0是流动培养进出水中营养盐浓度,µmol/L;v为蠕动泵流速,mL/min;S为柱样中沉积物-水界面面积,m2.
1.6 反硝化、DNRA速率计算方法
本研究假设培养过程中的反硝化是完全的脱氮反应,最终产物中不存在29N2O和30N2O[21];参与反硝化反应的14NO3-和15NO3-在生成 N2时,14N和15N的结合是随机的,即同位素分子量的差异不会对反应的随机性产生影响[22].
N2的释放速率(r29,r30)[20]:
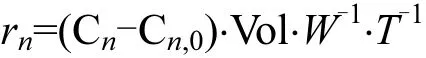
式中:rn为氮 气(r29,r30)释 放 速 率,µmol/(kg·h);Cn,0、Cn分别为培养开始前及培养后labco瓶中的氮气含量,µmol/L;Vol是培养瓶的体积,L;W是沉积物干泥的质量, kg;T是培养时间, h.
由29N2(r29),30N2(r30)的产生速率可计算出
15NO3--N的反硝化速率(DDNF)[23]:
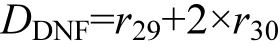
DNRA速率公式为[17]:
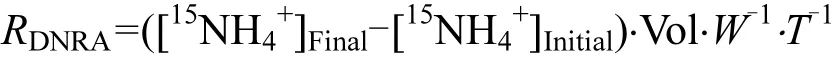
式中:RDNRA是总的潜在反硝化速率(µmol15N/(kg·h)),[15NH4+]Initial和[15NH4+]Final分别是泥浆样品中15NH4+的初始和最终浓度(µmol/L),其他各项参数与上式相同.
1.7 统计分析
单因素方差分析(ANOVA)用于差异性分析,变量之间的关系用Pearson相关性检验进行分析,所有的数据统计采用SPSS22.0,数据显著性分析的置信区间均为 95%.采样点的绘制使用 Arcgis 10.3.1,营养盐通量、反硝化、DNRA 及 DNRA在硝酸盐异养还原中的比例图用origin 9绘制.
2 结果与讨论
2.1 沉积物理化参数
各采样点沉积物理化参数如表1所示.沉积物 TN、TP的浓度变化范围分别为 0.67~2.57mg/g,0.26~0.70mg/g,均值分别为 1.54mg/g,0.51mg/g.TN,TP最大值均出现在傀儡湖出湖河道口附近的 S10.沉积物含水率的变化范围为35.02%~67.57%,位于 S7处(67.57%)的最大值约是S6处(35.02%)的2倍.烧失量最低值出现在S6,其值为 2.00%,最高值出现在阳澄湖引水河道口处的 S8,其值为 12.80%.烧失量可间接表明底泥的有机质含量,S8处(12.80%)的烧失量远高于其他点位的平均值(3.84%),说明阳澄湖来水中含有丰富的有机质.沉积物需氧量(sediment oxygen demand, SOD)变化范围为 12.80~41.72gO2/(m2·d),均值为23.40gO2/(m2·d),最大值位于 S8,与有机质含量最大处出现在相同位置说明此处微生物代谢活性高,生物活动丰富.
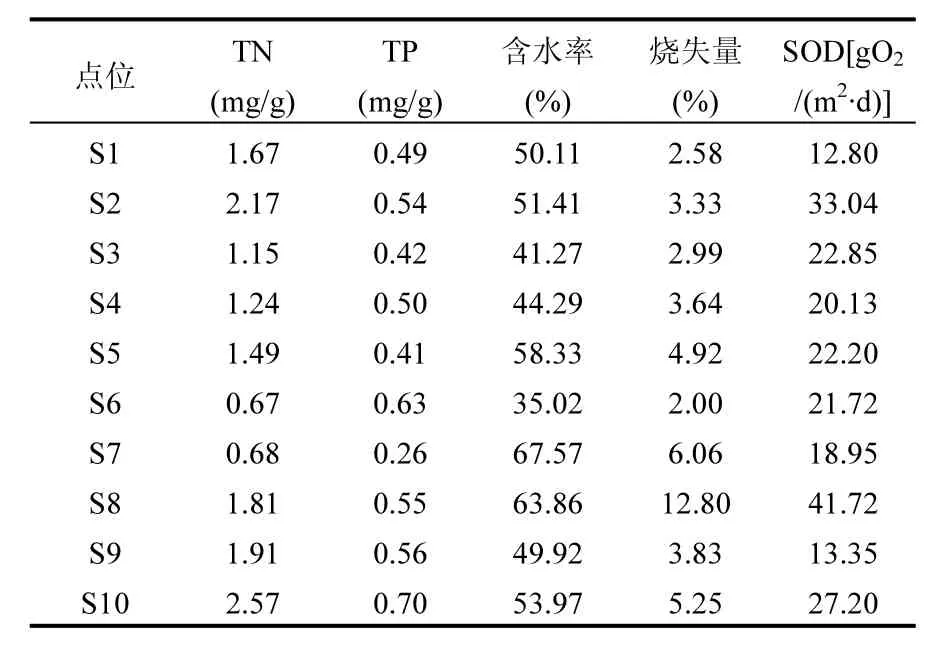
表1 傀儡湖沉积物理化参数Table 1 Physiochemical characteristics of the sediments in Lake Kuilei
2.2 沉积物-水界面营养盐通量
沉积物-水界面 NH4+-N 净通量在 40.60~277.98µmol/(m2·h)范围内(图 2),均值为 158.06±85.52µmol/(m2·h),不同点位之间存在较大差异性.10个采样点处的沉积物均表现为NH4+-N的源,即表示NH4+-N从沉积物中释放到上覆水体,其中 NH4+-N净通量的最大值出现在湖泊西北部的S2点,最小值在湖中心的S4点.NO3--N净通量具有与 NH4+-N净通量相反的传递方向,10个点位的沉积物均为 NO3--N 的汇,变化范围为 :-53.55~-11.09µmol/(m2·h),均 值 为 -31.30±13.26µmol/(m2·h),仅为 NH4+-N 通量的 19.8%.NO2--N净通量与NO3--N通量具有相同的传递方向,沉积物都为水体中的汇,但是NO2--N净通量远小于NO3--N净通量,其平均通量仅为-4.49±2.53µmol/(m2·h).总溶解性无机氮通量在 0.13~233.03µmol/(m2·h)范围内,最小值出现在 S4,最大值在 S3,具有很大的空间异质性.10个点位沉积物均为 DIN的源,这是因为NH4+-N净通量在DIN中占据主导作用,NO2--N净通量与 NO3--N通量都远小于NH4+-N通量,对 DIN的贡献率较小.沉积物中大量的 NH4+-N进入水体中,在水体中较高溶解氧的环境条件下,易促进硝化过程的发生,导致 NO3--N、NO2--N的大量生成,NO3--N、NO2--N通过扩散作用进入沉积物,成为硝酸盐在厌氧沉积物中异养还原过程的反应底物.这与研究结果表明的沉积物-水界面处的NH4+-N通量、NO3--N通量转移方向是一致的.
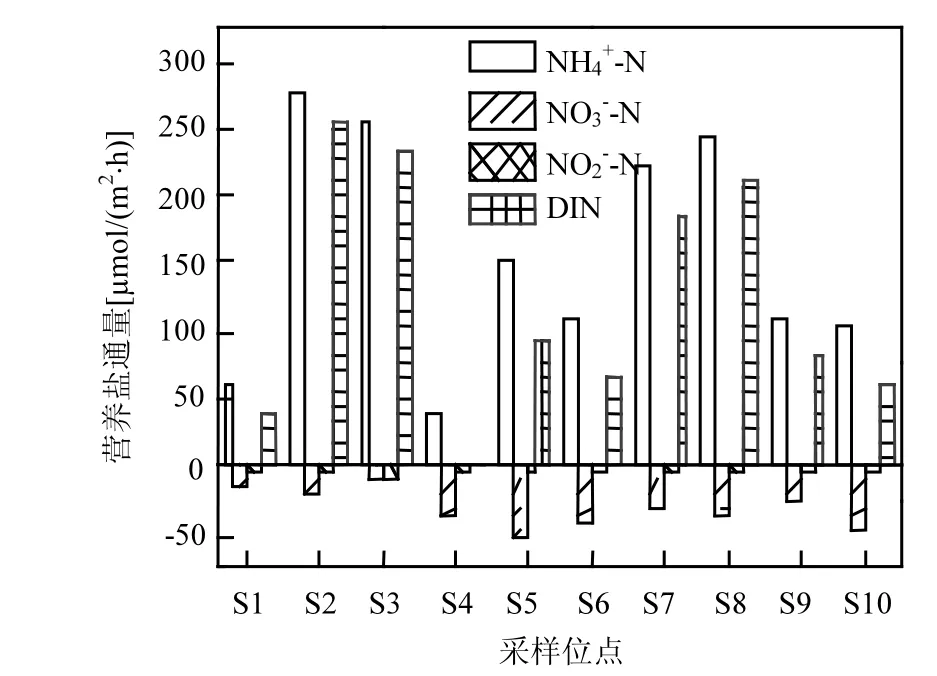
图2 各采样点沉积物-水界面营养盐通量Fig.2 Nutrient fluxes across the sediment-water interface of all sampling sites
2.3 反硝化速率
傀儡湖潜在反硝化速率是利用添加的15NO3-而发生的反硝化量 DDNF,其最大值出现在S8 处(54.00±9.69µmol/(kg·h))均值±标准偏差,下同),最小值在 S6处(18.88±1.31µmol/(kg·h)) (图3),均值为 36.39±3.86µmol/(kg·h).采样点之间的反硝化速率存在显著的空间差异性(one-way ANOVA,n=30,P=0.000).研究区域的反硝化速率与含水率和烧失量存在极显著相关性(P<0.01),但是与TN,TP之间的相关性不显著(表2).一般来说,反硝化速率和有机质之间存在显著的正相关关系,这表明研究区域的反硝化过程主要是由微生物分解有机质驱动的,有机质作为电子供体参与反硝化过程,因此导致有机质含量不同的区域反硝化速率也明显不同[9-10].反硝化与沉积物含水率之间的显著相关关系(r=0.885,P<0.01)是由于沉积物中的含水量可能会阻止氧气在其中的扩散,给微生物提供一个有利于脱氮的厌氧环境,因此随着沉积物含水率的增加,反硝化速率也相应的增加[11,24].
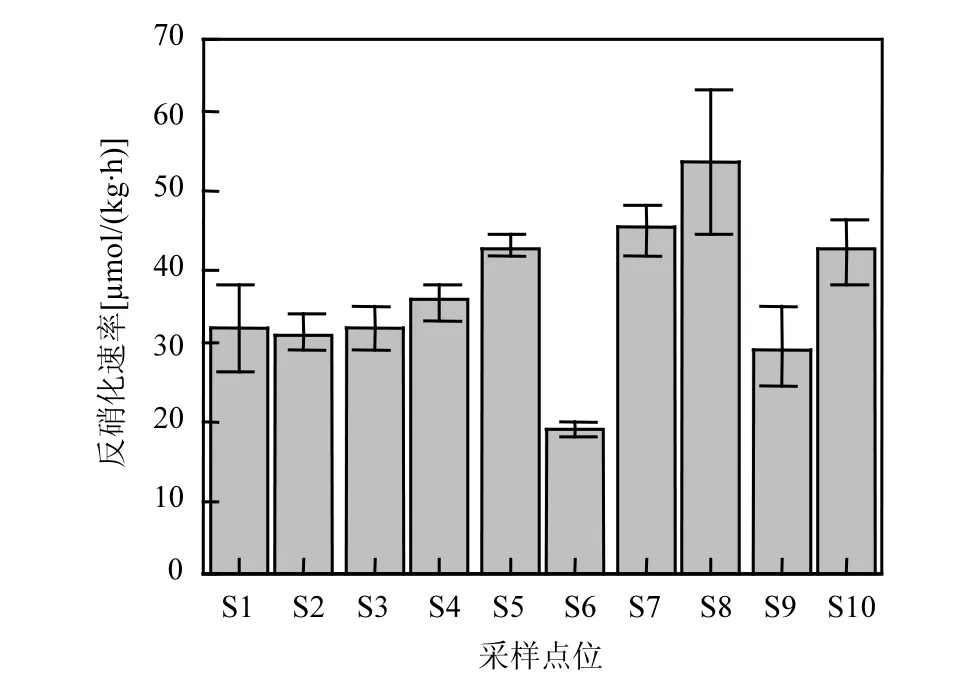
图3 傀儡湖沉积物反硝化速率Fig.3 DNF rates in the sediments of Lake Kuilei
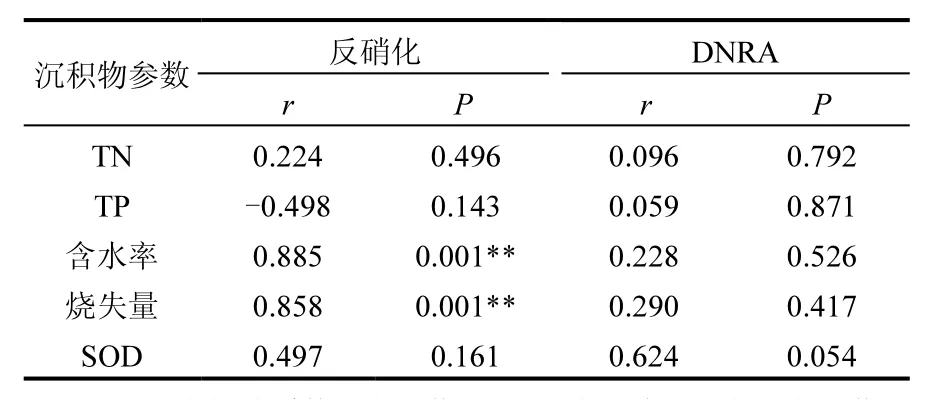
表2 硝酸盐异养还原(反硝化和DNRA)与沉积物理化参数的相关关系Table 2 Correlation analyses between dissimilatory nitrate reduction (DNF and DNRA) tares and physiochemical characteristics of sediments
2.4 DNRA速率
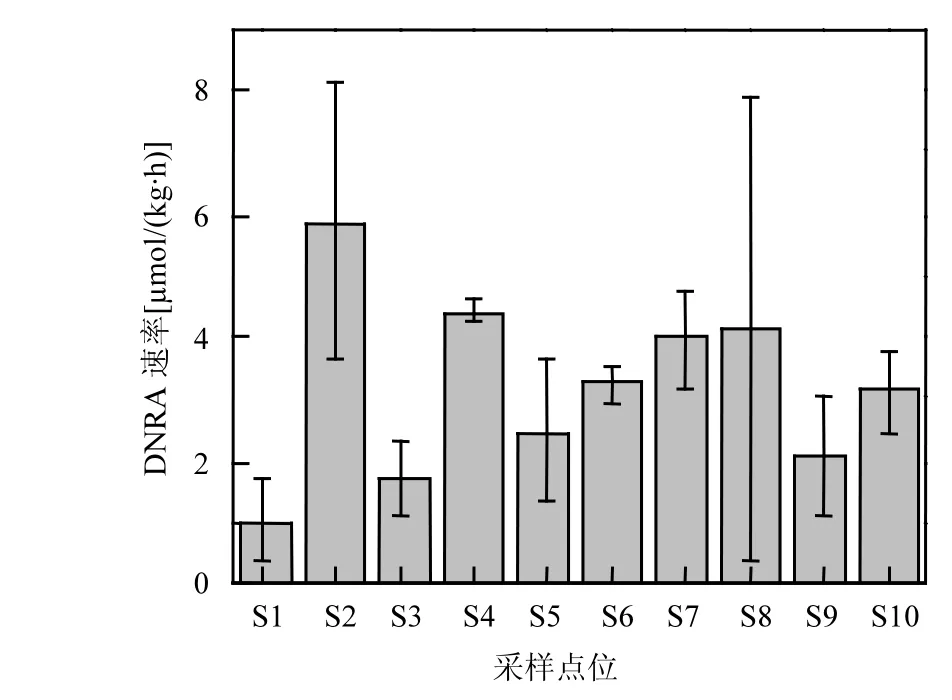
图4 傀儡湖沉积物DNRA速率Fig.4 DNRA rates in the sediments of Lake Kuilei
潜在DNRA速率变化范围在1.02~ 5.88µmol/(kg·h)之间(图 4),均值为 3.21±1.15µmol/(kg·h).由单因素方差分析可知,在整个傀儡湖研究区域,各样点之间的 DNRA速率没有显著的差异性(n=30,P>0.05).最高的DNRA速率位于S2,最低的在S1.DNRA过程可分别由以有机碳为电子供体的异养生物(发酵型的 DNRA)和以硝酸盐氧化硫化氢及其他还原性的无机底物的化能自养生物催化进行[23].之前的研究报道称由 DNRA产生NH4+的过程与沉积物中有机碳的含量存在相关关系,并且可能是高浓度的有机碳及氮限制的条件下硝酸盐异养还原的主导过程[23].进行相关分析发现,本研究中 DNRA过程与沉积物中有机碳含量之间没有显著的相关关系(r=0.290,P>0.05),说明有机碳不是本研究的限制因子,夏季沉积物中硝酸盐的限制可能是影响 DNRA过程的重要因素.沉积物耗氧量(SOD)表征的是沉积物对氧气的消耗情况,SOD越大,说明沉积物的还原性越强[24].还原性越强的沉积物越有利于DNRA过程的发生.由表2可知,DNRA速率与SOD之间存在正相关关系(r=0.624, P=0.054).还有研究表明,DNRA过程也会促进SOD的产生和增长:当沉积物中由DNRA过程产生的NH4+释放到上覆水中时,会促进浮游植物生产力的提高,浮游植物的死亡降解进一步导致额外的有机质进入沉积物,从而诱导SOD的增长[26].
2.5 不同类型湿地的反硝化和DNRA过程
反硝化和DNRA过程在硝酸盐异养还原过程中发挥不同的作用:反硝化可以去除水生生态系统中的硝酸盐,结束硝酸盐在水生生态系统中的循环过程,是湿地生态系统脱氮过程,反应生态系统的自净能力[22];而 DNRA过程是将硝酸盐还原为氨氮,以无机氮的形式继续存在于生态系统中.相比较于硝态氮,氨氮更易被浮游植物所利用,所以 DNRA过程是一种氮素内循环过程,甚至会加重湿地污染状况[27].因此,这两个过程之间的相互竞争强度决定水生生态系统中硝酸盐异养还原过程的转化方式与最终归趋.本研究中,反硝化是傀儡湖沉积物中硝酸盐异养还原的主导途径,占总的硝酸盐损失(DNF+DNRA)的 84.23%~ 96.90%.与反硝化过程相比,DNRA过程发挥较小的作用,只占总的硝酸盐损失的3.10%~15.77% (图5).
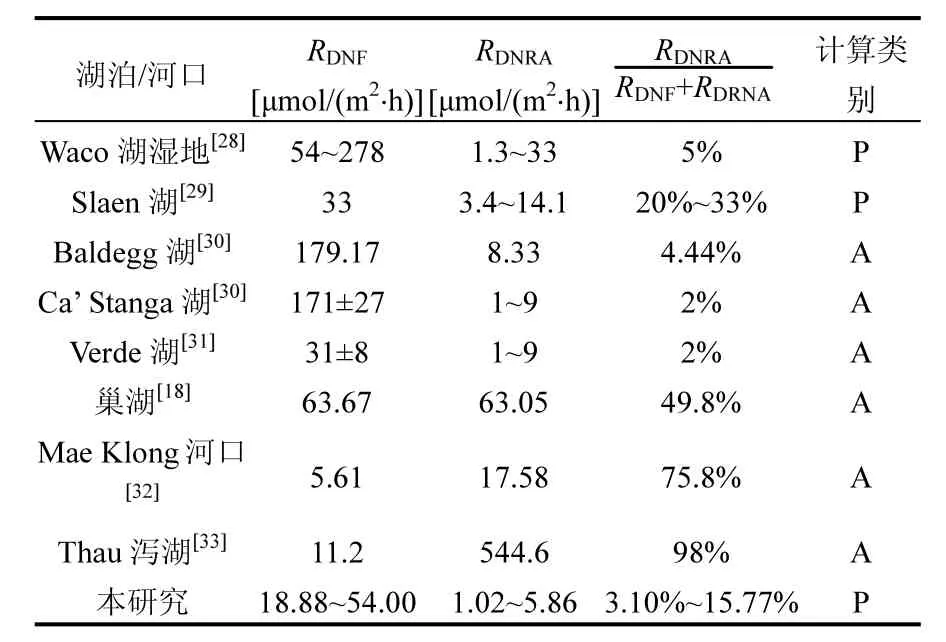
表3 傀儡湖及其他的湖泊、河口湿地反硝化、DNRA速率及DNRA在硝酸盐异养还原过程中所占的比重Table 3 DNF and DNRA rates and the contribution of DNRA to total dissimilatory nitrate reduction in Lake Kuilei and some other lake and estuarine ecosystems
与其他地区的湖泊湿地相比,本研究中的反硝化速率、DNRA速率及DNRA在硝酸盐异养还原过程中所占的比重在文献报道的范围内(表3).但是淡水湖泊中的DNRA速率在总的硝酸盐异养还原过程中所占的比重大部分都小于 50%,说明淡水湖泊中的硝酸盐异养还原过程还是以反硝化作用占据主导地位.文献报道海洋河口湿地沉积物的DNRA速率可达总的硝酸盐还原速率的 75%[32],甚至达 98%[33],远远高于淡水湖泊中DNRA速率所占的比重,这可能与海洋河口处硫化物浓度较高有关.Howarth报道海水中硫酸盐浓度约为 25~28mmol/L[34],远远高于淡水湖泊(其中太湖水体硫酸盐浓度为 1mmol/L)[35].此外,海洋河口处的盐度高于湖泊等淡水生态系统,在这样的盐度条件下,硫酸盐还原是主要的有机物降解过程,孔隙水中硫化物(硫酸盐还原产物)的浓度可能在低氧条件下增加,而高的硫化物浓度可能通过对硝化细菌的毒害作用抑制硝化过程的发生,从而导致可利用硝酸盐浓度的降低;同时,由于硫化物对反硝化细菌具有抑制作用且可充当电子供体参与DNRA过程,致使沉积物中的硝酸盐可能会被 DNRA过程而非反硝化过程利用[35].最终使得 DNRA速率远大于反硝化速率.这与湖泊生态系统中较低的硫化物浓度具有很大差异,所以淡水生态系统中的DNRA速率会远小于反硝化速率.
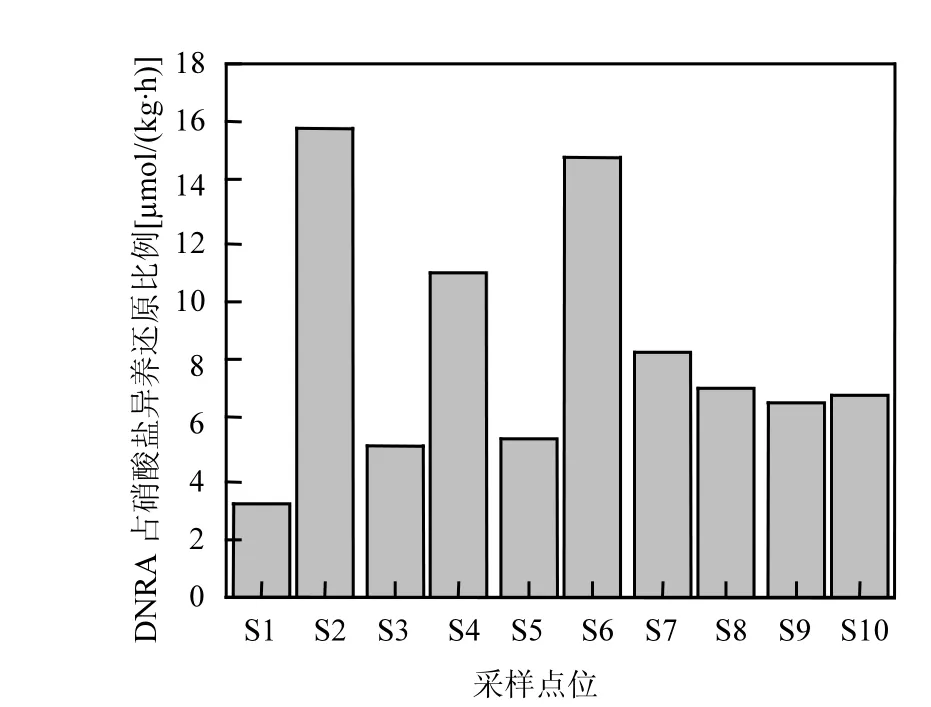
图5 DNRA占沉积物中硝酸盐异养还原(DNF+DNRA)的比例Fig.5 Contribution of DNRA to total dissimilatory nitrate reduction (DNF+DNRA) in the sediments of Lake Kuilei
3 结论
3.1 傀儡湖10个采样点沉积物-水界面处的营养盐通量具有较大的差异性.10个采样点沉积物均为NH4+-N净通量的源,NO3--N和NO2--N净通量的汇.由于NH4+-N净通量远大于NO3--N和NO2--N净通量,所以沉积物为总溶解性无机氮(DIN)的源.
3.2 傀儡湖硝酸盐异养还原过程中潜在的反硝化速率为 18.89~54.00µmol/(kg·h),均值为 36.39±3.86µmol/(kg·h);潜在 DNRA 速率为 1.02~5.88µmol/(kg·h),均值为 3.21±1.15µmol/(kg·h).
3.3 研究区域的反硝化速率与沉积物中的烧失量和含水率存在的正相关关系;DNRA与沉积物耗氧量(SOD)之间存在相关性.
3.4 反硝化是傀儡湖中硝酸盐异养还原的主导过程,占硝酸盐异养还原过程(DNF+DNRA)的84.23%~96.90%;DNRA 所占比重为 3.10%~15.77%.与海洋河口区域相比,淡水湖泊生态系统中DNRA速率和DNRA在硝酸盐异养还原中所占的比重均较小.
[1]Karthic I, Brugam R B, Retzlaff W, et al. The impact of nitrogen contamination and river modification on a Mississippi River floodplain lake [J]. Science of the Total Environment, 2013,463:734-742.
[2]Bu H, Meng W, Zhang Y. Nitrogen pollution and source identification in the Haicheng River basin in Northeast China [J].Science of the Total Environment, 2011,409(18):3394-3402.
[3]王秋娟,李永峰,姜 霞,等.太湖北部三个湖区各形态氮的空间分布特征 [J]. 中国环境科学, 2010,30(11):1537-1542.
[4]Di Z, Zhang H, Shan B. Using sedimentary phosphorus/nitrogen as indicators of shallow lake eutrophication: concentrations or accumulation fluxes [J]. Environmental Earth Sciences, 2015,74(5):3935-3944.
[5]Howarth R W, Marino R. Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems: Evolving views over three decades [J]. Limnology & Oceanography, 2006,51(1):364-376.
[6]Giblin A E, Tobias C R, Song B, et al. The importance of dissimilatory nitrate reduction to ammonium (DNRA) in the nitrogen cycle of coastal ecosystems [J]. Oceanography, 2013,26(3):124-131.
[7]Figueiredo Souza V, Santoro A L, van Weerelt M, et al. Sediment denitrification, DNRA and anammox rates in tropical floodplain lake (Pantanal, Brazil) [J]. Oecologia Australis, 2013,16(4):734-744.
[8]Saunders D L, Kalff J. Denitrification rates in the sediments of Lake Memphremagog, Canada—USA [J]. Water Research, 2001,35(8):1897-1904.
[9]Deng F, Hou L, Liu M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2015,120(8):1521-1531.
[10]Song G D, Liu S M, Marchant H, et al. Anaerobic ammonium oxidation, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment [J]. Biogeosciences,2013,10(11):6851-6864.
[11]Garcia-Ruiz R, Pattinson S N, Whitton B A. Denitrification in river sediments: relationship between process rate and properties of water and sediment [J]. Freshwater Biology, 1998,39(3):467-476.
[12]胡晓婷,程 吕,林贤彪,等.沉积物硝酸盐异化还原过程的温度敏感性与影响因素--以长江口青草沙水库为例 [J]. 中国环境科学, 2016,36(9):2624-2632.
[13]McCarthy M J, Lavrentyev P J, Yang L, et al. Nitrogen dynamics and microbial food web structure during a summer cyanobacterial bloom in a subtropical, shallow, well-mixed, eutrophic lake (Lake Taihu, China)[J]. Hydrobiologia, 2007,581(1):195-207.
[14]张 伟.昆山傀儡湖水污染控制对策 [J]. 污染防治技术,2003,S1:150-154.
[15]陈小华,李小平,程 曦,等.太湖流域典型中小型湖泊富营养化演变分析(1991~2010年) [J]. 湖泊科学, 2013,25(6):846-53.
[16]徐 徽,张 路,商景阁,等.太湖梅梁湾水土界面反硝化和厌氧氨氧化 [J]. 湖泊科学, 2009,21(6):775-781.
[17]Yin G, Hou L, Liu M, et al. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems [J]. Environmental Science &Technology, 2014,48(16):9555-9562.
[18]姜星宇,姚晓龙,徐会显,等.长江中下游典型湿地沉积物-水界面硝酸盐异养还原过程 [J]. 湖泊科学, 2016,28(6):1283-92.
[19]Bernard R J, Mortazavi B, Kleinhuizen A A. Dissimilatory nitrate reduction to ammonium (DNRA) seasonally dominates NO3−reduction pathways in an anthropogenically impacted sub-tropical coastal lagoon [J]. Biogeochemistry, 2015,125(1):47-64.
[20]Kunu T M, Sullivan M B, Cornwell J C, et al. Denitrification in estuarine sediments determined by membrane inlet mass spectrometry [J]. Limnology and Oceanography, 1998,43(2):334-339.
[21]Crowe S A, Canfield D E, Mucci A, et al. Anammox,denitrification and fixed-nitrogen removal in sediments from the Lower St. Lawrence Estuary [J]. Biogeosciences, 2012,9(11):4309.
[22]Risgaard‐Petersen N, Nielsen L P, Rysgaard S, et al. Application of the isotope pairing technique in sediments where anammox and denitrification coexist [J]. Limnology and Oceanography:Methods, 2003,1(1):63-73.
[23]Steingruber S M, Friedrich J, Gächter R, et al. Measurement of denitrification in sediments with the 15N isotope pairing technique [J]. Applied and Environmental Microbiology, 2001,67(9):3771-3778.
[24]Weier K L, Doran J W, Power J F, et al. Denitrification and the dinitrogen/nitrous oxide ratio as affected by soil water, available carbon, and nitrate [J]. Soil Science Society of America Journal,1993,57(1):66-72.
[25]Laverman A M, Canavan R W, Slomp C P, et al. Potential nitrate removal in a coastal freshwater sediment (Haringvliet Lake, The Netherlands) and response to salinization [J]. Water Research,2007,41(14):3061-3068.
[26]Dunn R J K, Welsh D T, Jordan M A, et al. Benthic metabolism and nitrogen dynamics in a sub-tropical coastal lagoon:microphytobenthos stimulate nitrification and nitrate reduction through photosynthetic oxygen evolution [J]. Estuarine, Coastal and Shelf Science, 2012,113:272-282.
[27]Dong L F, Sobey M N, Smith C J, et al. Dissimilatory reduction of nitrate to ammonium, not denitrification or anammox,dominates benthic nitrate reduction in tropical estuaries [J].Limnology and Oceanography, 2011,56(1):279-291.
[28]Scott J T, McCarthy M J, Gardner W S, et al. Denitrification,dissimilatory nitrate reduction to ammonium, and nitrogen fixation along a nitrate concentration gradient in a created freshwater wetland [J]. Biogeochemistry, 2008,87(1):99-111.
[29]Gruca-Rokosz R, Tomaszek J A, Koszelnik P. Competitiveness of dissimilatory nitrate reduction processes in bottom sediment of Rzeszów reservoir [J]. Environ. Protect. Eng., 2009,35:5-13.
[30]Pelegrí S P, Blackburn T H. Nitrogen cycling in lake sediments bioturbated by Chironomus plumosus larvae, under different degrees of oxygenation [J]. Hydrobiologia, 1996,325(3):231-238.
[31]Nizzoli D, Carraro E, Nigro V, et al. Effect of organic enrichment and thermal regime on denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in hypolimnetic sediments of two lowland lakes [J]. Water Research, 2010,44(9):2715-2724.
[32]Gilbert F, Souchu P, Bianchi M, et al. Influence of shellfish farming activities on nitrification, nitrate reduction to ammonium and denitrification at the water-sediment interface of the Thau lagoon, France [J]. Marine Ecology Progress Series, 1997:143-153.
[33]Hietanen S, Kuparinen J. Seasonal and short-term variation in denitrification and anammox at a coastal station on the Gulf of Finland, Baltic Sea [J]. Hydrobiologia, 2008,596(1):67-77.
[34]Howarth R. Microbial processes in salt-marsh sediments [J].Aquatic microbiology, 1993:239-260.
[35]Tao Y, Yuan Z, Wu F, et al. Six-Decade Change in Water Chemistry of Large Freshwater Lake Taihu, China [J].Environmental Science & Technology, 2013,47(16):9093-9101.
[36]An S M, Gardner W S. Dissimilatory nitrate reduction to ammonium (DNRA) as a nitrogen link, versus denitrification as a sink in a shallow estuary (Laguna Madre/Baffin Bay, Texas) [J].Marine Ecology Progress, 2002,237(1499):41-50.
