多核yolk−shell型Co3O4@mSiO2纳米反应器降解双酚A
2018-06-25吉芳英王攀峤陈晴空重庆大学三峡库区生态环境教育部重点实验室重庆400045重庆交通大学环境水利工程重庆市工程实验室重庆400074
吉芳英 ,王攀峤 ,陈晴空 (.重庆大学,三峡库区生态环境教育部重点实验室,重庆 400045;2.重庆交通大学,环境水利工程重庆市工程实验室,重庆 400074)
近年来,基于硫酸根自由基(SO4•-)的高级氧化技术已成为难降解有机污染物 (ROPs)处理领域的研究热点.最经济的硫酸根自由基引发方式是以Co2+离子催化过一硫酸盐(peroxymonosulfate,PMS),其反应机理与 Fenton反应相似,反应无需外加能源和特制的反应器,操作简单、低能耗;相对于Fenton试剂还具有氧化性更高、催化剂Co2+稳定存在、没有化学污泥产生、运行pH值范围宽等优点[1-2].但作为催化剂的 Co2+是有毒金属离子,对人体和环境有潜在的危害[3-4].将 Co3O4颗粒、钴-铁酸盐和负载型含Co材料[5]等含钴固体催化剂用于PMS催化可有效降低Co2+的环境风险.但催化剂的非均相化降低了 Co2+离子的扩散能力,当催化剂对目标污染物和PMS吸附性较弱时,Co2+与PMS的接触率下降, 会导致催化效率降低,需要投加大量催化剂或PMS以获得较高的自由基产率.而过量的PMS会造成SO42−浓度过高,需要增加后续脱盐设施,极大地提高技术成本.因此,如何提高非均相催化效率是减少催化剂和PMS投加量的关键.
近年来,纳米反应器在非均相催化领域受到广泛关注,它能提供一种纳米尺度的空间,通过内外浓度差吸收、释放物质,使反应受限于该纳米空间范围内.将它与基于 SO4•-高级氧化技术的非均相体系耦合,能极大地提高催化效率,同时减少催化剂和氧化剂PMS的投加量.各种结构的纳米反应器中,yolk-shell型纳米反应器具有内核可自由移动、尺寸和形貌易调节等优点[6-7].当包含金属纳米粒子作内核时,金属粒子被孤立在空腔内,可以有效避免金属粒子之间的相互作用和聚集,防止了催化效率的下降.而介孔材料由于其优良的吸附性,常被选作 yolk-shell型纳米反应器的外壳.其中,介孔 SiO2(mSiO2)具有比表面积和孔容大、孔径可调、尺寸稳定、强度高、使用寿命长等优点,是作为纳米反应器的理想材料[8].mSiO2里的介孔孔道有序并垂直于球表面,有利于客体分子的传输,在吸附大分子方面性能优越[9].Deng等[10]和 Liu等[11]分别合成了外壳为mSiO2的纳米反应器,均能高效吸附水中大分子污染物.
双酚 A(BPA)是一种内分泌干扰物(EDCs),在动物生殖、神经、免疫等方面存在潜在危害.它可通过相关制造业的工业废水进入环境,并通过食物链积累,产生持续的、不可逆的影响[12-13].目前,由于 BPA 的难生物降解性,生化处理难以达到对其的高效去除[14];采用吸附去除,吸附剂又存在难以再生的问题[15-16].本文提出将 mSiO2作外壳的 yolk-shell型纳米反应器与基于 SO4•-高级氧化技术的非均相体系耦合,用于降解工业废水中高浓度 BPA.文中采用双溶液注射法合成了多核yolk−shell型Co3O4@mSiO2纳米反应器,对合成的纳米反应器进行了表征,研究其对 BPA的吸附和降解效果,探究反应条件初始pH值、温度、纳米反应器投加量mcata、PMS:BPA物质的量之比 nPMS:nBPA对 BPA降解的影响,通过循环实验考察纳米反应器的再利用性.
1 实验部分
1.1 制备HMSS
将 0.84g溴化十六烷基三甲铵(CTAB;AR,Aladdin)溶解于含280mL超纯水、115.4mL无水乙醇(AR, Aladdin)和 5.55mL25wt%氨水(AR,Aladdin)的溶液中,35℃搅拌下加入 5mL正硅酸乙酯(TEOS;AR, Aladdin).将混合液搅拌 24h,离心,用无水乙醇洗涤沉淀.得到的白色产物分散于超纯水中,保持水温70℃培养12h,离心,用无水乙醇洗涤沉淀,干燥后 550℃煅烧 6h,得到白色的HMSS.
1.2 制备多核yolk-shell型Co3O4@mSiO2纳米反应器
将 0.50gCo(CH3COO)2·4H2O(AR, Aladdin)溶解于15mL无水乙醇和10mL超纯水的混合液中,记为溶液1.将5g HMSS分散于30mL正己烷(AR, Aladdin)中,记为溶液 2.
将溶液1逐滴加入溶液2,搅拌1h.逐滴加入625µL 25wt%氨水,搅拌 20min.再转移至聚四氟乙烯高压反应釜中,于150℃加热3h.冷却至室温,离心,用乙醇和超纯水洗涤沉淀,于 60℃干燥 4h,得到多核 yolk-shell型 Co3O4@mSiO2纳米反应器.按使用的试剂量计算,此纳米反应器的理论掺钴量为16.6%.
改变溶液1和溶液2的比例,将1/4体积的溶液1逐滴加入溶液2反应,之后制备步骤相同,得到另一种掺钴量的多核 yolk-shell型Co3O4@mSiO2纳米反应器.按使用的试剂量计算,此纳米反应器的理论掺钴量为4.8%.
1.3 纳米反应器的表征
使用 X 射线衍射仪(XRD;D/Max2500pc,日本里学)分析纳米反应器的物象,仪器具备旋转阳极靶,最大额定输出功率 18kW,2θ:-10~146°,最小步进0.001°.使用X射线光电子能谱仪 (XPS;250Xi,美国赛默飞世尔)分析纳米反应器表面各元素形态,使用 XPS peak4.1软件进行背景差分峰拟合处理.使用扫描电镜(SEM;MIRA3XMU,捷克泰斯肯)和透射扫描电镜(STEM; Tecnai F20,美国 FEI)观察纳米反应器形貌.使用比表面和孔径分布分析仪(BET; Quadrasorb 2MP,美国康塔仪器)分析纳米反应器比表面积、孔容及孔径.
1.4 BPA吸附和降解实验
在一系列的200mL烧杯中进行BPA吸附和降解实验,BPA的初始浓度设定为 50mg/L.以200r/min的速率搅拌溶液.对于吸附实验,初始pH 值=6.5,反应温度(25±0.1)℃,mcata=0.8g/L,吸附时间1h,按设定的时间间隔取样,经 0.22µm的滤膜过滤,使用高效液相色谱仪(HPLC;LC-2010,日本岛津)测定 BPA浓度.测定条件为流动相 45%乙腈(CRM, Aladdin)和 55%超纯水,流速0.7mL/min,柱温30℃,吸收波长205nm,纳米反应器对BPA的吸附容量按式1计算.对于降解实验,初始 pH 值=6.5,反应温度(25±0.1)℃,nPMS:nBPA=10:1, mcata=0.8g/L,先让材料吸附BPA30min,再投加氧化剂 PMS进行催化降解,共降解 2h,按设定的时间间隔取样,经 0.22µm 的滤膜过滤,加入83mmol/L Na2SO3(AR, Aladdin)淬灭 SO4•-,使用HPLC测定BPA浓度,BPA的降解率按式2计算.

式中:c0为降解前BPA浓度,mg/L;c为降解后BPA浓度,mg/L;mcata为纳米反应器的投加量, g/L.
使用总有机碳分析仪(TOC;TOC-VCPH,日本岛津)检测 BPA降解过程的总有机碳浓度,TOC去除率按式3计算.使用等离子发射光谱仪(ICP;HIC-SP,日本岛津)检测 BPA 降解过程的Co2+溶出量.
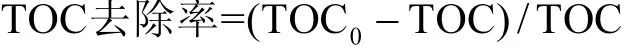
式中:TOC0为降解前 TOC,mg/L;TOC为降解后TOC,mg/L.
1.5 反应条件对BPA降解的影响
对于初始pH值,用pH计(PHSJ-4F, 中国雷磁)预设初始pH值=3、5、6.5、9,以0.1mol/L的硝酸(AR, Aladdin)或 0.1mol/L的 NaOH(AR,Aladdin)调节.对于反应温度,预设温度=25、35、45℃.对于 PMS:BPA 物质的量之比 nPMS:nBPA,预设nPMS:nBPA=6:1、8:1、10:1、12:1,变化 PMS 的投加量.对于纳米反应器的投加量,预设=0.4,0.6,0.8,1.0g/L.
1.6 纳米反应器的再利用性
回收降解 BPA后的多核 yolk-shell型Co3O4@mSiO2纳米反应器.将降解 BPA 后的溶液离心,用无水乙醇和超纯水洗涤沉淀,于 60℃干燥.每次回收的纳米反应器再用于 BPA降解,测定降解率.
2 结果及讨论
2.1 纳米反应器的表征
2.1.1 XRD 多核 yolk−shell型 Co3O4@mSiO2纳米反应器的XRD表征结果显示,位于2θ=22.8°的为无定形硅峰[17],表明纳米反应器的主体为SiO2.未出现明显的Co及其化合物的特征峰的原因可能是 Co含量太低,超出了仪器检测限而未能检出[18].
2.1.2 XPS 多核 yolk−shell型 Co3O4@mSiO2纳米反应器的 XPS表征结果如图 1所示.图 1a是C 1s的XPS能谱图,其结合能峰位284.8ev用于样品的电荷校正.图 1b证实了多核 yolk-shell型Co3O4@mSiO2纳米反应器表面含有Co、Si、O3种元素,表面Co 2p含量为1.08%.经分峰处理,纳米反应器的 Si 2p峰位于 103.72eV(图 1c),与SiO2的 Si 2p标准峰位(103.8eV)接近,推断103.72eV位置为SiO2硅峰.O 1s峰位于532.7eV(图 1d),与 SiO2的 O 1s标准峰位(532.6eV)及Co3O4的 O 1s标准峰位(530eV)比较,推断532.9eV位置为SiO2或 Co3O4氧峰.纳米反应器中的Co 2p对称分布于782.4eV、798.3eV(图1e),分别为 Co 2p3/2峰和 Co 2p1/2峰,与陈晴空[18]、Ganesh 等[19]、Lu 等[20]和 Shi等[21]对比,可判断Co的存在形式为Co3O4.
2.1.3 纳米反应器的形貌特征 多核 yolk−shell型Co3O4@mSiO2纳米反应器的SEM表征结果如图2所示.由图2a可知合成的多核yolk−shell型 Co3O4@mSiO2纳米反应器为粒径约300nm 的微球,均匀分散,没有出现团聚现象.由图2b可知纳米反应器表面布满孔洞,是由于合成的过程中通过煅烧,去除模板剂CTAB形成的[22].由图2c可知材料表面含有Si和O两种元素,几乎不含Co元素,结合XPS表征结果初步推断Co以Co3O4形式存在于纳米反应器内部.

图1 多核yolk-shell型Co3O4@mSiO2纳米反应器XPS能谱图*Fig.1 XPS analysis of multi yolk−shell Co3O4@mSiO2 nanoreactor
多核 yolk−shell型 Co3O4@mSiO2纳米反应器的STEM表征结果如图3所示.由图3a可知,合成的 HMSS粒径约为 300nm,内部中空.由图3b和图3c可知,合成的多核yolk−shell型Co3O4@mSiO2纳米反应器为均匀、粒径约300nm 的微球,内部含有多个纳米微球型内核,其余部分为空腔.对比图 3a和图 3b,说明采用双溶液注射法合成纳米反应器,并不会改变HMSS外壳的形貌[17],双溶液通过 HMSS表面孔洞进入内部生成内核.对比图3和图2,STEM和 SEM表征得到的形貌、粒径等观察结果一致.图3d显示纳米反应器中均匀分布有Si、O、Co3种元素,图 3e中可以观察到 Si、O、Co3种元素的峰.结合 XPS和 SEM 表征结果,说明绝大部分Co以Co3O4形式存在于纳米反应器的内部.
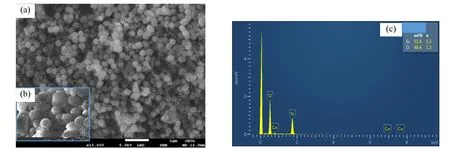
图2 多核yolk−shell型Co3O4@mSiO2纳米反应器SEM表征结果*Fig.2 SEM characterization of multi yolk−shell Co3O4@mSiO2 nanoreactor

图3 多核yolk−shell型Co3O4@mSiO2纳米反应器STEM表征结果*Fig.3 STEM characterization of multi yolk−shell Co3O4@mSiO2 nanoreactor
2.1.4 BET 多核 yolk−shell型 Co3O4@mSiO2纳米反应器的 BET表征结果显示,纳米反应器N2吸附脱附等温线属于Langmuir IV类曲线,证明其为介孔材料.等温线中明显的磁滞回线表明纳米反应器存在因内部空腔而形成的大孔和因外壳上SiO2粒子间的空隙而形成的介孔[23],介孔和空腔分别提供了物质传输的通道和反应的场所.经 BJH算法对等温线的脱附分支进行计算,得到纳米反应器的比表面积为 160.198m2/g,和Du等[24]、Chen等[25]合成的类似的 yolk-shell型纳米反应器比较数值相当,明显高于 Co3O4纳米粒子的比表面积.孔容为0.667cc/g,和Zeng等[23]、Chen等[25]合成的材料对比,合成的多核 yolk−shell型Co3O4@mSiO2纳米反应器有更大的孔容.更大的比表面积和孔容赋予多核 yolk-shell型Co3O4@mSiO2纳米反应器更好的吸附性能,在降解ROPs的过程中更有利于吸附ROPs和氧化剂,并在纳米反应器内部的富集,加大与内核接触的几率,从而加快催化速率.纳米反应器的平均孔径为 19.932nm,属于介孔范围,印证了合成的纳米反应器外壳为mSiO2.
由XRD、XPS、SEM、STEM和BET表征结果综合判断,成功合成了多核 yolk−shell型Co3O4@mSiO2纳米反应器.
2.2 纳米反应器对水中BPA的吸附
如图4所示,多核 yolk−shell型Co3O4@mSiO2纳米反应器和 Co3O4纳米粒子约在 30min均达到吸附平衡.纳米反应器对BPA 1h吸附容量为12.7mg/g,比Co3O4纳米粒子对BPA 1h吸附容量1mg/g大幅度提升.对比以多壁碳纳米管[26]、电气石[27]作为载体的纳米反应器,本研究合成的多核yolk−shell型 Co3O4@mSiO2纳米反应器吸附性能也有显著提高.这归功于 mSiO2外壳对BPA的高效吸附和yolk-shell型纳米反应器的空腔对 BPA的富集,能营造一个高浓度的反应条件[28].
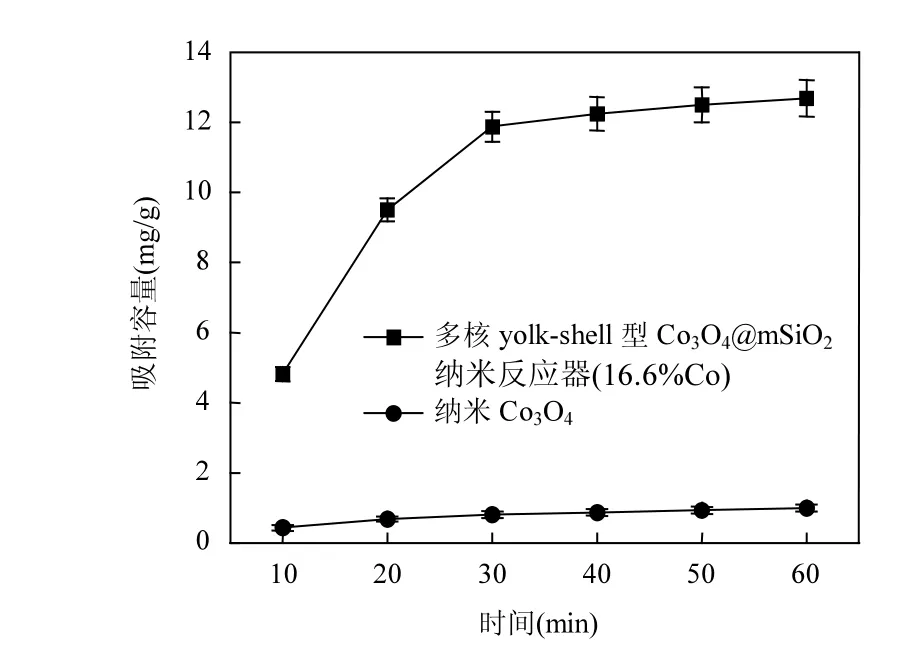
图4 多核yolk−shell型Co3O4@mSiO2纳米反应器对BPA的吸附Fig.4 Adsorption of BPA by multi yolk−shell Co3O4@mSiO2 nanoreactor
2.3 纳米反应器催化PMS降解水中BPA及其机理分析

图5 多核yolk−shell型Co3O4@mSiO2纳米反应器对BPA的催化降解*Fig.5 Catalyzation and degradation of BPA by multi yolk−shell Co3O4@mSiO2 nanoreactor
各反应体系初始pH值为6.5.如图5a所示,只加入PMS,BPA 2h降解30.8%,降解效果不高.投加合成的HMSS和PMS,BPA 2h降解49.1%,比只投加PMS的情况上升了18.3%,BPA和PMS被多孔的HMSS吸附于表面,由浓度差推动,经介孔进入内部空腔,实现了BPA和PMS的富集,在高浓度情况下,PMS利用自身的强氧化性对BPA进行降解,但并没有发生催化反应,导致降解率仍较低.在加入含Co催化剂后,PMS能在Co催化下产生 SO4•-[29].投加 Co3O4纳米粒子和 PMS,由于 Co3O4纳米粒子并不具备多孔的表面,不能高效地吸附 PMS和 BPA以及高效地催化生成SO4•-,导致 BPA与 SO4•-的接触率低,BPA 2h 降解率仍然不高,为 51.3%.投加多核 yolk−shell型Co3O4@mSiO2(4.8%Co)和 PMS,BPA 2h降解率为 69.8%;投加多核 yolk−shell型 Co3O4@mSiO2(16.6%Co)和PMS,BPA 2h降解率为81.8%.由于Co是催化PMS产生SO4•-的催化剂,掺钴量的增大能提高 BPA 的降解率.但掺钴量不宜过高,因为Co2+有生物毒性[4,30-31].投加多核yolk−shell型Co3O4@mSiO2和 PMS,纳米反应器实现了 PMS和BPA的“吸附-富集-限域反应”,BPA降解率比只投加PMS大幅度提升.
投加不同材料降解BPA过程的TOC去除情况如图5b所示.对比图5b和图5a,各反应体系中TOC的变化情况和BPA降解情况有关.投加多核yolk−shell Co3O4@mSiO2纳米反应器(16.6%Co)和PMS时,TOC去除率最高,2h去除率为41.4%,此时BPA大部分都转变成了中间产物.
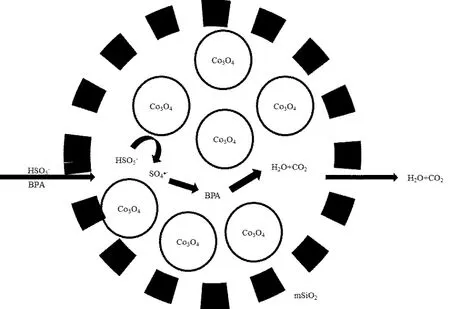
图6 多核yolk−shell型Co3O4@mSiO2纳米反应器降解BPA示意Fig.6 Schematic diagram of BPA degradation by multi yolk−shell Co3O4@mSiO2 nanoreactor
多核 yolk−shell型 Co3O4@mSiO2纳米反应器降解 BPA的机理如图 6所示.其机理可能是:由于纳米反应器外部的反应物浓度高于内部,通过 mSiO2外壳上的介孔,纳米反应器将 BPA和PMS吸附到反应器内部,富集BPA和PMS的浓度;利用纳米反应器的限域作用将反应限定在空腔内,增大PMS和内核Co3O4的接触几率,加快产生 SO4•-的速率;同样是限域作用,在纳米反应器内富集 SO4•-的浓度,加快 SO4•-降解 BPA 的速率;BPA最终降解产物为H2O和CO2,产物由于纳米反应器内外浓度差,通过 mSiO2外壳上的介孔离开纳米反应器,释放了空腔空间,有利于下一次吸附.
2.4 反应条件对纳米反应器降解BPA的影响
选定反应温度=25℃,mcata=0.8g/L,nPMS:nBPA=10:1,初始pH值=3、5、6.5、9时对BPA降解的影响实验结果如图 7a.多核 yolk−shell型Co3O4@mSiO2纳米反应器在弱酸性或者中性的条件下对BPA的降解率较高,而在酸性或碱性情况下 BPA降解率下降.在酸性情况下,PMS能在溶液中稳定存在,此时纳米反应器对PMS的催化效率强,短时间内生成大量 SO4•-,SO4•-还未来得及与 BPA有效接触便湮灭(式 4)[18].在碱性情况下,PMS作为酸式盐出现一定的分解,自由基总量相对较少,自由基种类以•OH为主,•OH的氧化性不如SO4•-,导致BPA降解效率降低[1-2].而在弱酸性或者中性情况下,纳米反应器对PMS的催化和PMS自身分解达到一个合理范围,体系中的自由基浓度达到最高值,种类以 SO4•-为主,但•OH比例较酸性环境有所上升,形成了混合自由基体系[32-33].
选定初始pH值为6.5,mcata=0.8g/L,nPMS:nBPA=10:1,反应温度为25、35、45℃时对BPA降解的影响实验结果如图7b.45℃时BPA降解率有明显降低,说明反应温度不宜过高.其原因可能是较高温度下 SO4•-生成速率过快,SO4•-自我湮灭(式 4).

选定初始 pH 值为 6.5,反应温度为 25℃,nPMS:nBPA=10:1, =0.4、0.6、0.8、1.0g/L时对 BPA降解的影响实验结果如图7c.BPA的降解率并没有随增加而一直上升,在为0.6g/L和0.8g/L时达到最大,mcata为0.4g/L和1.0g/L时BPA降解率下降.mcata过小时,不能提供足够的催化位点,导致催化效率不高.mcata过大时,反应体系中 BPA和PMS的总量不变,每个纳米反应器吸附的 BPA和 PMS减少,从反应动力学的角度来看反应物浓度降低不利于反应进行,反应速率下降;另外过大也会使反应发生过快,导致 PMS过早消耗(式4).
选定初始 pH 值=6.5,反应温度=25℃,mcata=0.8g/L,nPMS:nBPA=6:1、8:1、10:1、12:1 时对 BPA降解的影响实验结果如图 7d.理论上,PMS将BPA完全降解成CO2和H2O, nPMS:nBPA为 36:1(式 5);考虑工业废水回用要求,根据中国《城市污水再生利用-工业用水水质》(GB/T19923-2005)[34],除直流冷却水外硫酸盐限值为250mg/L,以 PMS最终全部转化为 SO42-计,为避免盐度超标 nPMS:nBPA应不大于 12:1,因此设计实验 nPMS:nBPA分别为6:1、8:1、10:1、12:1.在此变化范围内,BPA降解效率随 nPMS:nBPA增大而增大,说明PMS的投加量并未足量,但过多的PMS会消耗体系中的自由基[35-36](式 6),与 BPA发生竞争关系.纳米反应器高效的催化性能可以节省氧化剂PMS的用量,投加等量PMS,多核yolk−shell型Co3O4@mSiO2纳米反应器对BPA的降解效率远高于Co3O4纳米粒子对BPA的降解效率.对比Yang[37]等用O3/Na2S2O8体系降解BPA,本研究氧化剂用量明显减少.nPMS:nBPA为12:1时,BPA 2h降解率已经达到 94.8%,兼顾降解效果和水体盐度,nPMS:nBPA=12:1为一个较理想比值.
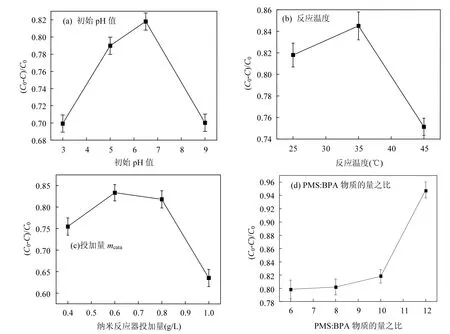
图7 不同反应条件下BPA的降解Fig.7 Degradation of BPA under different reaction condition
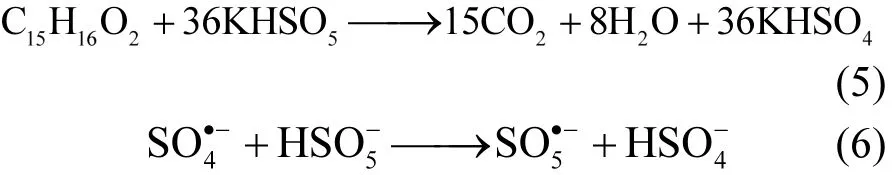
2.5 纳米反应器再利用性
多核 yolk−shell型 Co3O4@mSiO2纳米反应器的4个循环中对BPA的降解率如图8a所示.随着循环次数增加,BPA降解率和TOC去除率逐渐降低.由于每个循环中纳米反应器的Co2+溶出,纳米反应器在回收过程中会产生团聚等物理性质变化,且吸附于纳米反应器表面的降解中间产物会使其中毒[38-39],因此纳米反应器的催化性能随循环次数增加逐渐降低.但循环4的BPA降解率只比循环1降低11.75%,TOC去除率只比循环1降低 5.5%,说明多核 yolk−shell型 Co3O4@mSiO2纳米反应器有很好的回收再生性能,可反复利用.循环4的BPA降解率只比循环3降低1.38%,说明纳米反应器在两次循环间发生的变化小,纳米反应器状态趋于稳定.
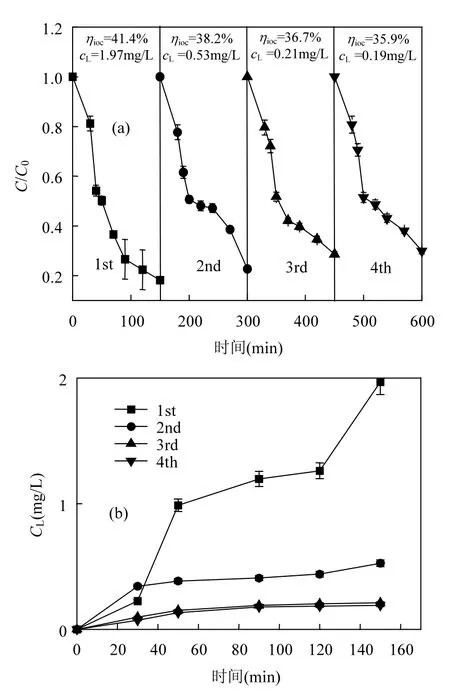
图8 多核yolk−shell型Co3O4@mSiO2纳米反应器再利用性Fig.8 Recyclability of multi yolk−shell Co3O4@mSiO2 nanoreactor
多核 yolk−shell型 Co3O4@mSiO2纳米反应器的4个循环中Co2+溶出量如图8b所示.每次循环中 Co2+的溶出量均随反应时间增加而上升,Co2+最大溶出量除循环 1外均低于《地表水环境质量标准》(GB3838-2002)[40]的要求(集中式生活饮用水地表对水源地特定项目标准限值中对Co2+的排放限值为 1mg/L).对比循环1和循环2,循环1的Co2+最大溶出量是循环2的3.6倍,但BPA降解率仅比循环2高出4.55%,证明BPA的降解主要是靠纳米反应器的非均相作用而不是均相作用.若要循环1的Co2+溶出量有所降低,应在制备时增加洗涤次数,洗去未被稳定固定的Co.对比循环3和循环4,两次循环的Co2+溶出曲线十分接近,最大溶出浓度仅相差0.02mg/L,再次说明纳米反应器状态逐渐达到稳定.
3 结论
3.1 本研究采用双溶液注射法成功合成了一种多核yolk−shell型Co3O4@mSiO2纳米反应器.
3.2 利用XRD,XPS,SEM,STEM和BET分析表征了合成的纳米反应器的形貌、结构、元素形态和比表面积,结果显示纳米反应器为粒径 300nm左右的微球,表面布满介孔,内部分布大量 Co3O4纳米粒子,且拥有极大的比表面积.
3.3 合成的纳米反应器在吸附BPA实验和催化PMS降解BPA实验中均表现出高效性.
3.4 通过单因素实验探究合成的纳米反应器降解BPA的最佳反应条件,为初始pH值=6.5、反应温度=35℃、纳米反应器投加量=0.6g/L、PMS:BPA物质的量之比 nPMS:nBPA=12:1.
3.5 在循环降解 BPA 实验中,纳米反应器在 4个循环周期均表现出高催化性能,且 Co2+溶出量保持在合理范围.
[1]陈晓旸.基于硫酸自由基的高级氧化技术降解水中典型有机污染物研究 [D]. 大连:大连理工大学, 2007.
[2]Antoniou M G, de la Cruz A A, Dionysiou D D. Degradation of microcystin-LR using sulfate radicals generated through photolysis, thermolysis and e(-)transfer mechanisms [J]. Applied Catalysis B-environmental, 2010,96(3/4):290-298.
[3]Guo W, Su S, Yi C, et al. Degradation of antibiotics amoxicillin by Co3O4-catalyzed peroxymonosulfate system [J]. Environmental Progress & Sustainable Energy, 2013,32(2):193- 197.
[4]Shukla P, Wang S, Singh K, et al. Cobalt exchanged zeolites for heterogeneous catalytic oxidation of phenol in the presence of peroxymonosulphate [J]. Applied Catalysis B: Environmental,2010,99(1):163-169.
[5]Hu P, Long M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016,181(Supplement C):103-117.
[6]Perez-Lorenzo M, Vaz B, Salgueirino V, et al. Hollow-shelled nanoreactors endowed with high catalytic activity [J].Chemistry-A European Journal, 2013,19(37):12196-12211.
[7]Anipsitakis G P, Stathatos E, Dionysiou D D. Heterogeneous activation of oxone using Co3O4[J]. Journal of Physical Chemistry B, 2005,109(27):13052-13055.
[8]Xu X R, Li H B, Wang W H, et al. Degradation of dyes in aqueous solutions by the Fenton process [J]. Chemosphere,2004,57(7):595-600.
[9]Hartmann M. Ordered mesoporous materials for bioadsorption and biocatalysis [J]. Chemistry of Materials, 2005,17(18):4577-4593.
[10]Deng Y, Qi D, Deng C, et al. Superparamagnetic highmagnetization microspheres with an Fe3O4@SiO2core and perpendicularly aligned mesoporous SiO2shell for removal of microcystins [J]. Journal of the American Chemical Society,2008,130(1):28-29.
[11]Liu Z, Yang H, Zhang H, et al. Oil-field wastewater purification by magnetic separation technique using a novel magnetic nanoparticle [J]. Cryogenics, 2012,52(12SI):699-703.
[12]Latini G, Knipp G, Mantovani A, et al. Endocrine disruptors and human health [J]. Mini-Reviews in Medicinal Chemistry,2010,10(9):846-855.
[13]Bromer J G, Zhou Y, Taylor M B, et al. Bisphenol-A exposure in utero leads to epigenetic alterations in the developmental programming of uterine estrogen response [J]. Faseb Journal,2010,24(7):2273-2280.
[14]Staples C A, Dorn P B, Klecka G M, et al. A review of the environmental fate, effects, and exposures of bisphenol A [J].Chemosphere, 1998,36(10):2149-2173.
[15]Huling S G, Kan E, Wingo C. Fenton-driven regeneration of MTBE-spent granular activated carbon-Effects of particle size and iron amendment procedures [J]. Applied Catalysis BEnvironmental, 2009,89(3/4):651-658.
[16]Kan E, Huling S G. Effects of Temperature and acidic pre-treatment on fenton-driven oxidation of MTBE-spent granular activated carbon [J]. Environmental Science &Technology, 2009,43(5):1493-1499.
[17]Liu C, Li J, Qi J, et al. Yolk-Shell Fe0@SiO2Nanoparticles as nanoreactors for fenton-like catalytic reaction [J]. ACS Applied Materials & Interfaces, 2014,6(15):13167-13173.
[18]陈晴空.基于 SO4•-的非均相类 Fenton-光催化协同氧化体系研究 [D]. 重庆:重庆大学, 2014.
[19]Ganesh I, Gupta A K, Kumar P P, et al. Preparation and characterization of Co-doped TiO2materials for solar light induced current and photocatalytic applications [J]. Materials Chemistry and Physics, 2012,135(1):220-234.
[20]Lu Y, Lin Y, Wang D, et al. A high performance cobalt-doped ZnO visible light photocatalyst and its photogenerated charge transfer properties [J]. Nano Research, 2011,4(11):1144-1152.
[21]Shi P, Su R, Wan F, et al. Co3O4nanocrystals on graphene oxide as a synergistic catalyst for degradation of Orange II in water by advanced oxidation technology based on sulfate radicals [J].Applied Catalysis B-Environmental, 2012,123:265-272.
[22]Saputra E, Muhammad S, Sun H, et al. alpha-MnO2activation of peroxymonosulfate for catalytic phenol degradation in aqueous solutions [J]. Catalysis Communications, 2012,26:144-148.
[23]Zeng T, Zhang X, Wang S, et al. Spatial Confinement of a Co3O4Catalyst in Hollow Metal-Organic Frameworks as a Nanoreactor for Improved Degradation of Organic Pollutants [J].Environmental Science & Technology, 2015,49(4):2350-2357.
[24]Du D, Shi W, Wang L, et al. Yolk-shell structured Fe3O4@void@TiO2as a photo-Fenton-like catalyst for the extremely efficient elimination of tetracycline [J]. Applied Catalysis B-Environmental, 2017,200:484-492.
[25]Chen L, Li L, Wang T, et al. A novel strategy to fabricate multifunctional Fe3O4@C@TiO2yolk-shell structures as magnetically recyclable photocatalysts [J]. Nanoscale,2014,6(12):6603-6608.
[26]Cleveland V, Bingham J, Kan E. Heterogeneous Fenton degradation of bisphenol A by carbon nanotube-supported Fe3O4[J]. Separation and Purification Technology, 2014,133(Supplement C):388-395.
[27]Yu L, Wang C, Ren X, et al. Catalytic oxidative degradation of bisphenol A using an ultrasonic-assisted tourmaline-based system: Influence factors and mechanism study [J]. Chemical Engineering Journal, 2014,252(Supplement C):346-354.
[28]Zhao M, Zheng L, Li N, et al. Fabrication of hollow silica spheres in an ionic liquid microemulsion [J]. Materials Letters, 2008,62(30):4591-4593.
[29]Yang Q, Choi H, Dionysiou D D. Nanocrystalline cobalt oxide immobilized on titanium dioxide nanoparticles for the heterogeneous activation of peroxymonosulfate [J]. Applied Catalysis B-Environmental, 2007,74(1/2):170-178.
[30]Rivas F J, Gimeno O, Borallho T. Aqueous pharmaceutical compounds removal by potassium monopersulfate. Uncatalyzed and catalyzed semicontinuous experiments [J]. Chemical Engineering Journal, 2012,192(Supplement C):326-333.
[31]Su S, Guo W, Yi C, et al. Degradation of amoxicillin in aqueous solution using sulphate radicals under ultrasound irradiation [J].Ultrasonics Sonochemistry, 2012,19(3):469-474.
[32]Hu P, Long M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016,181(Supplement C):103-117.
[33]Chen Q, Ji F, Liu T, et al. Synergistic effect of bifunctional Co-TiO2catalyst on degradation of Rhodamine B: Fenton-photo hybrid process [J]. Chemical Engineering Journal, 2013,229(Supplement C):57-65.
[34]GB/T19923-2005 城市污水再生利用-工业用水水质 [S].
[35]Ding Y, Zhu L, Wang N, et al. Sulfate radicals induced degradation of tetrabromobisphenol A with nanoscaled magnetic CuFe2O4as a heterogeneous catalyst of peroxymonosulfate [J].Applied Catalysis B: Environmental, 2013,129(Supplement C):153-162.
[36]Muhammad S, Shukla P R, Tadé M O, et al. Heterogeneous activation of peroxymonosulphate by supported ruthenium catalysts for phenol degradation in water [J]. Journal of Hazardous Materials, 2012,215(Supplement C):183-190.
[37]Yuan Z, Sui M, Yuan B, et al. Degradation of ibuprofen using ozone combined with peroxymonosulfate [J]. Environmental Science-Water Research & Technology, 2017,3(5):960-969.
[38]Li Y, Zhang F. Catalytic oxidation of Methyl Orange by an amorphous FeOOH catalyst developed from a high ironcontaining fly ash [J]. Chemical Engineering Journal, 2010,158(2):148-153.
[39]Ji F, Li C, Deng L. Performance of CuO/Oxone system:Heterogeneous catalytic oxidation of phenol at ambient conditions [J]. Chemical Engineering Journal, 2011,178:239-243.
[40]GB3838-2002 地表水环境质量标准 [S].
