左氧氟沙星滴眼液不同给药方式患者房水与血浆药物浓度的差异
2018-06-25张鲁洁蔡春梅范思均李晓琴
张鲁洁 魏 琳 蔡春梅 范思均 李晓琴 梁 歌
(锦州医科大学火箭军总医院研究生培养基地,北京 100088)
目前,对于如何预防白内障术后眼内炎的发生,国内外采取不同的预防措施,欧洲白内障与屈光外科医师学会(ESCRS)指南〔1〕将白内障手术术毕时前房注射抗生素(10 g/L头孢呋辛0.1 ml)作为常规白内障摘除手术流程。与国外眼内注射抗生素不同,我国白内障专家共识〔2〕指出局部应用具有广谱抗菌作用的滴眼液仍作为我国预防术后眼内炎的重要措施,并推荐使用氟喹诺酮类或氨基糖苷类等广谱抗生素滴眼液。常规术前3 d用药,4次/d,或者术前1 d频点,6~8次/d。但对于此方式给药后,房水中药物浓度是否能够达到常见致病菌的有效抑菌浓度及局部应用抗生素滴眼液后全身药物代谢情况,国内外少见报道。本文观察不同给药方式使用左氧氟沙量滴眼液对房水及血浆药物浓度的影响。
1 材料与方法
1.1药物名称 0.5%左氧氟沙星滴眼液(商品名:可乐必妥,日本参天制药有限公司)。左氧氟沙星对照品(CAS号100986-85-4,源叶生物科技有限公司,批号S30D6Y8275,含量大于99%)。内标物加替沙星(CAS号112811-59-3,源叶生物科技有限公司,批号Y07D7C26182,含量大于99%)、乙腈、甲醇(均为色谱纯,DUKSAN公司)。纯化水(屈臣氏公司)。
1.2分组及给药 纳入2016年7月至2017年8月在火箭军总医院眼科预行白内障超声乳化术的老年性白内障患者90例(90只眼),随机分为A(30例)、B(60例)两大组,A组又随机分为A1,A2和A3亚组,每组10例,A1组:术前1 d给药,6次/d,A2组:术前2 d给药,4次/d,A3组:手术前3 d给药,4次/d。B组给药方式为术前3 d给药,4次/d,并于手术当日分别在术前7.5,15.0,30.0,45.0,60.0和120.0 min单一剂量给药,每一时间点取10例,所选患者无其他眼部疾患,无高度近视史,无抗生素过敏史,无严重心、肺、肝、肾功能障碍,未同时接受其他口服或局部抗生素。
1.3样品采集 手术中抽取100 μl房水置于EP管中,并同时抽取5 ml静脉血,静脉血在3 000 r/min的条件下离心10 min,取上清液置于EP管中,所有样本立即于-80℃冰箱保存,至分析时取出。
1.4色谱质谱分析条件 色谱柱MSLab C18。流动相A为含0.1%甲酸的2%乙腈水溶液,B为含0.1%甲酸的98%乙腈水溶液,流速0.8 ml/min;分流比1∶1;柱温:50℃;进样量:20 μl。质谱条件:电喷雾 (ESI)离子源,正离子模式监测,离子喷射电压:4 800 V;离子源温度:600℃。
1.5血浆处理 取血浆200 μl置于1.5 ml EP管中,加入20 μl纯化水涡旋2.0 min,再加入400 μl 100 ng/ml加替沙星(甲醇溶解的内标),涡旋2.0 min,静置10.0 min,13 200 r/min离心5.0 min,取上清液,进样15 μl,进行LC-MS/MS分析。
1.6房水处理 取房水20 μl置于1.5 ml EP管中,加入20 μl纯化水涡旋2.0 min,再加入40 μl 100 ng/ml加替沙星(甲醇溶解的内标),涡旋2.0 min,静置10.0 min,13 200 r/min离心5.0 min,取上清液,进样15 μl,进行LC-MS/MS分析。
1.7统计学分析 采用SPSS17.0统计学软件进行方差分析。
2 结 果
A1、A2、A3组年龄、前房深度(ACD)及体重指数(BMI)差异无统计学意义(P>0.05),A1,A2及A3组房水中左氧氟沙星浓度组间差异无统计学意义(P=0.281);血浆左氧氟沙星浓度组间差异均无统计学意义(P=0.478),见表1。
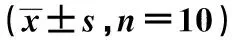
表1 A组一般资料、房水及血浆药物浓度比较
B组单一剂量给药后不同时间点房水药物浓度逐渐上升,45.0 min时达到最高值,之后逐渐下降。且45.0 min与7.5,15.0,30.0,60.0及120.0 min时药物浓度的差异均有统计学意义(P=0.000,0.000,0.010,0.012,0.029);应用滴眼液点眼后血浆中药物浓度逐渐上升但不明显,在45.0 min时药物浓度达到最高值,之后逐渐下降,45.0 min时的血浆药物浓度与7.5,30.0,60.0及120.0 min差异均有统计学意义(P=0.010,0.033,0.05,0.016),且血浆药物浓度远远低于房水药物浓度,见表2。
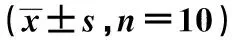
表2 B组不同时间点房水及血浆中的药物浓度
与45.0 min组比较:1)P<0.05;与同时点房水药物浓度比较:2)P<0.05
3 讨 论
本实验遵循了我国白内障专家共识〔2〕所推荐的给药方式,采用HPLC-MS/MS技术,分析测定了房水中的左氧氟沙星浓度,可达到常见的致病菌即表皮葡萄球菌(0.25~0.41 μg/ml)、金黄色葡萄球菌(0.25~0.50 μg/ml)、肺炎球菌(0.06~1.00 μg/ml)的MIC90〔3〕。Bucci等〔4〕团队曾报道术前2 d开始应用滴眼液点眼,每天4次,结果显示(0.285±0.193)μg/ml,与本次实验结果相符,其试验另一部分研究了术前点药5次,每次间隔10 min房水中的药物浓度可达(1.136±0.590)μg/ml。同样Yamada 等〔5〕研究了术前90.0 min点药3次所测房水药物浓度为(1.00±0.48)μg/ml,可见术前频点左氧氟沙星滴眼液可明显提高其在房水中的药物浓度,且频次越多房水中药物浓度越高,这可能与左氧氟沙星浓度依赖性的特点有关。本实验A2组数值相对偏低,但分析三组结果差异无统计学意义。所以结合本次实验结果和文献结果,我们更推荐术前1 d频繁点眼6次/d或是术前3 d点眼,4次/d两种给药方式,根据我们在临床中的工作经验,对于依从性不好的患者,推荐术前1 d频繁点眼的给药方式。
本实验还进行了局部应用滴眼液点眼后不同时间点的多点取样,探究单一剂量点眼后不同时间点房水药物浓度的变化。结果显示单一剂量点眼后房水药物浓度随着时间的增长呈上升趋势,在45.0 min达最高浓度,之后呈下降趋势。2009年姚克教授团队〔6〕报道了局部应用0.5%左氧氟沙星和0.3%加替沙星及0.3%乳酸左氧氟沙星后房水中的药物浓度,结果显示三种药物均在点眼后60.0 min时达最高浓度,但是两次试验的给药方式不一致,可能影响其到达最高药物浓度的时间,但有学者研究称局部滴眼液点眼,前房房水中药物浓度峰值在20.0~30.0 min后出现〔7〕。由此可知,局部抗生素点眼后45.0~60.0 min房水中的药物浓度达到最高值,所以患者可选择手术前1 h或45.0 min时频繁应用滴眼液(一般间隔10.0~15.0 min),以获得较好的抗菌效果。此外,我们推测,该结果姑且可以解释欧洲大部分国家选择术毕前房注射抗生素取得很好的预防效果。据报道欧洲白内障术后眼内炎的发生率0.04%~0.07%〔8,9〕,远远低于我国的发病率。由于术中灌注液的冲洗,前房内房水药物浓度很低,术后若应用滴眼液则在点眼后45.0 min或更久才能达到最高药物浓度,虽然不是只有达到最高浓度才能抑制细菌,但毕竟术后的45.0 min房水中药物浓度很低,且此时眼球又有切口与外界沟通更易发生眼内感染。欧洲的预防措施是术毕前房注射抗生素(常选用万古霉素),局部药物浓度高,且万古霉素半衰期可长达2 h,与术毕局部抗生素点眼的预防效果正好做到紧密衔接,故眼内炎的发生率可被控制在较低范围。因眼部解剖和生理功能的复杂,局部应用滴眼液点眼后,药物不仅从结膜囊血管吸收入血还可从鼻腔的鼻黏膜血管吸收入血,从而可使滴眼液大部分进入全身循环,此外药物从房水中的排泄大都是通过葡萄膜的血流循环进行的,所以只有很少一部分进入眼内〔7〕。因此,有研究者认为,小分子量的滴眼液点眼后可在短时间内进入血液循环,可能会引起患者的全身毒性应〔10,11〕。本研究结果发现应用局部抗生素滴眼液后,血浆中的药物浓度并没有达到之前研究者认为应用滴眼液后大部分入血的推测。当然也可能因为左氧氟沙星滴眼液的前房穿透性好,导致房水药物浓度较高。另外,我们观察到应用局部滴眼液在达到房水有效药物浓度的同时,血浆药物远远低于Pea等〔12〕所报道白内障患者术前10 h口服两次500 mg的左氧氟沙星后血浆中的药物浓度(5.23±2.12)μg/ml及George等〔13〕团队选用术前12 h口服750 mg左氧氟沙星后血浆中的平均药物浓度为(7.91±3.94)μg/ml。因此,相对于口服抗生素,采用滴眼液的方式给药具有较低的血浆药物浓度,更好的全身安全性。所以建议可选用局部滴眼液的方式预防术后感染,但若患者基础条件差如高龄,合并有糖尿病、肾功能不全等,可适当使用全身抗菌药物。
本研究所得结果存在较大程度的个体间变异性,表现为标准差较大。之前关于喹诺酮类药物渗透至角膜或房水的研究中也存在同样的问题〔5〕。分析其原因,我们认为可能存在多种因素导致患者间的变异性,如泪液循环速率、瞬目频率、药物吸收行为的差异等。总结分析本次实验不足:样本量相对较少;可能存在选择偏移;点眼操作不规范(存在少滴或是多滴的现象)虽在然时间点分组中由同一护士点眼,但对于不同方式给药的分组中均是由患者自己完成。
4 参考文献
1Seal DV,Barry P,Gettinby G,etal.ESCRS study of prophylaxis of postoperative endophthalmitis after cataract surgery:case for a European multicenter study.ESCRS study of prophylaxis of postoperative endophthalmitis after cataract surgery:case for a European multicenter study 〔J〕.Cataract Surg Refract,2006;32(3):396-406.
2中华医学会眼科学分会白内障和人工晶状体学组.关于白内障围手术期预防感 措施规范化的专家建议 (2013 年)〔J〕.中华眼科杂志,2013;49(1):76-8.
3Speaker MG,Milch FA,Shah MK,etal.Role of external bacterial flora in the pathogenesis of acute postoperative endophthalmitis〔J〕.Ophthalmology,1991;98:639-49.
4Bucci FA.An in vivo study comparing the ocular absorption of levofloxacin and ciprofloxacin prior to phacoemulsification〔J〕.Am J Ophthalmol,2004;137:308-12.
5Yamada M,Mochizuki H,Yamada K,etal.Aqueous humor levels of topically applied levofloxacin in human eyes〔J〕.Curr Eye Res,2002;24:403-6.
6黄晓丹,姚 克,陈伟娟,等.0.5%左氧氟沙星与0.3%加替沙星及0.3%乳酸左氧氟沙星的房水药物浓度研究〔J〕.中华眼科杂志,2009;45(11):987-91.
7Urtti A.Minimizing systemic absorption of topically administered ophthalmic drugs〔J〕.Surv Ophthalmol,1993;37:435-56.
8Endophthalmitis Study Group,European Society of Cataract & Refractive Surgeons.Prophylaxis of postoperative endophthalmitis following cataract surgery:results of the ESCRS multicenter study and identification of risk factors〔J〕.Cataract Refract Surg,2007;33:978-88.
9Lundström M,Barry P,Henry Y,etal.Evidence-based guidelines for cataract surgery:guidelines based on data in the European Registry of Quality Outcomes for Cataract and Refractive Surgery database〔J〕.Cataract Refract Surg,2012;38:1086-93.
10陈祖基.重视眼部给药系统的研究〔J〕.中华眼科杂志,2006;42(4):292-5.
11Salminen L.Systemic absorption of topically applied ocular drugs in humans〔J〕.J Ocular Pharmacol Therap,1990;6(3):243-9.
12Pea F,Ferrari E,Pavan F,etal.Lveofloxacin disposition over time in aqueous humor of patirnts undergoing cataract surgery〔J〕.Antimicrob Agents Chemother,2005;49:2554-7.
13George JM,Fiscella R,Blair M,etal.Aqueous and vitreous penetration of linezolid and levofloxacin after oral administration〔J〕.J Ocular Pharmacol Therap,2010;26(6):579-86.
