Quantitative analysis of dynamic contrast-enhanced MRI in distinguishing different grades of prostate cancer
2018-06-25nyu
, , , , U nyu*
(1.Department of Radiology, Peking University Third Hospital, Beijing 100191, China; 2.CT/MRI Division, the Central Hospital of Handan, Handan 056001, China)
前列腺癌是男性常见恶性肿瘤,患者预后受多种因素影响,个体差异较显著[1]。前列腺癌的侵袭性是影响预后的重要因素。高级别前列腺癌病情进展迅速,需及早采取前列腺癌根治术或放疗等积极治疗措施;而低级别前列腺癌则进展缓慢甚至长期无进展,仅需进行主动监测[2]。准确预测前列腺癌级别,可为个体化治疗提供依据。不同分级肿瘤的组织生物学特性各异。对比剂在不同病理组织中的药物代谢动力学不同,而动态对比增强MRI(dynamic contrast-enhanced MRI, DCE-MRI)可定量分析肿瘤组织的微血管密度及血管通透性等,从而评价肿瘤的生理特性。本研究探讨DCE-MRI定量分析在鉴别高、低级别前列腺癌中的价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月—2016年3月于我院接受前列腺根治术并经术后病理证实为前列腺癌的26例患者,年龄50~82岁,中位年龄72岁;前列腺特异性抗原(prostate specific antigen, PSA)3.87~451.00 μg/L,中位值为17.74 μg/L;术前均接受前列腺DCE-MRI,且无内分泌、放疗等非手术治疗史,MR检查前1个月内未接受前列腺穿刺活检。
1.2 仪器与方法 采用GE Discovery 750 3.0T MR扫描仪,8通道相控阵心脏线圈。扫描序列及参数:①矢状位、冠状位和轴位快速恢复FSE T2W,TR 4 417~6 573 ms,TE 96~106 ms,矩阵288×288,FOV 22 cm×22 cm,层厚4.0 mm,层间距0.4 mm;②常规轴位FSE序列T1W,TR 750 ms,TE 7.08 ms,矩阵320×224,FOV 32 cm×32 cm,层厚5.0 mm,层间距 0.5 mm;③DWI,TR 5 000 ms,TE 61.30 ms,矩阵128×128,FOV 30 cm×30 cm,b值为0、1 000 s/mm2,层厚4.0 mm,层间距0.4 mm;④动态增强扫描采用轴位三维容积超快速多期动态序列T1W,TR 4.30 ms,TE 1.95 ms,矩阵256×128,FOV 28 cm×28 cm,层厚3.60 mm,层间距0.72 mm。注射对比剂前先扫描蒙片,后以高压注射器经肘前静脉注射对比剂Gd-DTPA,剂量为0.2 mmol/kg体质量,流率 2 ml/s,以同样流率注射20 ml生理盐水,于注射对比剂的同时开始扫描,单期扫描时间5.5 s,共采集50期。
1.3 图像分析 将DCE-MRI数据传至GE AW 4.6工作站,首先应用Gen IQ工具对数据集进行后处理,再以3D SynchroView软件定量分析病灶。由2名分别具有8年和5年前列腺癌诊断经验的放射科医师根据第2版前列腺影像报告和数据系统(prostate imaging reporting and data system version 2, PI-RADS V2)共同分析图像,如2名医师意见不一致,则排除该病例。根据前列腺癌根治术后大体标本确定癌灶区域,以DWI为主,结合T2WI、ADC及DCE图确定外周带和中央腺体癌灶,在癌灶中心层面放置ROI(面积30~97 mm2),使其完全位于癌灶范围内,尽量避开外周带与中央腺体交界处、前列腺与直肠相邻处,以及尿道、射精管、精阜、精囊根部、出血、囊变及钙化灶。获得DCE-MRI定量参数值,包括转运常数(Ktrans)、速率常数(Kep)及血管外细胞外间隙体积百分数(Ve);均重复测量2次,取平均值。
1.4 病理分级采用 Gleason分级法进行前列腺癌病理分级,按病灶的主要和次要分化程度分别评分,将二者得分相加,获得最终得分,并根据得分将前列腺癌分为低级别组[Gleason评分≤6分或3(主要分化程度)+4(次要分化程度)=7分)]和高级别组[Gleason评分4(主要分化程度)+3(次要分化程度)=7分或最终Gleason评分≥8分)][3-4]。
1.5 统计学分析 采用SPSS 17.0统计分析软件。计量资料用±s表示,以独立样本t检验比较低级别与高级别前列腺癌Ktrans、Kep、Ve值的差异,并绘制ROC曲线,评价其鉴别高级别与低级别前列腺癌的诊断效能。采用Pearson相关分析评价DCE-MRI定量参数与Gleason评分的相关性。P<0.05为差异有统计学意义。
2 结果
26例中,外周带癌12例,中央腺体癌14例;低级别前列腺癌10例(Gleason评分6分6例,7分4例),高级别前列腺癌16例(Gleason评分7分4例,8分4例,9分6例,10分2例)。
高级别组Ktrans值及Kep值均高于低级别组(P均<0.05),2组间Ve值差异无统计学意义(P=0.994);见表1,图1、2。ROC曲线分析结果显示,Ktrans值及Kep值区分高级别与低级别前列腺癌的ROC曲线下面积分别为0.872及0.737(P均<0.05),见图3。以Ktrans=0.25/min为界值时,诊断高级别前列腺癌的敏感度和特异度分别为81.3%和80.0%;以Kep=1.62/min为界值时,诊断高级别前列腺癌的敏感度和特异度分别为68.8%和70.0%。
前列腺癌Ktrans、Kep、Ve值与Gleason评分均无明显相关(r=0.194、0.374、-0.130,P=0.343、0.060、0.526)。
表1 前列腺癌低级别组与高级别组各DCE-MRI参数结果比较(±s)
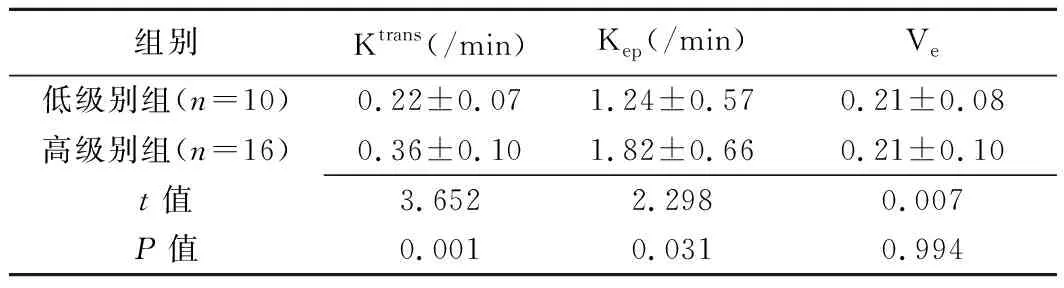
表1 前列腺癌低级别组与高级别组各DCE-MRI参数结果比较(±s)
组别Ktrans(/min)Kep(/min)Ve低级别组(n=10)0.22±0.071.24±0.570.21±0.08高级别组(n=16)0.36±0.101.82±0.660.21±0.10t值3.6522.2980.007P值0.0010.0310.994
3 讨论
前列腺癌的Gleason评分结果是选择治疗方法和判断预后的重要指标,级别越高,肿瘤侵袭性越强[5]。研究[6]表明,Gleason评分≥7分的前列腺癌血清PSA水平显著增高,常伴有被膜外侵犯、精囊腺浸润和阳性手术切缘,且淋巴结转移的发生率显著升高。因此,对于中、高级别前列腺癌,传统上采用前列腺癌根治术。低级别前列腺癌病情进展缓慢甚至长期无进展,很多低级别前列腺癌终生都不会对患者造成重要影响,而前列腺癌根治术可能伴有严重并发症,故对低级别前列腺癌多只需进行主动监测[2,7]。近年来,临床研究及治疗指南[3-4]认为Gleason评分为3+4=7分的前列腺癌具有较高的生物学惰性及较好的预后,也推荐采用主动监测,以避免过度治疗。本研究根据治疗策略将前列腺癌分为低级别组和高级别组,将Gleason评分3+4=7分的前列腺癌纳入低级别组,Gleason评分4+3=7分或≥8分者纳入高级别组,符合目前临床治疗原则。

图1 患者78岁,中央腺体高级别前列腺癌 A.T2WI示前列腺中央腺体局灶性低信号结节; B.DWI示结节呈高信号; C.ADC图示结节呈低信号; D.Ktrans图,Ktrans值为0.54/min; E.Kep图,Kep值为3.75/min; F.Ve图,Ve值为0.15

图2 患者78岁,外周带高级别前列腺癌 A.T2WI示前列腺右侧外周带局灶性低信号结节; B.DWI结节呈明显高信号; C.ADC图示结节呈低信号; D.Ktrans图,Ktrans值为0.35/min; E. Kep图,Kep值为1.97/min; F.Ve图,Ve值为0.196
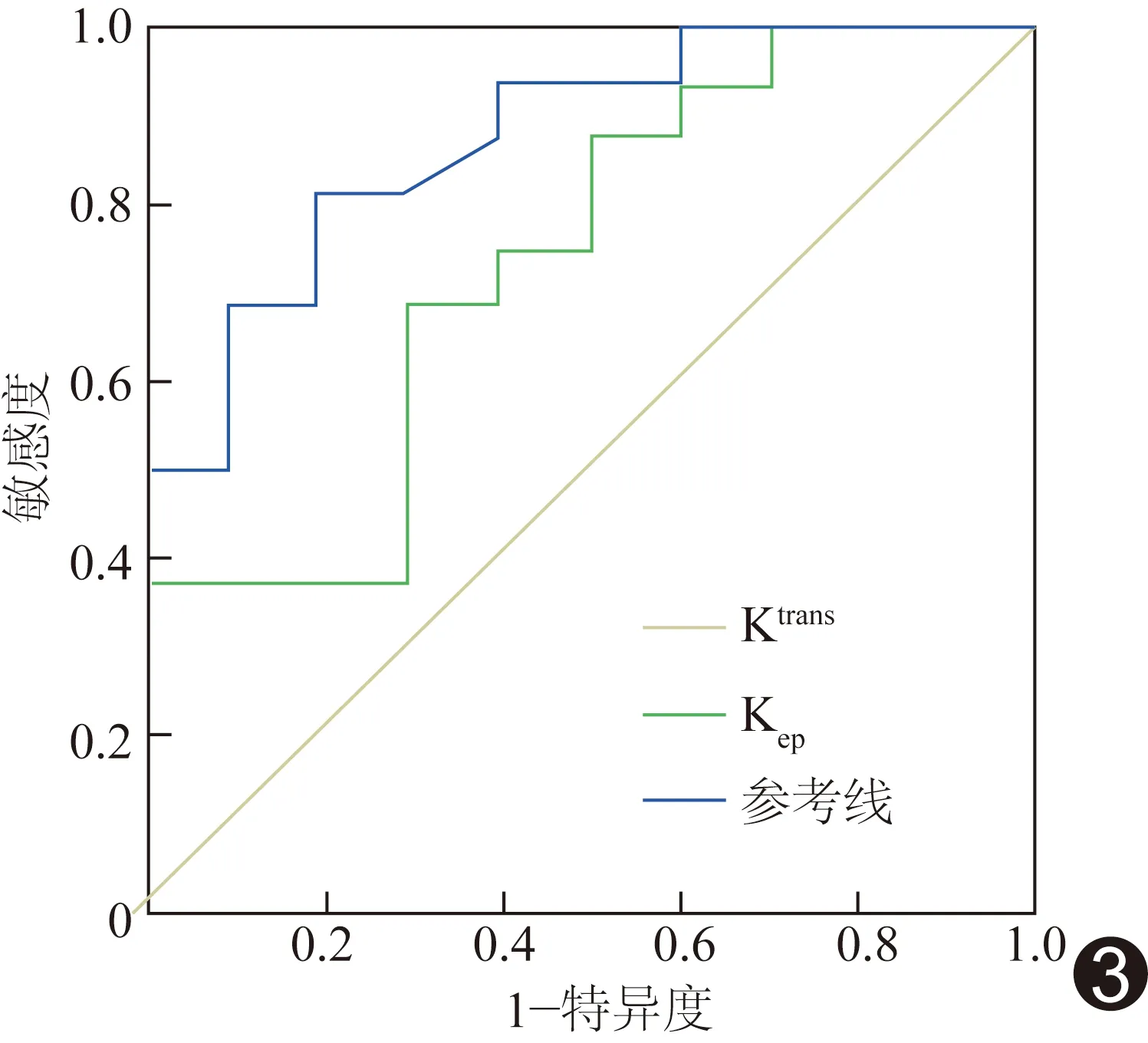
图3 Ktrans值和Kep值鉴别高、低级别前列腺癌ROC曲线
研究[8-9]表明,前列腺癌Gleason评分结果与微血管密度相关,肿瘤级别越高、分化程度越差,细胞代谢和增殖就越快,新生微血管增多,血管壁通透性和细胞外血管外间隙比例越高,对比剂交换速率越快。有学者[10]发现,与分化较好的前列腺癌相比,分化较差的前列腺癌表现出更强及更快的早期强化。Ktrans是单位时间内对比剂从血液进入到组织间隙的转运容积,取决于血流量、毛细血管渗透性及表面积;理论上肿瘤级别越高,Ktrans值越大,与前列腺癌Gleason评分呈正相关[11-12]。本研究中高级别组Ktrans值明显高于低级别组(P<0.05),但相关性分析显示Ktrans值与前列腺癌Gleason评分无明显相关,分析其原因,可能是本研究样本量较少,未能完全体现各Gleason分级间Ktrans值的差异。本研究中Ktrans值区分前列腺高级别癌和低级别癌的ROC曲线下面积为0.872,敏感度和特异度分别为81.3%和80.0%,提示其具有较高的诊断效能。本研究只将前列腺癌分为高级别组及低级别组,增大了组别间Ktrans值的差异,提高了Ktrans值鉴别高、低级别前列腺癌的诊断效能。
Kep是单位时间内由血管外细胞外间隙回流入血管的对比剂量,理论上Kep值与肿瘤级别相关。但大多数研究[13-15]结果表明Kep值与Gleason评分无相关性,而Vos等[12]的研究发现Kep值可评估外周带前列腺癌的侵袭性,并可用于鉴别外周带低级别与中、高级别前列腺癌。本研究中高级别组Kep值高于低级别组(P<0.05),但Kep值与前列腺癌Gleason评分无明显相关,分析原因,除样本量较少外,还在于理论上Kep=Ktrans/Ve,Kep值大小可能受Ktrans、Ve值的影响因素(微血管通透性、渗漏到血管外细胞外间隙对比剂的量、血管内外的渗透压等)的干扰,变异性较大[16]。有关Kep值的诊断价值需要进一步验证。
Ve是指单位体积组织内血管外细胞外间隙体积百分比,反映组织坏死及组织细胞化程度。本研究中高级别与低级别组的Ve值差异无统计学意义(P=0.994),Ve值与Gleason评分亦无明显相关,可能提示高级别前列腺癌与低级别前列腺癌的组织血管外细胞外间隙内成分差异较小。
本研究的局限性:①样本量较少,结果可能存在偏倚;②未将各序列图像显示不明确的病灶纳入研究,可能产生选择性偏倚。
综上所述,DCE-MRI定量参数Ktrans及Kep值有助于鉴别高、低级别前列腺癌,特别是Ktrans值具有较高诊断效能,可为临床制定治疗计划提供参考。
[参考文献]
[1] 马艺宁,杨华.前列腺癌预后因素的探讨.诊断病理学杂志,2007,14(5):387-389.
[2] Bill-Axelson A, Holmberg L, Ruutu M, et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med, 2011,364(18):1708-1717.
[3] Morash C, Tey R, Agbassi C, et al. Active Surveillance Guideline Development Group. Active surveillance for the management of localized prostate cancer: Guildline recommendations. Can Urol Assoc J, 2015,9(5-6):171-178.
[4] Bul M, van den Bergh RC, Zhu X, et al. Outcomes of initially expectantly managed patients with low or intermediate risk screen-detected localized prostate cancer. BJU Int, 2012,110(11):1672-1677.
[5] Heidenreich A, Bellmunt J, Bolla M, et al. EAU guidelines on prostate cancer. Part 1: Screening, diagnosis, and treatment of clinically localised disease. Eur Urol, 2011,59(1):61-71.
[6] Ozgur A, Onol FF, Turkeri LN. Important preoperative prognostic factors for extracapsular extension, seminal vesicle invasion and lymph node involvement in eases with radical retropublie prostatectomy. Int Urol Nephrol, 2004,36(3):369-373.
[7] Ahmed HU, Akin O, Coleman JA, et al. Transatlantic Consensus Group on active surveillance and focal therapy for prostate cancer. BJU Int, 2012,109(11):1636-1647.
[8] Brawer MK, Deering RE, Brown M, et al. Predictors of the pathological stage in prostate cancel. The role of neovascularity. Cancer, 1994,73(3):678-687.
[9] 李鹏,杨文君,陈志强,等.前列腺癌动态对比增强MRI与扩散加权成像的相关性.中国医学影像技术,2013,29(2):264-268.
[10] 刘莉,吴宁,欧阳汉.前列腺癌动态增强 MRI 的多样性表现及特点.中国医学影像技术,2011,27(12):2506-2510.
[11] 刘会佳,赵娓娓,任芳,等.3.0T动态增强磁共振对前列腺癌的定量分析研究.放射学实践,2014,29(5):477-481.
[12] Vos EK, Litjens GJ, Kobus T, et al. Assessment of prostate cancer aggressiveness using dynamic contrast-enhanced magnetic resonance imaging at 3 T. Eur Urol, 2013,64(3):448-455.
[13] 何为,刘毅,刘剑羽,等.3.0T MR动态增强扫描定量分析诊断前列腺癌的价值.中华放射学杂志,2014,48(3):215-218.
[14] Chen YJ, Chu WC, Pu YS, et al. Washout gradient in dynamic contrast-enhanced MRI is associated with tumor aggressiveness of prostate cancer. J Magn Reson Imaging, 2012,36(4):912-919.
[15] Rosenkrantz AB, Sabach A, Babb JS, et al. Prostate cancer: Comparison of dynamic contrast-enhanced MRI techniques for localization of peripheral zone tumor. AJR Am J Roentgenol, 2013,201(3):W471-W478.
[16] Sourbron SP, Buckley DL. Classic models for dynamic contrast -enhanced MRI. NMR Biomed, 2013,26(8):1004-1027.
猜你喜欢
杂志排行
中国医学影像技术的其它文章
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- Gynecologic imaging reporting and data system combined with three-dimensional contrast-enhanced ultrasonography for differential diagnosis of benign and malignant ovarian masses
- Gd-EOB-DTPA enhanced MRI in assessing whole liver and segmental liver function
- Consistency of different physicians in diagnosis of malignant breast lesions with breast CEUS predictive model: A multicenter study
- Stretched-exponential model of DWI in differentiating malignant and benign breast lesions
- Contrast-enhanced MRA in differential diagnosis of spinal cord vascular malformation and secondary vascular tortuosity caused by non vascular malformations on spinal cord
