Gynecologic imaging reporting and data system combined with three-dimensional contrast-enhanced ultrasonography for differential diagnosis of benign and malignant ovarian masses
2018-06-25,,,3,,,
, , ,3, , ,
(1.Department of Ultrasound, Zhangzhou Affiliated Hospital of Fujian Medical University, Zhangzhou 363000, China; 2.Department of Clinical Medicine, Quanzhou Medical College, Quanzhou 362000, China; 3.Department of Ultrasound, the Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China)
早期诊断卵巢癌是提高患者5年生存率的关键[1]。多项研究[2-3]已证实,通过妇科超声影像报告和数据系统(gynecologic imaging reporting and data system, GI-RADS)及三维超声造影(3D contrast enhanced ultrasound, 3D-CEUS)均可有效鉴别良恶性卵巢肿块。本研究旨在探讨GI-RADS及3D-CEUS联合应用在鉴别卵巢良恶性肿块中的价值。
1 资料与方法
1.1 一般资料 选取2015年7月—2016年7月期间于我院门诊及住院治疗的102例卵巢肿块患者,年龄16~68岁,平均(32.8±12.2)岁。纳入标准:①经常规二维超声发现卵巢占位,病灶表现为囊实性或实性肿块,或表现为壁厚、分隔及壁上可见乳头状突起的囊性肿块;②接受二维超声联合3D-CEUS检查;③获得手术病理或临床最终随访诊断结果。排除标准:①妊娠及哺乳期女性;②严重心脏病患者;③超声造影剂过敏。患者对本研究所有检查均知情同意。
1.2 仪器与方法 采用GE Voluson E8三维彩色超声显像仪,RIC5-9-D超宽阴道探头(频率5.0~9.0 MHz)及RAB2-5-D腹部探头(频率2.0~5.0 MHz)。造影剂为SonoVue(Bracco公司)。首先行二维超声扫查,观察卵巢肿块有无大乳头状突起物(≥7 mm)、有无中心性血流、是否合并腹腔积液,并测量病灶内分隔或囊壁的厚度、血流阻力指数(resistance index, RI)及病灶实性成分比例。而后行3D-CEUS,将造影剂加入5 ml生理盐水后,经患者肘静脉一次性团注2.5 ml,再尾随注入5 ml生理盐水,切换至静态3D-CEUS模式,机械指数(mechanical index, MI)为0.08。开启断层超声成像(tomography ultrasound imaging, TUI)模式,每10 s采集1次图像并储存。
1.3 图像分析 由1名高年资超声医师对卵巢肿瘤患者二维超声及增强早期(20~70 s)超声造影图像进行评估[4],再由另1名年资相当的医师独立评估图像。
采用GI-RADS评估方法对卵巢肿块进行分类。GI-RADS恶性指征[5]:①有大乳头状突起物(≥7 mm);②分隔或囊壁厚度≥3 mm;③有中心性血流;④RI<0.50;⑤病灶实性成分≥50%;⑥合并腹腔积液。
3D-CEUS恶性指征[6]:①病灶增强时间早于子宫肌层开始灌注(快速增强);②病灶增强水平高于子宫肌层增强水平(高增强);③病灶实性成分中造影剂分布不均匀;④病灶实性成分中血管密集、走行纡曲、杂乱。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以单因素χ2检验及多因素Logistic回归分析获得卵巢恶性肿块的独立预测因子,建立GI-RADS与3D-CEUS联合评分系统。绘制ROC曲线,获得鉴别诊断良恶性肿瘤的临界值,并以病理及最终临床随访诊断结果为金标准评价其诊断效能。采用配对Z检验比较GI-RADS联合3D-CEUS与单纯应用GI-RADS诊断卵巢恶性肿瘤的ROC曲线下面积(area under the curve, AUC),采用χ2检验比较其敏感度、特异度、阳性预测值、阴性预测值及准确率。P<0.05为差异有统计学意义。对2名医师评估结果的一致性分析采用Kappa检验,Kappa值≥0.75为一致性好,0.75>Kappa值≥0.4为一致性中等,Kappa值<0.4为一致性差。
2 结果
102例卵巢肿块中,98例经手术病理证实,4例经临床随访确诊;其中良性67例,包括成熟畸胎瘤15例、卵巢瘤样病变10例、子宫内膜异位囊肿9例、浆液性囊腺瘤13例、黏液性囊腺瘤8例、卵泡膜细胞瘤3例、卵泡膜纤维瘤3例、卵巢纤维瘤3例、卵巢甲状腺肿2例、间质性硬化瘤1例;恶性(含交界性肿瘤)35例,包括未成熟性卵巢畸胎瘤2例、卵巢颗粒细胞瘤3例、子宫内膜样癌2例、浆液性腺癌11例、黏液性腺癌5例、交界性浆液性腺瘤5例、交界性黏液性腺癌2例、卵巢鳞状细胞癌2例、转移性腺癌2例、卵巢恶性淋巴瘤1例。
对GI-RADS及3D-CEUS共10个恶性指征(图1)的单因素分析结果见表1,多因素Logistic回归分析结果见表2。综合单因素分析及多因素Logistic回归分析结果,构建GI-RADS与3D-CEUS联合评分系统,见表3。GI-RADS联合3D-CEUS诊断卵巢恶性肿块的ROC曲线见图2,以评分4分为临界值时诊断效能最佳,AUC值(0.969)大于单纯应用GI-RADS的AUC值(0.839),差异有统计学意义(Z=1.64,P=0.029);诊断敏感度、特异度、阳性预测值、阴性预测值及准确率均高于单纯应用GI-RADS,见表4。
一致性分析结果显示,2名医师间GI-RADS与3D-CEUS联合评分结果的一致性好,Kappa值为0.872。
3 讨论
经阴道二维超声是目前临床评估卵巢肿块的首选方法,但其鉴别良恶性肿块的能力仍有限。有经验的医师可根据卵巢肿块声像图特征判断其良恶性;借助评分系统或分类系统有助于进一步提高诊断准确率。

表1 二维超声及3D-CEUS征象单因素分析结果
注:3D-CEUS增强时间及增强水平均以子宫肌层灌注情况为参照

表2 超声恶性指征多因素Logistic回归分析结果
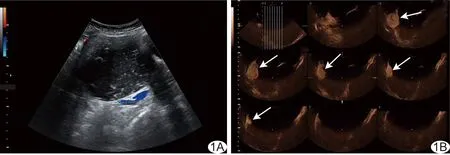
图1 卵巢黏液性囊腺瘤声像图 A.二维超声示病灶实性成分>50%,病灶内血流不丰富; B.3D-CEUS TUI模式清晰显示不均匀、高增强的乳头状突起(箭),评分4分
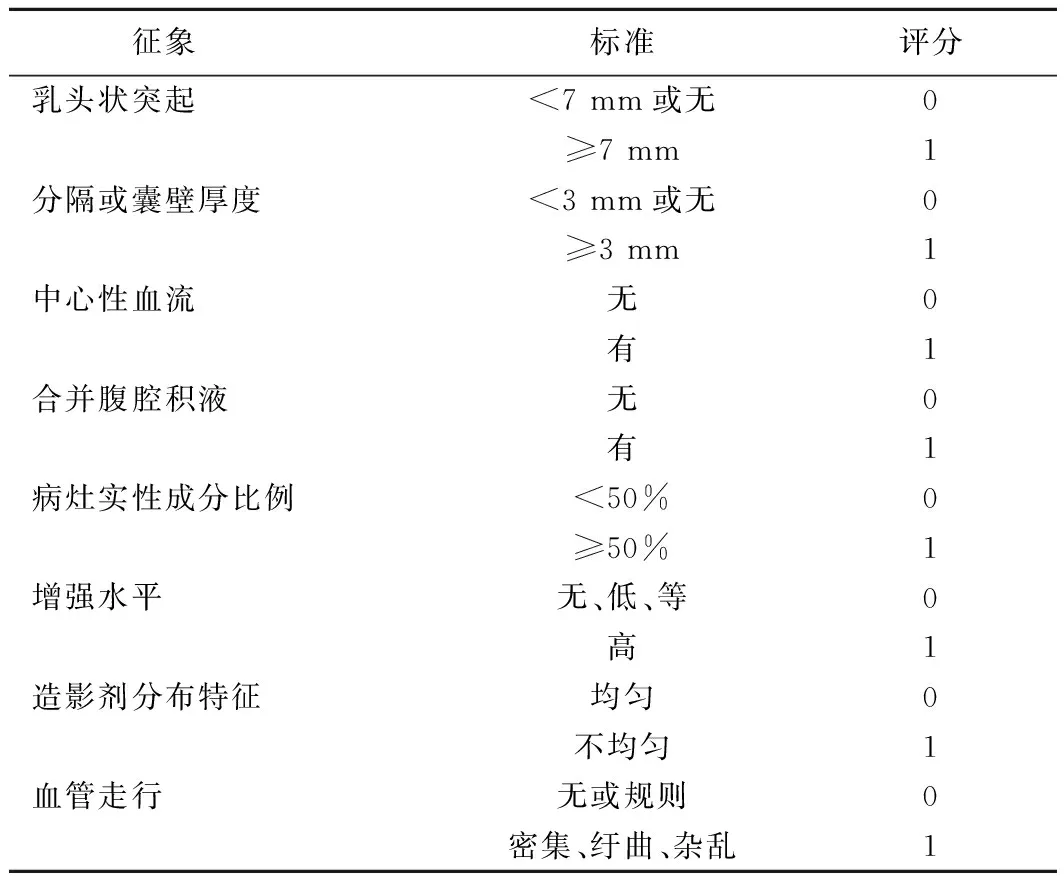
征象标准评分乳头状突起<7 mm或无0≥7 mm1分隔或囊壁厚度<3 mm或无0≥3 mm1中心性血流无0有1合并腹腔积液无0有1病灶实性成分比例<50%0≥50%1增强水平无、低、等0高1造影剂分布特征均匀0不均匀1血管走行无或规则0密集、纡曲、杂乱1
注:3D-CEUS增强时间及增强水平均以子宫肌层灌注情况为参照

表4 GI-RADS联合3D-CEUS诊断卵巢恶性肿块的效能(%)
陈秋月等[5]采用GI-RADS超声分类对999例附件肿物患者进行诊断性试验,结果显示该方法鉴别附件肿物良恶性的敏感度为99.1%,特异度为90.4%。然而GI-RADS鉴别卵巢肿瘤特异度仍显不足,有相当一部分以实性成分为主的囊实性或实性卵巢肿物实际为良性肿瘤[7],而GI-RADS将其归为恶性肿瘤,这在一定程度上限制了GI-RADS超声分类在鉴别良恶性卵巢肿瘤中的应用。
超声造影主要通过明确肿块实性成分有无活性及肿块灌注增强模式来鉴别良恶性卵巢肿块[8]。3D-CEUS在常规超声造影基础上结合三维成像的优势,实现类似CT的三维断层扫查,立体、实时显示卵巢肿瘤血管构象及微血管特征,可提高超声对卵巢良恶性肿块的鉴别诊断能力[9]。Xiang等[4]通过肿块形态、壁厚、内壁结构、分隔、与周围组织关系、合并腹腔积液情况及3D-CEUS模式下造影剂分布共7个指标建立评分系统,获得较好的诊断效能,但该研究选择评价指标缺乏依据,同时仅选择1个3D-CEUS指标,不够全面。本研究选取的10个超声恶性指征,其中包括6个指征GI-RADS 及4个指征3D-CEUS;单因素χ2检验及多因素Logistics回归分析证实,大乳头状突起物(≥7 mm)、分隔或囊壁厚度≥3 mm、有中心性血流、病灶实性成分≥50%、合并腹腔积液、高增强、造影剂分布不均匀以及血管密集、走行纡曲、杂乱,共8个指标为卵巢恶性肿块的独立预测因子,可作为构建GI-RADS与3D-CEUS联合评分系统的依据。

图2 GI-RADS联合3D-CEUS诊断卵巢恶性肿块ROC曲线
本研究结果表明,GI-RADS联合3D-CEUS鉴别卵巢良恶性肿块的敏感度、特异度及准确率均明显高于单纯应用GI-RADS。与单纯应用GI-RADS相比,GI-RADS联合3D-CEUS的优势在于:①通过3D-CEUS可根据增强时间、增强水平、病灶实性成分中造影剂分布特征及血管走行情况判断卵巢肿块良恶性,且具有较高鉴别诊断价值[10];②恶性肿瘤血管结构复杂,往往在不同平面纡曲走行,3D-CEUS为容积成像,可显示肿块血管的整体灌注信息,从而克服二维超声造影仅能从单一层面感兴趣区观察病变特征的不足,相对更为直观、全面[11];③大乳头状突起物(≥7 mm)为诊断卵巢恶性肿瘤的指征,但约20%良性卵巢肿物也可具此表现,使得二维超声假阳性率较高[12];通过3D-CEUS TUI模式可逐层显示病灶周边和内部血管分布情况,不仅有利于发现肿瘤内部二维超声不易检测到的乳头状突起,还可显示该乳头状突起的血流灌注情况[13-14]。
虽然3D-CEUS对卵巢肿块良恶性的鉴别具有诸多优势,但对于增强时相和增强程度与周围组织类似的肿块,由于造影剂注入可使周围组织中的血管也被凸显,使得3D-CEUS对肿块形态的分辨能力下降,而肿物形态对判断其性质具有重要意义[15]。因此,作为诊断卵巢肿瘤的辅助手段,3D-CEUS需联合GI-RADS进行全面分析,以获得最佳效果。
[参考文献]
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics. CA Cancer J Clin, 2014,64(5):9-29.
[2] Amor F, Vaccaro H, Alcázar JL, et al. Gynecologic imaging reporting and data system: A new proposal for classifying adnexal masses on the basis of sonographic findings. J Ultrasound Med, 2009,28(3):285-291.
[3] 刘婧,陈秋月,吕国荣.超声国际卵巢肿瘤研究组简单法则与妇科影像报告与数据系统分类诊断卵巢肿瘤的比较.中国医学影像技术,2017,33(5):739-742.
[4] Xiang H, Huang R, Cheng J, et al. Value of three-dimensional contrast-enhanced ultrasound in the diagnosis of small adnexal masses. Ultrasound Med Biol, 2013,39(5):761-768.
[5] 陈秋月,吕国荣.GI-RADS分类在妇科附件肿块诊断中的应用.中国超声医学杂志,2013,9(6):527-530.
[6] 中国医师协会超声医师分会编写组.产前超声与超声造影检查指南.北京:人民军医出版社,2013:93-96.
[7] Alcázar JL, Rodriguez D. Three-dimensional power Doppler vascular sonographic sampling for predicting ovarian cancer in cystic-solid and solid vascularized masses. J Ultrasound Med, 2009,28(3):275-281.
[8] 吴莹,彭鸿灵,赵霞.不同影像学检查诊断卵巢肿瘤:Meta分析.中国医学影像技术,2016,32(8):1244-1249.
[9] Hu R, Xiang H, Mu Y, et al. Combination of 2- and 3-dimensional contrast-enhanced transvaginal sonography for diagnosis of small adnexal masses ovarian cancer. J Ultrasound Med, 2014,33(11):1889-1899.
[10] 杨帆,杨太珠,罗红,等.超声造影成像在卵巢肿物中的诊断价值.四川大学学报(医学版),2013,44(3):424-428.
[11] Huchon C, Metzger U, Bats A, et al. Value of three-dimensional contrast-enhanced power Doppler ultrasound for characterizing adnexal masses. J Obstet Gynaecol Res, 2012,38(5):832-840.
[12] Testa AC, Timmerman D, Exacoustos C, et al. The role of CnTI-SonoVue in the diagnosis of ovarian masses with papillary projections: A preliminary study. Ultrasound Obstet Gynecol, 2007,29(5):512-516.
[13] Jiang ZH, Li KT, Tian JW, et a1. An overview of the development and application of the sonographic scoring system: Differentiation of malignant from benign ovarian tumors. Arch Gynecol Obstet, 2016,293(2):303-310.
[14] Ma X, Zhao Y, Zhang B, et al. Contrast-enhanced ultrasound for differential diagnosis of malignant and benign ovarian tumors: Systematic review and meta-analysis. Ultrasound Obstet Gynecol, 2015,46(3):277-283.
[15] Liu Z, Yang F, Zhang Y, et al. Conventional, Doppler and contrast-enhanced ultrasonography in differential diagnosis of ovarian masses. Cell Physiol Biochem, 2016,39(6):2398-2408.
猜你喜欢
杂志排行
中国医学影像技术的其它文章
- CT morphological characteristics of plantar nerves and their significances in diabetic foot
- Quantitative analysis of dynamic contrast-enhanced MRI in distinguishing different grades of prostate cancer
- Gd-EOB-DTPA enhanced MRI in assessing whole liver and segmental liver function
- Consistency of different physicians in diagnosis of malignant breast lesions with breast CEUS predictive model: A multicenter study
- Stretched-exponential model of DWI in differentiating malignant and benign breast lesions
- Contrast-enhanced MRA in differential diagnosis of spinal cord vascular malformation and secondary vascular tortuosity caused by non vascular malformations on spinal cord
