磺胺-磺胺二甲基嘧啶污染对小白菜生长和生理指标的影响及相关性分析
2018-06-25司雄元熊科胜徐慧敏檀华蓉司友斌
司雄元, 熊科胜, 徐慧敏, 檀华蓉, 司友斌
(1.安徽农业大学资源与环境学院, 安徽 合肥 230036; 2.安徽农业大学生物技术中心, 安徽 合肥 230036; 3.安徽农业大学农田生态保育与污染防控安徽省重点实验室, 安徽 合肥 230036)
多磺胺类抗生素(sulfonamides,SAs) 具有对氨基苯磺酞胺结构,是人工合成的的一类抗菌药物,具有抗菌谱广、使用方便、价格低廉、性质稳定、毒性小、口服吸收迅速以及疗效好等优点,在抗感染药物市场中占有一定地位[1],是我国畜禽养殖业中广泛使用的兽用抗菌药物之一[2]。由于抗生素的滥用、超量使用[3],同时抗生素的生物利用率有限,超过一半的抗生素随着动物粪尿排出体外[4],致使环境中抗生素污染风险备受关注,如环境(土壤、水体等)中SAs残留量检测及环境质量影响评价[5-7]。
此外,已有报道显示,蔬菜可以吸收环境中的SAs,蔬菜中均不同程度检测出磺胺嘧啶、磺胺间甲氧嘧啶和磺胺甲恶唑,其中青菜中SAs残留量最高[8],根茎类蔬菜平均含量为289 μg·g-1,瓜果类蔬菜平均含量为143 μg·kg-1,叶菜类蔬菜平均含量为98.1 μg·kg-1[9]。然而对于磺胺胁迫条件下蔬菜的生理及生长研究还鲜有报道。植物种子的萌发和根长被认为是直观、有效的污染物生态毒理效应指标[10]。污染胁迫会导致蔬菜的多种生理应激反应,使其代谢加速和能量需求增加,同时伴随着活性氧自由基(reactive oxygen species, ROS)的过量产生。自由基累积过多会引起蛋白质、核酸和甾醇类物质损伤以及细胞膜脂质过氧化等[11]。过氧化物酶(POD)和过氧化氢酶(CAT)是机体清除自由基的关键酶类,而丙二醛(MDA)作为脂类物质氧化应激的最终产物,可以衡量机体内活性氧水平和氧化应激程度[12]。叶绿素和可溶性蛋白质是重要的生理生化指标,反映了外界环境因子的影响程度[13-14]。
笔者以小白菜(Brassicacampestris)为研究对象,探讨其在SAs污染情况下种子萌发、抗氧化酶活性和MDA含量,以及叶绿素、蛋白质含量等相关生理生长指标的变化,对探究SAs对蔬菜生长及品质的影响和保障食品安全具有现实意义。
1 材料与方法
1.1 实验材料
小白菜(Brassicacampestris)品种为无夕白,获取于丰原种子公司;磺胺(SA)纯度w>99%,上海阿拉丁公司;磺胺二甲基嘧啶(SMT)纯度w>99%,上海阿拉丁公司。
1.2 实验步骤
1.2.1SAs溶液的配制
采用超纯水配制母液ρ均为500 mg·L-1,单一SAs污染溶液ρ分别设置为5、10、20、40和60 mg·L-1,复合SAs污染溶液SA和SMTρ分别设置为20和20、20和40、 40和20、40和40 mg·L-1。
1.2.2种子萌发实验
将小白菜种子用φ为3%的双氧水消毒浸泡15 min,用去离子水冲洗干净,晾干待用。在9 cm直径的培养皿中等距放置25粒大小均一、颗粒饱满的种子,培养皿内铺有双层滤纸,每培养皿分别加入5 mL不同浓度的单一及复合SAs溶液,每个处理浓度设置4个重复和空白对照(CK)。将培养皿密封后,置于温度为25 ℃、湿度为80%的培养箱中避光培养。当CK处理小白菜种子发芽率大于90%,平均根伸长至20 mm时实验结束[14]。在根伸长抑制率为10%~60%区间内,用超纯水配置SA和SMT的不同处理浓度,进行种子萌发实验[15]。参照国家种子质量检验标准,于第3、7天记录所有种子的发芽个数,计算发芽势、发芽率和发芽指数。
1.2.3水培实验
将种子在电热恒温培养箱中催芽72 h后,将其转移到含有不同浓度SAs的50 mL Hoagland营养液中培养,置于阳光温室(25 ℃),每个浓度梯度设4个重复。每2 d换一次培养液。从添加污染物开始至培养14 d后收获幼苗,用于生长生理指标的测定[16]。
1.3 测定方法与数据分析
1.3.1小白菜生长指标的测定
(1) 种子萌发实验:按国家种子质量检验标准,发芽势于试验第3天测定,发芽率则于试验第7 天测定,各指标计算公式如下:
发芽势=前3 d内正常发芽种子数/供试种子数×100%,发芽率=前7 d内正常发芽种子数/供试种子数×100%,发芽指数=某段时间内发芽总数/相应的发芽时间。
(2)根长和芽长的测定:用直尺测量小白菜的根伸长和芽伸长。
(3)鲜重和干重的测定:每个处理浓度取10株小白菜样品清洗干净,用滤纸吸干表面水分后称取鲜重,然后冷冻干燥48 h,称取小白菜干重,将干燥好的小白菜样品研磨混匀后,过0.150 mm孔径筛保存于干燥器中备用。
1.3.2小白菜生理指标的测定
叶绿素含量采用改进的混合液提取法[17]测定。可溶性蛋白质含量采用考马斯亮蓝G250染色法[18]测定 。丙二醛的含量采用硫代巴比妥酸法测定[19]测定。过氧化物酶活性采用愈创木酚氧化法[20]测定。过氧化氢酶活性采用高锰酸钾滴定法[21]测定。
1.3.3蔬菜中SAs的提取及高效液相色谱检测方法
以φ=0.1%的H3PO4(pH=2.2)水溶液提取蔬菜中SAs;以Penomenex C18为分析柱,以w=0.5%(NH4)2HPO4-H3PO4溶液(pH=3.0)和乙腈为流动相,柱温30 ℃,流速1.0 mL·min-1,检测波长为270 nm的方法检测蔬菜中SAs含量[22]。
1.4 数据分析
采用DPS 7.05软件进行LSD差异显著性分析,采用SPSS 18.0软件进行Pearson相关性分析,采用Origin 8.5软件绘图。
2 结果与分析
2.1 SA和SMT对小白菜生长的影响
2.1.1SA和SMT对种子萌发的影响
不同浓度SA和SMT污染对小白菜种子发芽势、发芽率和发芽指数的影响如表1所示。从表1可知,当ρ(SAs)为0~40 mg·L-1时白菜种子发芽势、发芽率和发芽指数总体呈下降趋势,但未达显著水平;ρ(SA)达60 mg·L-1时对种子萌发仍无抑制作用,而当ρ(SMT)达60 mg·L-1时对种子萌发有显著抑制作用,这与金彩霞等[23]的研究结果一致,种子萌发过程中可从胚内获取养分,从而减少外界环境对种子萌发的影响。
表1SAs对白菜种子发芽势、发芽率和发芽指数的影响
Table1EffectofSAsonthegerminationvigor,germinationrateandgerminationindexofBrassicacampestrisseeds

污染物处理组ρ1)/(mg·L-1)发芽势/%发芽率/%发芽指数/% 空白CK079.64±7.19a90.41±8.23a74.55±6.01a SAA1582.22±6.74a93.67±6.59a74.50±6.14a A21079.20±6.31a92.73±9.09a74.33±6.79a A32079.59±7.89a91.44±5.20a73.32±6.58a A44077.46±8.97a90.12±9.53a72.19±5.62a A56075.52.±6.17a87.69±8.21a71.43±6.16a SMTB1578.36±7.81a89.11±7.48a73.62±4.97a B21078.14±8.40a91.70±9.31a73.01±8.14a B32077.87±9.12a90.07±12.65a72.08±7.19a B44074.59±10.25a89.73±10.47a72.22±11.54a B56066.59±9.25b86.49±9.36b71.01±12.16b SA-SMTA3B320,2078.67±8.93a91.99±8.87a74.64±4.16a A3B420,4076.33±8.74a90.12±12.32a73.18±6.17a A4B340,2079.39±9.09a90.85±9.71a72.33±6.46a A4B440,4073.84±10.08a88.94±11.33a71.79±4.72a
同一列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)SA-SMT复合污染下,前者为SA浓度,后者为SMT浓度。
植物种子在一定浓度污染物胁迫下萌发表现为不受抑制或部分受抑制,可能是由于种皮阻碍了外界污染物向胚芽渗透,只有环境受到严重污染时种子萌发才会被抑制。SA-SMT复合污染ρ均为40 mg·L-1时对种子萌发仍无显著抑制作用。
2.1.2SA和SMT对小白菜生长指标(根伸长、芽伸长、干重和鲜重)的影响
从表2可知,当ρ(SAs)为5 mg·L-1时,仅SMT对根伸长有显著抑制作用,其他指标均无显著影响,但随着SAs浓度增加,SA和SMT单一及复合污染对小白菜各生长指标均存在显著抑制作用。
MIGLIORE 等[24]研究表明植物体内磺胺类污染物会与叶酸产生竞争吸收,降低植物体内叶酸含量,叶酸影响嘌呤的合成,从而影响其正常的生理功能,使根伸长和芽伸长受到抑制。 单一污染下,SAs对根伸长的影响大于对芽伸长的影响,其中SMT对小白菜的生理指标影响大于SA。SA和SMT单一污染对小白菜干重和鲜重有不同程度的影响,ρ(SMT)和ρ(SA)均为5 mg·L-1时,小白菜干重和鲜重有增加趋势,但未达显著水平,随着SAs浓度的增加,小白菜鲜重和干重均有所下降。总体来说,单一SMT污染对小白菜生物量的影响要大于单一SA污染。
表2SAs污染对小白菜根伸长、芽伸长、鲜重和干重的影响
Table2EffectofSAsontherootlength,sprout,freshweightanddryweightofBrassicacampestris

污染物处理组ρ1)/(mg·L-1)根伸长/mm芽伸长/mm鲜重/〔g·(10株)-1〕干重/〔g·(10株)-1〕 空白CK029.95±0.54a14.30±0.28a7.13±0.33ab0.550±0.028ab SAA1529.43±0.33a14.50±0.36a7.15±0.06ab0.553±0.029a A21026.95±0.31b11.68±0.41c7.13±0.33ab0.550±0.018abA32019.55±1.35e10.43±0.72de7.15±0.17ab0.543±0.015abcdA44018.65±0.34f10.18±0.05def7.03±0.21abc0.537±0.022abcdeA56016.60±0.36g9.85±0.35fg7.00±0.18abc0.535±0.013abcde SMTB1527.43±0.33b14.00±0.26a7.25±0.17a0.555±0.038a B21025.45±0.31c12.48±0.39b7.25±0.17a0.545±0.019abcB32022.30±0.18d10.68±0.70d7.10±0.08ab0.537±0.010abcdeB44018.65±0.34f9.85±0.42fg7.00±0.12abc0.535±0.010abcdeB56014.10±0.77h9.38±0.40g6.80±0.20cd0.525±0.010bcde SA-SMTA3B320,2019.68±1.05e10.55±0.58d7.08±0.10ab0.532±0.005abcdeA3B420,4018.33±0.40f9.95±0.06ef6.93±0.05bcd0.520±0.001deA4B340,2018.38±0.44f9.95±0.10ef6.90±0.01bcd0.518±0.010cdeA4B440,4018.23±0.22f9.85±0.19fg6.70±0.16d0.515±0.006e
同一列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)SA-SMT复合污染下,前者为SA浓度,后者为SMT浓度。
SA-SMT复合污染时,当ρ(SMT)为20 mg·L-1时,对根伸长和芽伸长在SA低浓度下呈拮抗作用,SA高浓度下为协同作用;对鲜重和干重均表现为协同作用。当ρ(SMT)为40 mg·L-1时,仅SA低浓度下对芽伸长表现为拮抗作用,其他均为协同作用。当ρ(SA)为20 mg·L-1时,仅SMT高浓度下对芽伸长表现为拮抗作用;当ρ(SA)为40 mg·L-1时,SMT对各指标均为协同抑制作用。
2.2 SA和SMT对小白菜生理的影响
2.2.1SA和SMT对叶绿素含量的影响
从表3可知,当SAs单一污染为5 mg·L-1时,总叶绿素含量与对照组无显著差异,但随着浓度的升高,各浓度处理间与对照组相比总叶绿素、叶绿素a和叶绿素b含量均显著降低(P<0.05),且SMT对总叶绿素、叶绿素a的影响强于SA;低浓度下SMT对叶绿素b的抑制作用强于SA,但当ρ达60 mg·L-1时SA抑制作用强于SMT。逆境可导致小白菜体内活性氧的累积,进而使叶绿素加速分解[25]。SAs污染条件下,叶绿素a受到的抑制作用强于叶绿素b,这与叶绿素a较叶绿素b敏感、更易与活性氧发生反应的结论[14]一致。当SAs浓度较高,产生脂质过氧化作用时,细胞膜结构和功能遭到破坏,叶绿素下降影响小白菜的生长发育,这与顾国平等[26]的研究结果相一致。SA-SMT复合污染对小白菜叶绿素含量的影响在较低浓度时表现为拮抗作用,在较高浓度时表现为协同作用。
2.2.2SA和SMT对小白菜过氧化物酶(POD)活性的影响
从图1可知,在单一污染条件下,SA和SMT对小白菜POD活性影响趋势相似,小白菜体内POD活性均为先增加后降低。ρ(SA)为40 mg·L-1,ρ(SMT)在10 mg·L-1时POD活力达最高,各处理之间均有显著差异(P<0.05),这与高若松[27]研究磺胺间甲氧嘧啶对大豆幼苗体内POD活性变化一致。
单一污染下,20 mg·L-1SA使小白菜中POD活性较CK处理增加28.94%,而在20 mg·L-1SMT下,小白菜POD活性较CK处理增加42.10%,而在SA-SMT复合污染(ρ均为20 mg·L-1)下,小白菜POD活性较CK处理增加42.21%,比相同浓度的单一SMT污染的增加程度稍大。在SA-SMT复合污染(ρ均为40 mg·L-1)条件下,POD活性最低。SA-SMT 复合污染对小白菜POD活性的影响均表现为协同抑制作用。
表3SAs污染对小白菜叶绿素含量的影响
Table3EffectofSAsonthechlorophyllcontentofBrassicacampestris
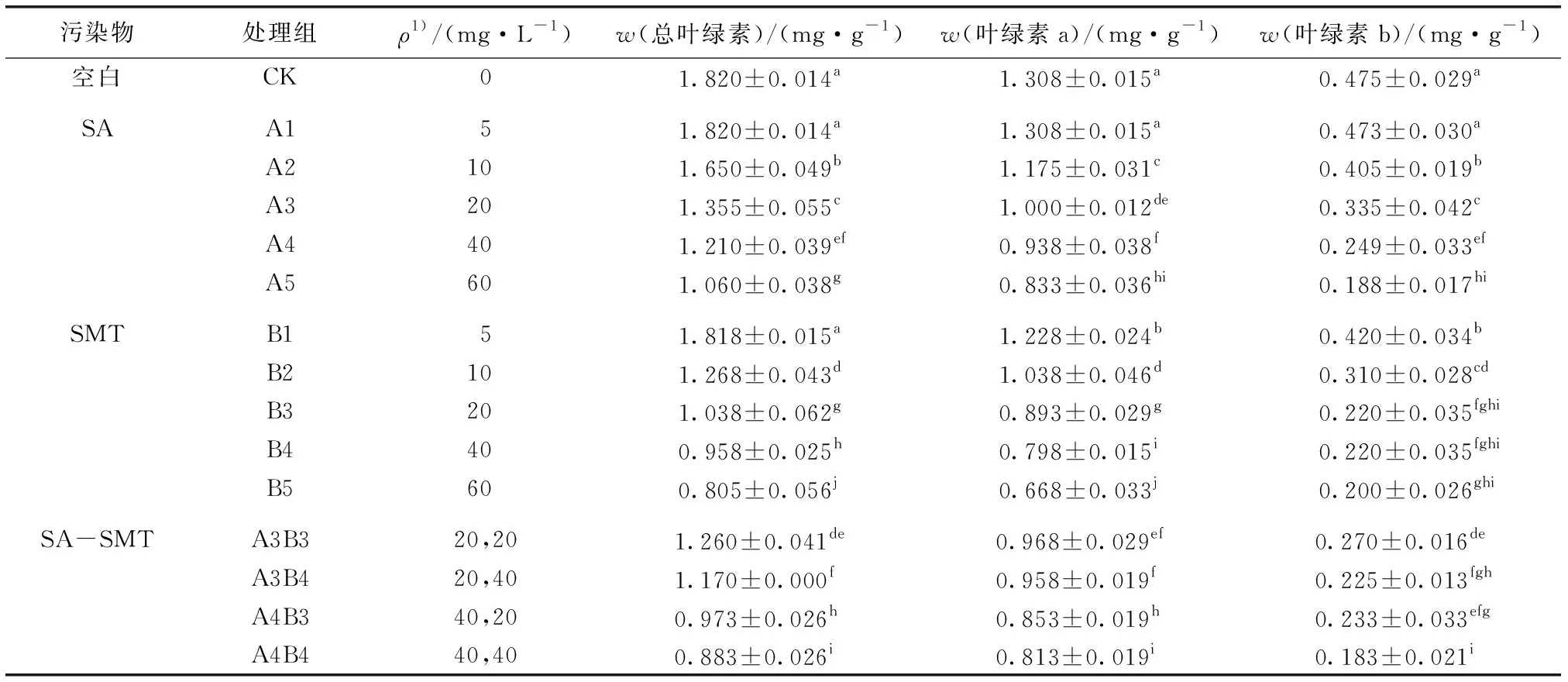
污染物处理组ρ1)/(mg·L-1)w(总叶绿素)/(mg·g-1)w(叶绿素a)/(mg·g-1)w(叶绿素b)/(mg·g-1) 空白CK01.820±0.014a1.308±0.015a0.475±0.029a SAA151.820±0.014a1.308±0.015a0.473±0.030a A2101.650±0.049b1.175±0.031c0.405±0.019b A3201.355±0.055c1.000±0.012de0.335±0.042c A4401.210±0.039ef0.938±0.038f0.249±0.033efA5601.060±0.038g0.833±0.036hi0.188±0.017hi SMTB151.818±0.015a1.228±0.024b0.420±0.034b B2101.268±0.043d1.038±0.046d0.310±0.028cdB3201.038±0.062g0.893±0.029g0.220±0.035fghiB4400.958±0.025h0.798±0.015i0.220±0.035fghiB5600.805±0.056j0.668±0.033j0.200±0.026ghi SA-SMTA3B320,201.260±0.041de0.968±0.029ef0.270±0.016deA3B420,401.170±0.000f0.958±0.019f0.225±0.013fghA4B340,200.973±0.026h0.853±0.019h0.233±0.033efgA4B440,400.883±0.026i0.813±0.019i0.183±0.021i
同一列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。1)SA-SMT复合污染下,前者为SA浓度,后者为SMT浓度。

各处理组含义见表1。直方柱上方英文小写字母不同表示各处理组间POD活性差异显著(P<0.05)。

各处理组含义见表1。直方柱上方英文小写字母不同表示各处理组间CAT活性差异显著(P<0.05)。
2.2.3SA和SMT污染对小白菜过氧化氢酶(CAT)活性的影响
图2为在SA和SMT单一复合污染条件下小白菜CAT活性的变化,SA和SMT单一污染对小白菜CAT活性的影响不同,当ρ(SA)<20 mg·L-1时小白菜CAT活性低于对照,但随着SA浓度的增加,产生较多H2O2,诱导CAT活性升高[28]。而SMT对小白菜中CAT活性的影响呈现低浓度的激活作用和高浓度的抑制作用,且各处理之间均具有显著性差异(P<0.05)。SA-SMT复合污染对CAT活性的抑制增加,为协同抑制作用。
2.2.4SA和SMT对小白菜可溶性蛋白质含量的影响
从图3可知,ρ(SA)≤20 mg·L-1时小白菜体内可溶性蛋白质含量与CK差异未达显著水平(P>0.05),当ρ(SA)>20 mg·L-1时可溶性蛋白质含量显著下降。随SMT污染浓度提高,可溶性蛋白质含量不断降低,这与赵保真[16]研究结果相类似,当磺胺类药物污染浓度超过小白菜的忍受阈值,蛋白合成就会受阻,含量下降。单一污染下,SMT污染对小白菜蛋白质含量的影响要大于SA污染处理。在SA-SMT复合污染条件下,SA与SMT混合污染(ρ均为20 mg·L-1)会在一定程度上缓解SA对小白菜中蛋白质含量的毒性效应而表现为拮抗作用,ρ(SMT)浓度较高(40 mg·L-1)时与SA混合增加了SA对小白菜中蛋白质的毒性效应,表现为协同作用。

各处理组含义见表1。小白菜质量以鲜重计。直方柱上方英文小写字母不同表示各处理组间可溶性蛋白质含量差异显著(P<0.05)。
2.2.5SA和SMT污染对小白菜丙二醛(MDA)含量的影响
从图4可知,在SA单一污染条件下小白菜中MDA含量随SA浓度增加而增加,当ρ(SA)为60 mg·L-1时MDA含量显著增加,这与徐敦明等[29]研究得到的农药对上海青(Brassicarapa)的影响结果一致。

各处理组含义见表1。直方柱上方英文小写字母不同表示各处理组间MDA含量差异显著(P<0.05)。
不同污染物对小白菜体内MDA含量的影响不同,SMT单一污染时小白菜中MDA含量随SMT浓度的増加呈先增加后降低趋势,并达显著水平。MDA含量与污染物浓度及抗氧化酶保护系统等有关,MDA含量增加验证了植物细胞启动膜保护系统的应激机制[30]。当ρ(SMT)≥40 mg·L-1时小白菜体内MDA含量下降,可能与白菜中SMT的吸收速率降低及抗氧化酶保护的滞后性有关。SA和SMT复合污染时MDA含量也呈降低趋势。
2.3 小白菜对SA和SMT的吸收及富集
从表4可知,小白菜对SA和SMT的吸收累积有一定差异性,随着SA和SMT浓度的增加,小白菜中SA和SMT含量也增加,累积量表现为SMT>SA。在低浓度处理下,小白菜体内SA和SMT含量差异不明显,只有在高浓度时小白菜体内SA和SMT积累量才呈显著差异。当ρ为60 mg·L-1时,白菜体内SMT含量最高,累积量达1.618 mg·kg-1,而SA累积量只有0.873 mg·kg-1。
表4不同浓度污染下小白菜中SA和SMT含量
Table4ContentsofSAandSMTinBrassicacampestrisunderdifferentconcentrationsofpollution

ρ/(mg·L-1)w(SA)/(mg·kg-1)富集系数w(SMT)/(mg·kg-1)富集系数 0NDNDNDND 5NDND0.023±0.002a0.004 100.056±0.034a0.0060.037±0.014a0.004 200.171±0.012b0.0070.637±0.110b0.031 400.452±0.094c0.0110.865±0.073c0.021 600.873±0.150d0.0141.618±0.102d0.026
ND表示未检出。同一列数据后英文小写字母不同表示处理间某指标差异显著(P<0.05)。
富集系数指植物体内抗生素含量与溶液中该抗生素含量的比值,是评价植物富集抗生素能力的指标之一,它反映了植物对抗生素的吸收能力大小。富集系数越大,富集能力越强[31]。从表4可知,ρ(SAs)为5~60 mg·L-1时,小白菜对SA的富集系数为0~0.014,对SMT的富集系数为0.004~0.031。随着浓度的升高,小白菜对SA的富集系数呈升高趋势,而对SMT的富集系数呈先升高后降低趋势。相同浓度下小白菜幼苗对SA和SMT的富集系数整体上为SMT>SA,说明小白菜在幼苗期更容易从环境中吸收SMT。
2.4 SAs与小白菜生长生理指标的相关性分析
SAs与其他生长生理指标相关性分析见表5~6。小白菜体内SA、SMT含量与SAs污染浓度呈极显著正相关关系,且与SA的相关性高于SMT;SAs污染浓度及小白菜体内吸收SAs与各指标具有类似的相关性,但不同磺胺抗生素种类与各指标的相关性存在差异。
环境中和小白菜体内SA浓度与CAT、POD活性均无相关性,与MDA含量均呈正相关关系,与其他指标呈不同程度的负相关关系,环境中SA浓度与各指标的相关性大小顺序为叶绿素含量>可溶性蛋白质含量>鲜重>MDA含量>根长>干重>芽长;小白菜体内SA浓度与各指标的相关性大小顺序为MDA含量>可溶性蛋白质含量>叶绿素>鲜重>根长>干重>芽长。
表5SA污染浓度与小白菜生长生理指标的相关性分析
Table5CorrelationbetweenSAconcentrationswithgrowthandphysiologicalindexesinBrassicacampestris
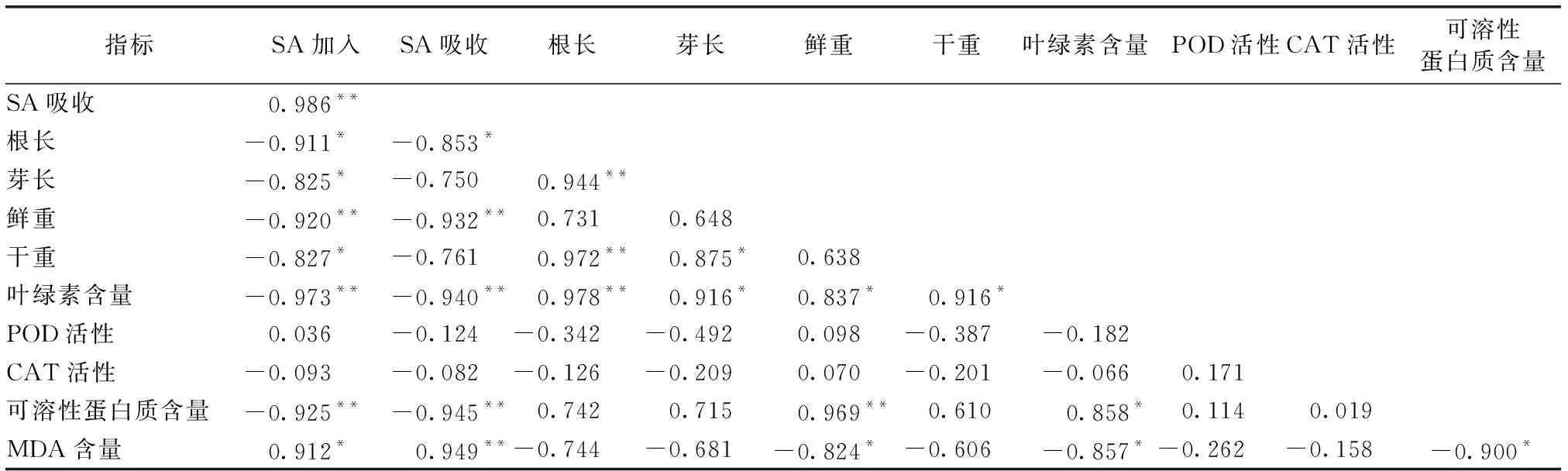
指标SA加入SA吸收根长芽长鲜重干重叶绿素含量 POD活性CAT活性可溶性蛋白质含量 SA吸收0.986** 根长-0.911*-0.853* 芽长-0.825*-0.750 0.944** 鲜重-0.920**-0.932**0.7310.648 干重-0.827*-0.7610.972**0.875*0.638叶绿素含量-0.973**-0.940**0.978**0.916*0.837* 0.916* POD活性0.036-0.124-0.342-0.4920.098-0.387-0.182 CAT活性-0.093-0.082-0.126-0.2090.070-0.201-0.0660.171可溶性蛋白质含量-0.925**-0.945**0.7420.7150.969**0.6100.858*0.1140.019 MDA含量0.912*0.949**-0.744-0.681-0.824*-0.606-0.857*-0.262-0.158-0.900*
**表示P<0. 01, *表示P<0.05。
表6SMT污染浓度与小白菜生长生理指标的相关性分析
Table6CorrelationbetweenSMTconcentrationswithgrowthandphysiologicalindexesinBrassicacampestris
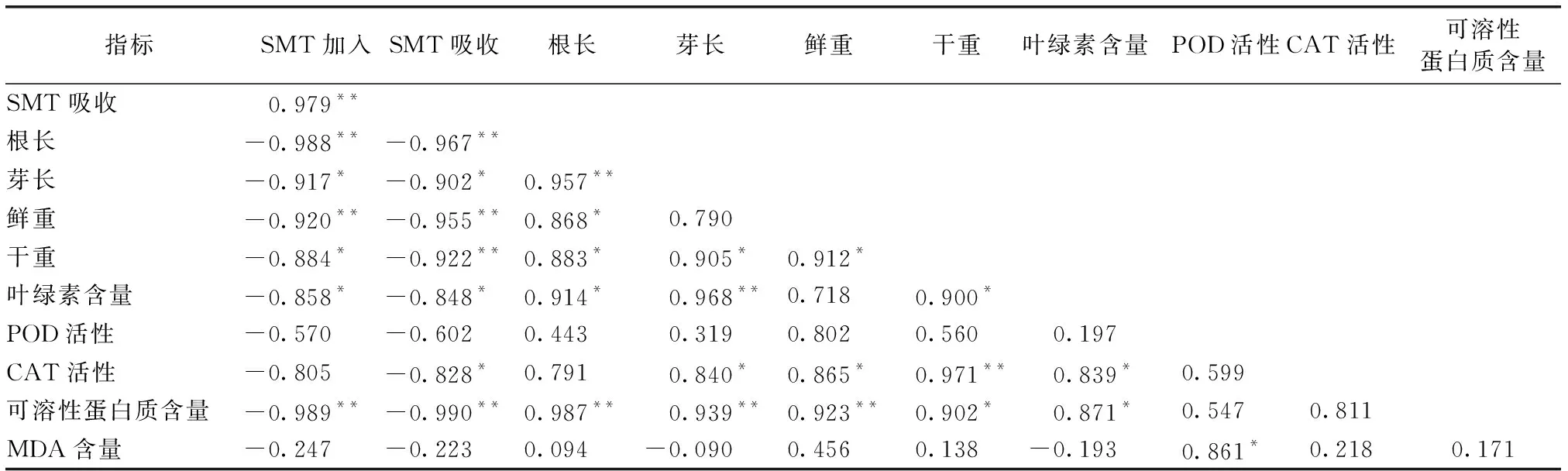
指标SMT加入SMT吸收根长芽长鲜重干重叶绿素含量 POD活性CAT活性可溶性蛋白质含量 SMT吸收0.979** 根长-0.988**-0.967** 芽长-0.917*-0.902*0.957** 鲜重-0.920**-0.955**0.868*0.790 干重-0.884*-0.922**0.883*0.905*0.912* 叶绿素含量-0.858*-0.848*0.914*0.968**0.7180.900* POD活性-0.570-0.6020.4430.3190.8020.5600.197 CAT活性-0.805-0.828*0.7910.840*0.865*0.971**0.839*0.599 可溶性蛋白质含量-0.989**-0.990**0.987**0.939**0.923**0.902*0.871*0.5470.811 MDA含量-0.247-0.2230.094-0.0900.4560.138-0.1930.861*0.2180.171
**表示P<0. 01, *表示P<0.05。
环境中和小白菜体内SMT浓度与各生长生理指标均呈负相关关系,且与MDA含量的相关性均较差,其中环境中SMT浓度与其他各指标间的相关性大小顺序为可溶性蛋白质含量>根长>鲜重>芽长>干重>叶绿素>CAT活性>POD活性;小白菜体内SMT含量与其他指标的相关性大小顺序为可溶性蛋白质含量>根长>鲜重>干重>芽长>叶绿素>CAT活性>POD活性。比较发现,环境中和小白菜体内SA浓度与小白菜的叶绿素、可溶性蛋白质含量间均呈极显著相关关系,环境中和小白菜体内SMT浓度与小白菜的可溶性蛋白质含量、根长和鲜重间均呈极显著相关关系。
SA-SMT复合污染下,当ρ(SA)为20 mg·L-1时SMT仅与MDA含量呈正相关关系,与其他各指标均呈负相关关系,SMT与叶绿素总量呈极显著相关关系,与CAT活性呈显著相关关系;当ρ(SA)为40 mg·L-1时SMT浓度与芽伸长、根伸长、鲜重、可溶性蛋白质含量、POD活性及MDA含量的相关性均有所提高,而与叶绿素含量和CAT活性相关性有所下降,SMT浓度仅与POD活性呈极显著相关;当ρ(SMT)为20 mg·L-1时SA与各指标相关关系均未达显著水平,当ρ(SMT)为40 mg·L-1时,SA仅与可溶性蛋白质含量呈极显著负相关关系。
3 结论
不同SAs对小白菜种子萌发的影响不同,SMT对小白菜种子萌发的抑制作用强于SA;SAs单一及复合污染下,随着SAs污染浓度的增加,小白菜的生理和生长均受到不同的抑制作用,小白菜的根伸长、芽伸长、鲜重和干重均降低,小白菜的叶绿素含量、可溶性蛋白质含量总体呈下降趋势;不同SAs对小白菜中POD活性、CAT活性的影响不同,总体均呈下降趋势。单一污染下,MDA含量随SA浓度增加而增加,而随SMT浓度增加,MDA含量先增加后降低,复合污染下呈下降趋势。小白菜体内SAs含量随环境中SAs浓度的增加而增加,小白菜对不同SAs的富集能力不同,对SMT的富集大于SA。相关性分析结果表明,SAs单一及复合污染条件下,SAs分别与小白菜的可溶性蛋白质含量、叶绿素含量、CAT活性和POD活性的相关性较好。在SAs污染下,小白菜的生理生长指标及品质均受到不同程度的影响,SAs也会通过富集进入小白菜体内,进而带来潜在的食品安全风险。
[1] 包艳萍.珠三角蔬菜中磺胺类抗生素污染特征研究[D].广州:暨南大学,2010.[BAO Yan-ping.The Study of Sulfonamides Antibiotics in Vegetables From Pearl River Delta[D].Guangzhou:Jinan University,2010.]
[2] 王健,贲伟伟,强志民,等.我国养猪业废弃物中四环素类、磺胺类抗生素及相关抗性基因污染研究进展[J].生态毒理学报,2015,10(5):2-10.[WANG Jian,BEN Wei-wei,QIANG Zhi-min,etal.Contamination of Tetracyclines,Sulfonamides and Corresponding Resistance Genes in the Waste From Chinese Pig Industry[J].Asian Journal of Ecotoxicology,2015,10(5):2-10.]
[3] 吴林海,谢旭燕.生猪养殖户认知特征与兽药使用行为的相关性研究[J].中国人口·资源与环境,2015,25(2):160-169.[WU Lin-hai,XIE Xu-yan.A Study About the Interrelation Between Pig Farmers′ Cognitive Characteristics and Behaviors on Veterinary Drugs Use[J].China Population,Resources and Environment,2015,25(2):160-169.]
[4] 潘寻,强志民,贲伟伟.高温堆肥对猪粪中多类抗生素的去除效果[J].生态与农村环境学报,2013,29(1):64-69.[PAN Xun,QIANG Zhi-min,BEN Wei-wei.Effects of High-Temperature Composting on Degradation of Antibiotics in Swine Manure[J].Journal of Ecology and Rural Environment,2013,29(1):64-69.]
[5] 常红,胡建英,王乐征,等.城市污水处理厂中磺胺类抗生素的调查研究[J].科学通报,2008,53(2):159-164.
[6] AWAD Y M,KIM S C,EI-AZEEM S A M A,etal.Veterinary Antibiotics Contamination in Water,Sediment,and Soil Near a Swine Manure Composting Facility[J].Environmental Earth Sciences,2014,71(3):1433-1440.
[7] AHMAD M,RAJAPAKSHA A U,LIM J E,etal.Biochar as a Sorbent for Contaminant Management in Soil and Water:A Review[J].Chemosphere,2014,99:19-33.
[8] 金彩霞,司晓薇,王子英,等.养殖场周边土壤-蔬菜系统磺胺类药物残留及风险评价[J].环境科学,2016,37(4):1562-1567.[JIN Cai-xia,SI Xiao-wei,WANG Zi-ying,etal.Distribution and Risk Assessment of Sulfonamides Antibiotics in Soil and Vegetables From Feedlot Livestock[J].Environmental Science,2016,37(4):1562-1567.]
[9] 成玉婷,吴小莲,向垒,等.广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J].中国环境科学,2017,37(3):1154-1161.[CHENG Yu-ting,WU Xiao-lian,XIANG Lei,etal.Distribution and Risk Assessment of Sulfonamide Antibiotics in Soil From Organic Vegetable Farms in Guangzhou[J].China Environmental Science,2017,37(3):1154-1161.]
[10] XIE X J,ZHOU Q X,LIN D S,etal.Toxic Effect of Tetracycline Exposure on Growth,Antioxidative and Genetic Indices of Wheat(TriticumaestivumL.)[J].Environmental Science and Pollution Research,2011,18(4):566-575.
[11] GILL S S,TUTEJA N.Reactive Oxygen Species and Antioxidant Machinery in Abiotic Stress Tolerance in Crop Plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[12] 程帆,赵艳茹,余克强,等.基于高光谱技术的病害早期胁迫下黄瓜叶片中过氧化物酶活性的研究[J].光谱学与光谱分析,2017,37(6):1861-1865.[CHENG Fan,ZHAO Yan-ru,YU Ke-qiang,etal.Application of Hyper-Spectra for Detecting Peroxidase Content in Cucumber Leaves With Early Disease Stress[J].Spectroscopy and Spectral Analysis,2017,37(6):1861-1865.]
[13] LIU X L,ZHANG S Z,SHAN X Q,etal.Combined Toxicity of Cadmium and Arsenate to Wheat Seedlings and Plant Uptake and Antioxidative Enzyme Responses to Cadmium and Arsenate Co-Contamination[J].Ecotoxicology and Environmental Safety,2007,68(2):305-313.
[14] 张明生,谢波,谈锋,等.甘薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J].中国农业科学,2003,36(1):13-16.[ZHANG Ming-sheng,XIE Bo,TAN Feng,etal.Relationship Among Soluble Protein,Chlorophyll and ATP in Sweet Potato Under Water Stress With Drought Resistance[J].Scientia Agricultura Sinica,2003,36(1):13-16.]
[15] 金彩霞,司晓薇,毛蕾,等.铜-磺胺嘧啶复合胁迫对蔬菜种子发芽的急性毒性效应[J].生态毒理学报,2015,10(5):164-171.[JIN Cai-xia,SI Xiao-wei,MAO Lei,etal.Acute Toxic Effect of Cu-Sulfadiazine Combined Stress on the Germination of Vegetable Seeds[J].Asian Journal of Ecotoxicology,2015,10(5):164-171.]
[16] 赵保真.Cu和磺胺嘧啶单一及复合污染的生态毒性效应研究[D].新乡:河南师范大学,2012.[ZHAO Bao-zhen.Study of the Ecology Toxic Effects of Single and Combined Pollution Between Cu and Sulfadiazine[D].Xinxiang:Henan Normal University,2012.]
[17] 沈伟其.测定水稻叶片中叶绿素含量的混合液提取法[J].植物生理学通报,1988,24(3):62-64.[SHEN Wei-qi.Extraction of Mixed Solution for Determination of Chlorophyll Content in Rice Leaf Blade[J].Plant Physiology Communications,1988,24(3):62-64.]
[18] 北京师范大学生物系生物化学教研室.基础生物化学实验[M].北京:高等教育出版社,1982:97-99.
[19] OHKAWA H,OHISHI N,YAGI K.Assay for Lipid Peroxides in Animal Tissues by Thiobarbituric Acid Reaction[J].Analytical Biochemistry,1979,95(2):351-358.
[20] 赵炀,李永生,高秀峰.基于愈创木酚荧光减量准确测定过氧化物酶活性的新方法[J].分析化学,2015,43(7):1040-1046.[ZHAO Yang,LI Yong-sheng,GAO Xiu-feng.A New Method for Accurate Determination of Peroxidase Activity Based on Fluorescence Decrease of Guaiacol[J].Chinese Journal of Analytical Chemistry,2015,43(7):1040-1046.]
[21] 余迪求,岑川,杨明兰,等.玉米不同组织过氧化氢酶水杨酸敏感性的差异和外源水杨酸处理提高玉米抗病性的研究[J].植物学报,1999,41(12):1293-1298.[YU Di-qiu,CEN Chuan,YANG Ming-lan,etal.Tissue Variance of Salicylic Acid-Sensitive Catalase and Enhancement of Disease Resistance With Exogenous Salicylic Acid in Maize[J].Acta Botanica Sinica,1999,41(12):1293-1298.]
[22] 徐慧敏,施婷婷,檀华蓉,等.高效液相色谱法同时测定蔬菜中有机酸与磺胺类抗生素[J].分析实验室,2016,35(10):1135-1139.[XU Hui-min,SHI Ting-ting,TAN Hua-rong,etal.Examination of Seven Organic Acids in Vegetables by High Performance Liquid Chromatography[J].Chinese Journal of Analysis Laboratory,2016,35(10):1135-1139.]
[23] 金彩霞,刘军军,陈秋颖,等.兽药污染土壤对小麦和白菜根伸长抑制的毒性效应[J].农业环境科学学报,2009,28(7):1358-1362.[JIN Cai-xia,LIU Jun-jun,CHEN Qiu-ying,etal.Toxicological Effects of Veterinary Drugs in Soil on the Inhibition of Root Elongation of Wheat and Chinese Cabbages[J].Journal of Agro-Environment Science,2009,28(7):1358-1362.]
[24] MIGLIORE L,CIVITAREALE C,COZZOLINO S,etal.Laboratory Modelsto Evaluate Phytotoxicity of Sulphadimethoxine on Terrestrial Plants[J].Chemosphere,1998,37(14/15):2957-2961.
[25] 伍泽堂.超氧自由基与叶片衰老时叶绿素破坏的关系[J].植物生理学通讯,1991,27(4):277-279.[WU Ze-tang.Relationship Between Superoxide Radical and Destruction of Chlorphyll During Leaf Senescence[J].Plant Physiology Communications,1991,27(4):277-279.]
[26] 顾国平,章明奎.兽药土霉素对水稻幼苗根系及部分生理特性的影响[J].浙江农业学报,2016,28(2):190-194.[GU Guo-ping,ZHANG Ming-kui.Effect of Oxytetracycline on Root Growth and Physiological Characteristics of Rice Seedlings[J].Acta Agriculturae Zhejiangensis,2016,28(2):190-194.]
[27] 高若松.Cd-磺胺间甲氧嘧啶单一及复合污染的生态毒性研究[D].新乡:河南师范大学,2011.[GAO Ruo-song.Study of the Ecology Toxic Effects of Single and Combined Pollution Between Cd and Sulfamononethoxine[D].Xinxiang:Henan Normal University,2012.]
[28] MELIDOOUA M,RIGANAKOSB K,GALARIS D.Protection Against Nuclear DNA Damage Offered by Flavonoids in Cells Exposed to Hydrogen Peroxide:The Role of Iron Chelation[J].Free Radical Biology and Medicine,2005,39(12):1591-1600.
[29] 徐敦明,马志卿,冯俊涛,等.毒死蜱和鬼臼毒素胁迫对蔬菜上海青抗氧化酶系及丙二醛的影响[J].农业环境科学学报,2004,23(6):1089-1092.[XU Dun-ming,MA Zhi-qing,FENG Jun-tao,etal.Effects of Chlorpyrifos and Podophyllotoxin on Anti-Oxidative Enzymes and the MDA of Vegetable(BrassicarapaL.)[J].Journal of Agro-Environment Science,2004,23(6):1089-1092.]
[30] 孟超敏,姬俊华,郑跃进.Pb2+、Cr3+单一及复合污染对小麦幼苗MDA积累及保护酶活性的影响[J].广东农业科学,2011,38(15):15-17.[MENG Chao-min,JI Jun-hua,ZHENG Yue-jin.Effects of Single or Combined Pollution of Heavy Metal Pb2+,Cr3+on MDA Accumulation and Protection Enzyme Activity of Wheat Seeding[J].Guangdong Agricultural Sciences,2011,38(15):15-17.]
[31] 杨惟薇,刘敏,曹美珠,等.不同玉米品种对重金属铅镉的富集和转运能力[J].生态与农村环境学报,2014,30(6):774-779.[YANG Wei-wei,LIU Min,CAO Mei-zhu,etal.Accumulation and Transfer of Lead (Pb) and Cadmium (Cd) on Different Species of Maize[J].Journal of Ecology and Rural Environment,2014,30(6):774-779.]
