经阴道三维能量多普勒超声评估35岁以内卵巢储备功能下降患者的卵巢血流灌注
2018-06-25徐子宁赵宏利
徐子宁 姚 洁 廉 华 赵宏利 马 娴
卵巢储备(ovarian reserve,OR)功能下降是指卵巢中存留的可募集卵泡数目减少及卵子质量下降到阈值以下。Scott等[1]研究表明,卵巢储备下降在<30岁时为 3%,30~34岁为 7%,35~39岁为 10%,40~44岁为26%,45岁时达100%,超过35岁可以预示卵巢低反应。然而,对于≤35岁的患者,年龄并不是一个敏感指标[2]。本研究排除年龄因素影响,关注≤35岁女性不明原因不孕和有明确病因如卵巢手术或疾病所导致的非生理性卵巢储备下降[3-4]。由于卵巢血供全程参与卵泡的生长、排卵、黄体形成,因此卵巢的周期性变化维持着正常的生殖生理,可能作为反映OR的指标。本研究旨在通过动态监测优势卵巢间质血流定量参数包括卵巢间质血管形成指数(vasculariza-tion index,VI)、血流指数(flow index,FI)、血管形成血流指数(vascularization flow index,VFI)来了解卵巢血供的变化进而评估卵巢储备功能。
1 资料与方法
1.1 临床资料 2015年6月—2016年12月,本院门诊就诊的不孕、月经周期不规则或正常女性,23-35岁,共计50例,无多囊卵巢综合征,无卵巢异常包块,2个月内未接受任何激素治疗。根据文献[5-7]拟定,10 IU/L<基础卵泡刺激素(bFSH)<40 IU/L、基础卵泡刺激素/基础黄体生成素(bFSH/bLH)≥3、抗苗勒管激素(AMH)≤1.26 ng/mL,窦卵泡计数(AFC)<6作为预测卵巢储备功能下降组(DOR)的指标组合,共计25例,其中卵巢囊肿剥除手术史2例,平均年龄(33.6±5.2)岁,不孕 2~5 年伴/不伴月经不规则、量少;bFSH≤10 IU/L、bFSH/bLH<3、AMH>1.26 ng/mL,6≤AFC<15作为预测卵巢储备功能正常组(NOR)的指标组合,共计25例,无卵巢手术史,平均年龄(29.5±6.4)岁,月经周期不规则或正常。对于在晚卵泡期未发现有直径≥16mm的优势卵泡生成者将被排除在研究之外。
1.2 血清性激素测定 于月经周期第2~4天采用电化学发光免疫法检测血清基础卵泡刺激素(bFSH)、基础黄体生成素(bLH)、抗苗勒管激素(AMH),检测2次,每次间隔1个月,结果取均值。
1.3 仪器与方法 GE Voluson E8彩色多普勒超声诊断仪,腔内容积探头RIC 5-9-D,患者体位稳定、呼吸平静,清晰完整显示双侧卵巢,启用sonoAVCTM于早卵泡期分别测定双侧卵巢窦卵泡数(插页图1);应用3D-PDA VOCALTM技术(能量多普勒增益-2.0~-1.0;脉冲重复频率 0.6KHz;壁滤波 Low 1;扇扫角度 90°;容积角度 90°)多平面成像模型,以 30°旋转纵轴切面,手动勾画6个卵巢切片边缘后,自动获取卵巢体积;玻璃体成像软件立体显示卵巢间质血管数量和分布(插页图2~3);最后启用血流直方图软件分别于早卵泡期和晚卵泡期获取双侧卵巢间质VI、FI、VF(I插页图4~5),每侧卵巢2次重建测值取均值。
1.4 优势卵巢的判断 以晚卵泡期出现直径≥16mm的卵泡侧卵巢作为优势卵巢,并回顾性确定早卵泡期某侧卵巢为优势卵巢。
1.5 超声检查时段 早卵泡期;自月经周期第10天开始每隔1~2天监测卵泡,当出现直径≥16mm的优势卵泡后缩短至1次/天直至其显示排卵征象。
1.6 统计学方法 应用SPSS17.0软件处理数据,定量资料数据呈正态分布者用均数±标准差(±s) 表示,组间比较采用t检验,相关分析应用Pearson相关分析;偏态分布者用P50(P25-P75)表示,组间比较采用Mann-Whitney检验,相关分析采用Spearman相关;P<0.05为差异有统计学意义。
2 结果
2.1 两组血清bFSH、bFSH/bLH、AMH、AFC比较本研究过程未发现同一周期有1个以上优势卵泡生成的情况。DOR组发生未破裂卵泡黄素化3例(3/25);NOR组发生未破裂卵泡黄素化 2例(2/25)。DOR组bFSH、bFSH/bLH水平高于NOR组(P均<0.01),AMH、AFC 水平比较低于 NOR 组 (P 均<0.01),见表 1。
2.2 相关性分析 Pearson相关分析显示,早卵泡期优势卵巢 FI与 AMH(r=0.734,P=0.000)、AFC(r=0.775,P=0.000)呈显著正相关,与bFSH/bLH(r=-0.830,P=0.000)、bFSH(r=-0.777)呈显著负相关。
表1 两组bFSH、bFSH/bLH、AMH、AFC水平比较(±s)
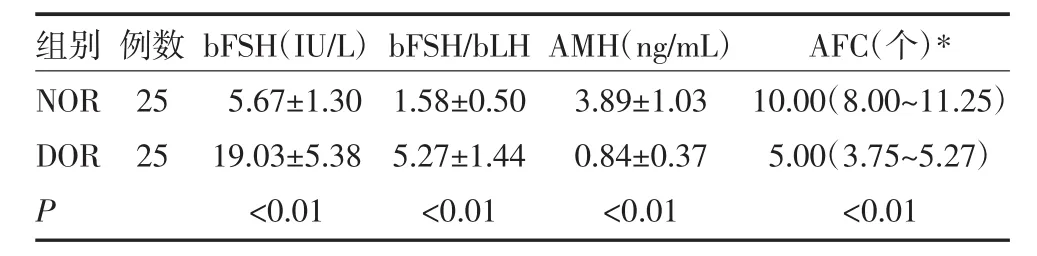
表1 两组bFSH、bFSH/bLH、AMH、AFC水平比较(±s)
注:AFC数据偏态分布,用P50(P25~P75)表示,组间比较采用Mann-Whitney检验。其他用(±s) 表示,组间比较采用t检验;NOR:卵巢储备功能正常组;DOR:卵巢储备功能下降组;bFSH:基础卵泡刺激素;bFSH/bLH:基础卵泡刺激素/基础黄体生成素;AMH:抗苗勒管激素;AFC:窦卵泡计数
组别NOR DOR P例数25 25 bFSH(IU/L)5.67±1.30 19.03±5.38<0.01 bFSH/bLH 1.58±0.50 5.27±1.44<0.01 AMH(ng/mL)3.89±1.03 0.84±0.37<0.01 AFC(个)*10.00(8.00~11.25)5.00(3.75~5.27)<0.01
2.3 两组VI、FI、VFI比较 两组早卵泡期优势卵巢的FI差异有统计学意义(P<0.05),两组晚卵泡期优势卵巢的VI、FI、VFI差异均有统计学意义(P<0.05或 P<0.01)。两组非优势卵巢的 VI、FI、VFI在早、晚卵泡期差异均无统计学意义(P>0.05),见表2~3。
2.4 两组早卵泡期和晚卵泡期优势卵巢VI、FI、VFI比较 两组优势卵巢早、晚卵泡期VI、FI、VFI差异有统计学意义(P均<0.05),见表 4。
3 讨论
国内外学者[8-9]认为,卵巢反应低下与间质血流灌注情况改变有关,基础状态下卵巢间质动脉血流可作为检测卵巢储备功能的指标之一。卵巢间质血流是维持卵泡库营养所必需,并且是每个月经周期募集的卵泡簇成熟并选择优势卵泡所必需的。始基卵泡没有单独血供而依赖间质动脉供血,随着卵泡发育,血管生成持续进行最终形成巨大微血管网,促进卵泡成熟[10]。Martelli等[11]认为正常排卵前成熟卵泡周围有丰富的微循环重建网络,使之有更多机会获取激素和氧气支持。动物实验[12]显示,阻断动物卵巢血管形成,将干扰正常的生理过程。
表2 两组患者早卵泡期卵巢VI、FI、VFI比较(±s)

表2 两组患者早卵泡期卵巢VI、FI、VFI比较(±s)
注:非优势侧卵巢FI偏态分布,用P50(P25~P75)表示;NOR:卵巢储备功能正常组;DOR:卵巢储备功能下降组;VI:卵巢间质血管形成指数;FI:血流指数;VFI:血管形成血流指数
49
表3 两组患者晚卵泡期卵巢VI、FI、VFI比较(±s)

表3 两组患者晚卵泡期卵巢VI、FI、VFI比较(±s)
注:优势侧卵巢FI偏态分布,用P50(P25~P75)表示;NOR:卵巢储备功能正常组;DOR:卵巢储备功能下降组;VI:卵巢间质血管形成指数;FI:血流指数;VFI:血管形成血流指数
组别DOR NOR P例数25 25优势卵巢非优势卵巢VI(%)9.60±1.83 12.00±2.98<0.05 FI 32.23(29.45~33.07)34.16(33.22~37.73)<0.01 VFI 2.43±0.46 3.11±0.41<0.01 VI(%)5.31±1.49 5.69±1.03>0.05 FI 29.99±1.28 29.70±2.08>0.05 VFI 1.51±0.33 1.69±0.31>0.05
表4 两组患者早卵泡期和晚卵泡期优势卵巢VI、FI、VFI比较(±s)

表4 两组患者早卵泡期和晚卵泡期优势卵巢VI、FI、VFI比较(±s)
注:优势侧卵巢FI偏态分布,用P50(P25~P75)表示;与早卵泡期比较,*P<0.05;NOR:卵巢储备功能正常组;DOR:卵巢储备功能下降组;VI:卵巢间质血管形成指数;FI:血流指数;VFI:血管形成血流指数
组别DOR NOR例数25 25早卵泡期晚卵泡期VI(%)6.05±1.04 7.00±1.86 FI 30.11±2.29 31.80(30.66~34.68)VFI 1.98±0.69 2.08±0.54 VI(%)9.60±1.83*12.00±2.98*FI 32.28±2.15*34.16(33.22-37.73)*VFI 2.43±0.46*3.11±0.41*
本研究发现,在早卵泡期优势卵巢VI、FI、VFI三个参数中,FI与 bFSH、bFSH/bLH、AMH、AFC 相关性良好,提示早卵泡期优势卵巢FI在一定程度上较之其它两个参数对OR的预测价值更佳。
通过回顾性分析,显示DOR组早卵泡期优势卵巢FI低于NOR组相应参数(P<0.05),DOR组晚卵泡期优势卵巢VI、FI、VFI均低于NOR组相应参数(P<0.05 或 P<0.01)。Hope等[13]发现口服避孕药的女性在整个卵泡期的卵巢间质VI、FI、VFI较之正常卵巢(无论排卵与否)相应数值高。尽管研究对象不同,但同样反映当卵巢功能低下时,卵巢血供会相应减少,本研究结果与之相近。Hope等[13]发现无论排卵与否,VI、FI、VFI在贯穿卵泡早、中期的增长之后,于卵泡晚期会有一个暂时下跌的阶段,绝对值甚至低于早卵泡期。而Jokubkiene等[14]认为对于具备正常月经周期的女性,优势卵巢血流参数在卵泡期增加,尤其VFI在正常排卵期前持续增高,而非优势卵巢的血流无明显变化。本研究支持Jokubkiene的结论,与Hope的后一观点相悖。优势卵巢VI、FI、VFI数值在卵泡期的增长意味着新生血管数量和血流密度提升,血流量丰富。但在DOR患者,虽然随着卵泡逐步发育卵巢血供较前增长,但新生血管数量和血流量仍存在不足。卵巢间质血流定量参数的变化与血流灌注的实际情况相平行,影响生育潜能的主因不是年龄而是非生理性趋于减少的卵巢血供。动态测定优势卵巢间质血流参数对于卵巢反应性更具评估价值。优势卵巢的早卵泡期 FI,晚卵泡期 VI、FI、VFI,以及VI、VFI在早、晚卵泡期的增长幅度将有助于DOR的早期筛选。
总之,三维能量多普勒超声的引入开拓了整体评估卵巢血供的新途径,能在卵泡早期和晚期量化间质血流,有利于研究血流灌注变化和卵巢储备之间的相关性。

图1 采用sonoAVCTM计数基础窦卵泡

图2 三维能量多普勒超声VOCAL技术玻璃体软件显示DOR组优势卵巢早卵泡期卵巢血供数量及分布

图3 三维能量多普勒超声VOCAL技术玻璃体软件显示NOR组优势卵巢晚卵泡期卵巢血供数量及分布

图4 三维能量多普勒超声VOCAL技术血流直方图软件显示DOR组非优势卵巢早卵泡期卵巢间质VI、FI、VFI

图5 三维能量多普勒超声VOCAL技术血流直方图软件显示NOR组优势卵巢晚卵泡期卵巢间质VI、FI、VFI
[1]Scott RT,Leonardi MR,Hofmann GE,et al.Aprospective evaluation of clomiphene citrate challenge test screening of the general infertility population[J].Obstet Gynecol,1993,82(4pt1):539-544
[2]邓波,章晓梅,任平,等.五种预测卵巢储备指标的临床研究[J].中国优生与遗传杂志,2006,14(4):102-104,106.
[3] Sun W,Stegmann BJ,Henne MA,et al.A new approach to ovarian reserve testing[J].Fertil Steril,2008,90(6):2196-2202.
[4] Deb S,Campbell BK,Pincott-Allen C.Quantifying effect of combined oral contraceptive pill on functional ovarian reserve as measured by serum anti-Mullerian hormone and small antral follicle count using three-dimensional ultrasound[J].Ultrasound Obstet Gynecol,2012,39:574-580.
[5]Spresso M,Oliani AH,Oliani DC.Value of the Ultrasound in the Study of Ovarian Reserve for Prediction of Oocyte Recovery[J].Rev Bras Ginecol Obstet,2016,38(10):499-505.
[6]Shrim A,Elizur SE,Seidman DS,et al.Elevated day 3 FSH/LH ration due to low LH concentrations predicts reduced ovrian response[J].Reprod Biomed Online,2006,12(4):418-422.
[7]Gnoth C,Schuring AN,Friol K.Relevance of anti-Mullerian hormone measurement in a routine IVF program[J].Hum Reprod,2008,23(6):1359-1365.
[8] Jokubkiene L,Sladkevicius P,Valentin L.Ovarian size and vascularization as assessed by three-dimensional grayscale and power Doppler ultrasound in asymptomatic women 20~39 years old using combined oral contraceptives[J].Contraception,2012,86(3):257-267.
[9]王伟群,张华,蔡款,等.经阴道彩色多普勒超声检查对卵巢储备功能下降患者卵巢基础状态的评价[J/CD].中华医学超声杂志(电子版),2011,8(7):1543-1548.
[10]Geva E,Jaffe RB.Role of vascular endothelial growth factor in ovarin physiology and pathology[J].Fertil Steril,2000,74(3):429-437.
[11]Martelli A,Berardinelli P,Russo V,et al.S patio-temporal analysis of vascularendothelial growth factor expression and blood vessel remodelling in pig ovarian follicles during the periovulatory period[J].J Mol Endocrinol,2006,36(1):107-119.
[12]Zimmermann RC,Xiao E,Husami N,et al.Short-term administration of antivascular endothelial growth factor antibody in the late follicular phase delays follicular development in the rhesus monkey[J].J Clin Endocrinol Melab,2001,86(2):768-772.
[13]Hope JM,Long K,Kudla M,et al.Three-Dimensional Power Doppler Angiography of Cyclic Ovarian Blood Flow[J].J Ultrasound Med,2009,28(8):1043-1052.
[14] Jokubkiene L,Sladkevicius P,Rovas L,et a1.Assessment of changes in volume and vascularity of the ovaries during the normal menstrual cycle using three-dimensional power Doppler ultrasound[J].Hum Reprod,2006,21(10):2661-2668.
